名校
1 . 某温度下,向密闭容器中充入等物质的量的 和
和 ,发生反应
,发生反应 。达到平衡后,下列说法正确的是
。达到平衡后,下列说法正确的是
 和
和 ,发生反应
,发生反应 。达到平衡后,下列说法正确的是
。达到平衡后,下列说法正确的是A.增大压强,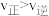 ,平衡常数增大 ,平衡常数增大 |
B.加入催化剂,平衡时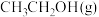 的浓度增大 的浓度增大 |
C.恒温下,移走一定量的 , , 变大, 变大, 变小 变小 |
D.恒容下,充入一定量的 ,平衡时 ,平衡时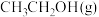 的体积分数一定降低 的体积分数一定降低 |
您最近一年使用:0次
2022-12-16更新
|
696次组卷
|
3卷引用:上海市行知中学2022-2023学年高二下学期2月月考化学试题
名校
2 .  可生产
可生产 并进而制得硫酸等,其反应原理为:
并进而制得硫酸等,其反应原理为: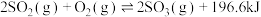 。下列说法正确的是
。下列说法正确的是
 可生产
可生产 并进而制得硫酸等,其反应原理为:
并进而制得硫酸等,其反应原理为: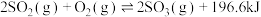 。下列说法正确的是
。下列说法正确的是| A.该反应在工业上需要在高温高压下进行 |
B.反应速率平衡后再通入 、 、 的体积分数一定增加 的体积分数一定增加 |
C.反应在高温、催化剂条件下进行可提高 的平衡转化率 的平衡转化率 |
D. 和 和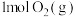 充分反应放出的热量小于196.6kJ 充分反应放出的热量小于196.6kJ |
您最近一年使用:0次
名校
3 . 根据实验测定,某容器中同时发生甲和乙两个反应:
反应甲:

反应乙:
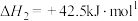
该容器中的反应达到平衡后,下列措施中一定能提高平衡体系中CH3OH的百分含量的是
反应甲:


反应乙:

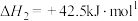
该容器中的反应达到平衡后,下列措施中一定能提高平衡体系中CH3OH的百分含量的是
| A.降低温度 | B.使用催化剂 |
| C.扩大容器体积 | D.在原料气中加入H2O(g) |
您最近一年使用:0次
2023-02-15更新
|
204次组卷
|
2卷引用: 上海交通大学附属中学2022-2023学年高三下学期开学摸底考试化学试题
名校
4 . 回答下列问题
(1)工业生产氢气时,常将水蒸气通过红热的炭即产生水煤气。
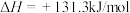 ,
,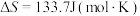 ,该反应在温度在
,该反应在温度在_______ 时能自发进行(“低温”或“高温”)。
(2)已知在400℃时,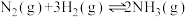 的
的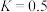
①在400℃时,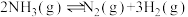 的
的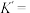
_______ (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得 、
、 、
、 的物质的量分别为2mol、1mol、2mol,则此时反应
的物质的量分别为2mol、1mol、2mol,则此时反应
_______  (填“>”、“<”、“=”或“不能确定”)。
(填“>”、“<”、“=”或“不能确定”)。
③一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有_______ (填字母)。
A.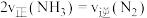
B.气体压强不再变化
C.气体的平均相对分子质量不再变化
D.单位时间每生成 3mol,同时消耗
3mol,同时消耗 2mol
2mol
(3)在某密闭容器中通入2mol 和2mol
和2mol ,在不同条件下发生反应
,在不同条件下发生反应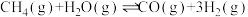 ,测得平衡时
,测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
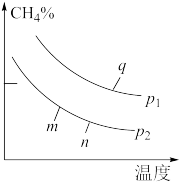
①
_______  (填“<”、“>”或“=”),该反应为
(填“<”、“>”或“=”),该反应为_______ (填“吸”或“放”)热反应。
②m、n、q三点的化学平衡常数大小关系为_______ 。
③若q点对应的纵坐标为30,此时甲烷的转化率为_______ 。
(4)实验测定该反应的化学平衡常数K随温度变化的曲线是如图中的_______ (填“a”、“b”),理由是_______ 。
(1)工业生产氢气时,常将水蒸气通过红热的炭即产生水煤气。

 ,
,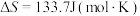 ,该反应在温度在
,该反应在温度在(2)已知在400℃时,
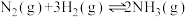 的
的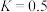
①在400℃时,
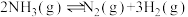 的
的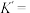
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得
 、
、 、
、 的物质的量分别为2mol、1mol、2mol,则此时反应
的物质的量分别为2mol、1mol、2mol,则此时反应
 (填“>”、“<”、“=”或“不能确定”)。
(填“>”、“<”、“=”或“不能确定”)。③一定温度下,在恒容的密闭容器中发生上述反应,下列表示反应达到平衡状态的有
A.
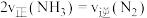
B.气体压强不再变化
C.气体的平均相对分子质量不再变化
D.单位时间每生成
 3mol,同时消耗
3mol,同时消耗 2mol
2mol(3)在某密闭容器中通入2mol
 和2mol
和2mol ,在不同条件下发生反应
,在不同条件下发生反应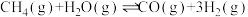 ,测得平衡时
,测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
①

 (填“<”、“>”或“=”),该反应为
(填“<”、“>”或“=”),该反应为②m、n、q三点的化学平衡常数大小关系为
③若q点对应的纵坐标为30,此时甲烷的转化率为
(4)实验测定该反应的化学平衡常数K随温度变化的曲线是如图中的

您最近一年使用:0次
名校
5 . 反应
 ,在一定条件下的密闭容器中达到平衡。下列措施不能提高乙烷平衡转化率的是
,在一定条件下的密闭容器中达到平衡。下列措施不能提高乙烷平衡转化率的是

 ,在一定条件下的密闭容器中达到平衡。下列措施不能提高乙烷平衡转化率的是
,在一定条件下的密闭容器中达到平衡。下列措施不能提高乙烷平衡转化率的是| A.增大容器容积 | B.升高温度 | C.分离出 | D.再充入 |
您最近一年使用:0次
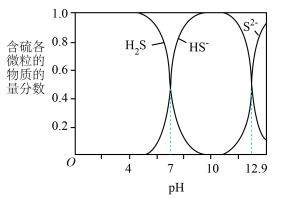
6 . 向pH≈10的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。
(2)pH≈10时,溶液中硫元素的主要存在形态为___________ 。
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:___________ 。
 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入
 溶液后pH降低的原因:
溶液后pH降低的原因:
您最近一年使用:0次
名校
7 . 向 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图

(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____
(2) 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为_____
(3)用化学平衡移动原理解释向 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:_____ 。
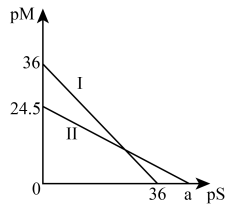
(4)某温度下,CuS和 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,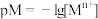 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为(3)用化学平衡移动原理解释向
 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:(4)某温度下,CuS和
 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,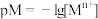 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
A.曲线Ⅱ代表的是 | B. |
C.此温度下CuS的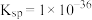 | D.此温度下的饱和溶液中 |
您最近一年使用:0次
名校
解题方法
8 . 一定条件下,在固定容积的密闭容器中发生反应: ,图Ⅰ是该反应中能量变化示意图,图Ⅱ表示某平衡量Y随X的变化关系,下列说法中正确的是
,图Ⅰ是该反应中能量变化示意图,图Ⅱ表示某平衡量Y随X的变化关系,下列说法中正确的是

 ,图Ⅰ是该反应中能量变化示意图,图Ⅱ表示某平衡量Y随X的变化关系,下列说法中正确的是
,图Ⅰ是该反应中能量变化示意图,图Ⅱ表示某平衡量Y随X的变化关系,下列说法中正确的是
A.一定条件下,向密闭容器中加入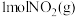 与1 mol CO(g)反应放出234kJ热量 与1 mol CO(g)反应放出234kJ热量 |
B.若X表示CO的起始浓度,则Y表示的可能是 的转化率 的转化率 |
| C.若X表示反应时间,则Y表示的可能是混合气体的密度 |
D.若X表示温度,则Y表示的可能是 的物质的量浓度 的物质的量浓度 |
您最近一年使用:0次
2021-04-17更新
|
222次组卷
|
2卷引用:上海交通大学附属中学2019-2020学年高一下学期期中调研化学试卷
名校
9 . 某温度下恒容密闭容器中进行如下两个反应并达到平衡,下列叙述错误的是
①2X(g)+Y(g) Z(s)+ 2W(g)+Q1 (Q1>0)
Z(s)+ 2W(g)+Q1 (Q1>0)
②M(g)+N(g) R(g)+W(g)-Q2 (Q2>0)
R(g)+W(g)-Q2 (Q2>0)
①2X(g)+Y(g)
 Z(s)+ 2W(g)+Q1 (Q1>0)
Z(s)+ 2W(g)+Q1 (Q1>0) ②M(g)+N(g)
 R(g)+W(g)-Q2 (Q2>0)
R(g)+W(g)-Q2 (Q2>0)| A.加入适量Z,①和②平衡均不移动 | B.通入稀有气体Ar,①平衡正向移动 |
| C.降温时无法判断W浓度的增减 | D.通入Y,则N的浓度增大 |
您最近一年使用:0次
2021-03-30更新
|
220次组卷
|
5卷引用:上海交通大学附属中学2021届高三下学期3月月考化学试题
上海交通大学附属中学2021届高三下学期3月月考化学试题上海市青浦区2021届高三等级考二模化学试题黑龙江省佳木斯学校(佳木斯市实验中学)2021-2022学年高二上学期第二次月考化学试题上海市控江中学2022-2023学年高三上学期第一次月考化学试题(已下线)第七章 化学反应速率与化学平衡 第43讲 化学平衡移动原理及应用
名校
10 . 硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
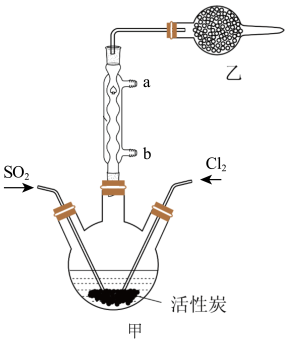
I.SO2Cl2的制备
(1)水应从___ (选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___ (填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___ 。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___ 。
(5)反应结束后,分离甲中混合物的最佳实验操作是___ 。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___ 。
(7)产品中SO2Cl2的质量分数为___ %,若步骤③不加入硝基苯则所测SO2Cl2含量将___ (填“偏高”、“偏低”或“无影响”)。
 SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
I.SO2Cl2的制备
(1)水应从
(2)制取SO2的最佳组合是
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是
(4)制备过程中需要将装置甲置于冰水浴中,原因是
(5)反应结束后,分离甲中混合物的最佳实验操作是
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为
(7)产品中SO2Cl2的质量分数为
您最近一年使用:0次
2019-12-10更新
|
482次组卷
|
3卷引用:上海大学附属中学2021-2022学年学高三下学期第一次测试化学试题



