名校
解题方法
1 . 反应mX(g) nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
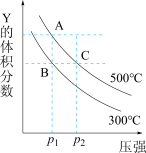
 nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
| A.该反应的ΔH>0 | B.m<n+p |
| C.B、C两点化学平衡常数:KB>KC | D.A、C两点的反应速率v(A)<v(C) |
您最近一年使用:0次
2022-09-15更新
|
2039次组卷
|
47卷引用:上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题
上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题2015-2016学年浙江台州中学高二上第三次统练化学试卷内蒙古自治区北京八中乌兰察布分校2018-2019学年高二下学期第一次月考化学试题湖北省随州二中2019-2020学年高二上学期9月份月考化学试题河南省新野县第一高级中学2019-2020学年高二上学期第二次月考化学试题甘肃省镇原县镇原中学2019-2020学年高二上学期期中考试化学(理)试题甘肃省镇原县镇原中学2019-2020学年高一上学期期中考试化学(理)试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)2020年北京高二下学期 复习模拟试题二(选修4人教版)安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题(已下线)练习7 化学平衡(二)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)重庆市暨华中学校2021-2022学年高二上学期第一次月考化学试题四川省广安市武胜烈面中学校2021-2022学年高二10月月考化学试题天津市武清区崔黄口中学2021-2022学年高二上学期第一次练习化学试题重庆市永川景圣中学校2021-2022学年高二上学期第一次月考化学试题河南省平顶山九校联盟2021-2022学年高二上学期期中考试化学试题四川省广安市2021-2022学年高二上学期期末考试化学试题河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题吉林省长春市第六中学2021-2022学年高二上学期第三学程考试(理)化学试题陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题天津市武清区四校2022-2023学年高二上学期第一次阶段性练习化学试题贵州省黔西南州金成实验学校2022-2023学年高二上学期9月月考化学试题重庆市江津中学2022-2023学年高二上学期10月阶段性考试化学试题山东省滕州市第一中学2022-2023学年高二上学期11月月考化学试题湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题湖南省长沙市长郡中学2022--2023学年高二上学期第二次线上月考化学试题新疆昌吉州行知学校2022-2023学年高二上学期第一次线上月考化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题辽宁省部分重点中学2022-2023学年高二上学期期末联考化学试题山东省泰安市宁阳县复圣中学2022-2023学年高二上学期期末考试化学试题湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题 重庆市育才中学校2022-2023学年高二上学期期中考试化学试题辽宁省丹东市第二中学 大石桥市第三高级中学2022-2023学年高二上学期期末联考化学试题四川省宜宾市第四中学校2023-2024学年高二上学期9月月考化学试题四川省广安市岳池县第一中学2023-2024学年高二上学期第一次月考化学试题重庆市荣昌中学校2023-2024学年高二上学期期中考试化学试题四川省内江市威远中学校2023-2024学年高二上学期期中考试化学试题新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期期中考试化学(理科)试题四川省内江市威远中学校2023-2024学年高二上学期第二次月考(期中)化学试卷陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(三)化学试题陕西省宝鸡市渭滨区2023-2024学年高二上学期期末考试化学试题河南省焦作市博爱县第一中学2023-2024学年高三上学期1月期末化学试题 贵州省遵义市仁怀市第六中学2023-2024学年高二上学期期中考试化学试题河南省驻马店市环际大联考2023-2024学年高二上学期11月期中考试化学试题福建省泉州市泉州中远学校2023-2024学年高二上学期11月期中化学试题
名校
2 . 下列事实能用勒夏特列原理来解释的是
A.实验室采用排饱和食盐水的方法收集氯气Cl2+H2O H++Cl-+HClO H++Cl-+HClO |
B.工业上合成氨反应N2(g)+3H2(g) 2NH3(g) △H<0选择500℃ 2NH3(g) △H<0选择500℃ |
C.H2、I2、HI平衡混合气体加压后颜色加深H2(g)+I2(g) 2HI(g) 2HI(g) |
D.SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g) 2SO3(g) 2SO3(g) |
您最近一年使用:0次
2022-08-25更新
|
418次组卷
|
10卷引用:上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题
上海市奉贤中学2022-2023学年高二上学期10月阶段测试化学试题重庆市九校联盟2017-2018学年高二上学期期中考试化学试题【区级联考】天津市武清区2018-2019学年高二上学期期中质量调查化学试题湖南省永州市双牌县第二中学2019-2020学年高二上学期期中考试化学试题(选考)辽宁省辽河油田第二高级中学2021-2022学年高二上学期开学考试化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题吉林省长春市第二十中学2021-2022学年高二上学期第一次质量检测化学试题新疆昌吉州2021-2022学年高二上学期期中质量检测化学试题江西省宜春市万载中学2021-2022学年高二上学期第二次月考化学试题重庆市渝东六校共同体2022-2023学年高二上学期联合诊断考试化学试题
3 . 在密闭容器中进行反应N2(g)+3H2(g)⇌2NH3(g),达到平衡时,若温度保持不变,增加N2的浓度,则
| A.正反应速率一直增大 | B.逆反应速率先减小 |
| C.化学平衡向正反应方向移动 | D.化学平衡向逆反应方向移动 |
您最近一年使用:0次
名校
4 . 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:
 。下列说法
。下列说法
| A.饮食中摄入过多食盐,会加重痛风病病情 | B.大量饮水会增大痛风病发作的可能性 |
| C.寒冷季节更易诱发关节疼痛 | D.患痛风病的人应少吃能代谢产生更多尿酸的食物 |
您最近一年使用:0次
2024-02-21更新
|
161次组卷
|
41卷引用:上海市奉贤区2020届高三5月教学质量调研(二模)化学试题
上海市奉贤区2020届高三5月教学质量调研(二模)化学试题北京市西城区2019-2020学年度高二上学期期末考试化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题北京市第四十三中学2020-2021学年高二上学期12月月考化学试题辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题北京市房山区2020-2021学年高二上学期期末考试化学试题河南省焦作市县级重点中学2021-2022学年高二上学期期中考试化学试题吉林省长白山第二高级中学校2021-2022学年高三上学期第二次月考化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2021-2022学年高二上学期期中考试化学试题 北京市房山区2022-2023学年高二上学期期中质量检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题北京市顺义区2023届高三第一次统练化学试题广东省汕头市聿怀中学2022-2023学年高二上学期期末线上考试化学试题安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题(已下线)专题15 化学反应速率和化学平衡新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期11月期中检测化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第六十六中学2023-2024学年高二上学期期中质量检测化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高二上学期11月期中考试化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题河南省信阳市淮滨县2022-2023学年高二上学期11月期中考试化学试题甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题四川省内江市2025届第三中学高二上学期化学试卷北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题北京市顺义区2022-2023学年高三上学期第一次统练化学试卷
5 . 勒夏特列原理在生产生活中有许多重要应用。完成下列填空:
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止________________________ 。
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色) H++Z—(蓝色)。在中性溶液中。石蕊试液呈
H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________ 色;要使石蕊试液呈红色,可加入____________________________ 。
(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是_______________________ 。
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是_________ (选填编号)。
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)
 H++Z—(蓝色)。在中性溶液中。石蕊试液呈
H++Z—(蓝色)。在中性溶液中。石蕊试液呈(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
您最近一年使用:0次
2019-07-01更新
|
261次组卷
|
2卷引用:上海市奉贤区致远高级中学2021-2022学年高二上学期期中教学评估(合格考)化学试题
2012·上海奉贤·二模
6 . 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
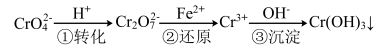
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显____________ 色.
(2)能说明第①步反应达平衡状态的是_____________ 。
a Cr2O72-和CrO42-的浓度相同 b 2v(Cr2O72-)=v(CrO42-)
c 溶液的颜色不变 d.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要________ mol的FeSO4·7H2O。
(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2-(亮绿色)+H2O Cr(OH)3(s)
Cr(OH)3(s) Cr3+(紫色)+ 3OH-
Cr3+(紫色)+ 3OH-
下列有关说法中正确的是_______
a 加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b 在一定条件下存在:Cr(OH)3+OH-=CrO2-+2H2O;Cr(OH)3+3H+=Cr3++3H2O
c Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d Cr(OH)3(固)在水中的存在叁个平衡

其中第①步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)若平衡体系的pH=2,则溶液显
(2)能说明第①步反应达平衡状态的是
a Cr2O72-和CrO42-的浓度相同 b 2v(Cr2O72-)=v(CrO42-)
c 溶液的颜色不变 d.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要
(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2-(亮绿色)+H2O
 Cr(OH)3(s)
Cr(OH)3(s) Cr3+(紫色)+ 3OH-
Cr3+(紫色)+ 3OH-下列有关说法中正确的是
a 加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b 在一定条件下存在:Cr(OH)3+OH-=CrO2-+2H2O;Cr(OH)3+3H+=Cr3++3H2O
c Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d Cr(OH)3(固)在水中的存在叁个平衡
您最近一年使用:0次
9-10高二下·江苏·期末
7 . 金属卤化物与卤素化合可生成多卤化物,如KI + I2 KI3,有关KI3的叙述中错误的是
KI3,有关KI3的叙述中错误的是
 KI3,有关KI3的叙述中错误的是
KI3,有关KI3的叙述中错误的是 | A.I2在KI溶液中溶解度增大是由于生成了I3- |
B.I3-在溶液中存在平衡:I3- I2 + I- I2 + I- |
| C.KI3溶液遇淀粉不呈蓝色 |
| D.将氯气通入KI3溶液中,I3-浓度减小 |
您最近一年使用:0次
8 . 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷还能让心脏有规律地跳动、维持肾脏正常机能和传达神经刺激的重要物质。许多磷的化合物是工业上的重要原料。请完成下列填空:
P(s,红磷)+ O2(g)=
O2(g)= P4O10(s)+738.5 kJ
P4O10(s)+738.5 kJ
P4(s,白磷)+ 5O2(g)=P4O10(s)+2983.2 kJ
(1)则白磷转化为红磷的热化学方程式_____________________ 。
(2)红磷在KOH溶液的悬浊液中和KOCl作用,可以生成K6P6O12的钾盐和KCl等产物。请写出该反应的化学方程式,并标出电子转移方向和数目。____
(3)制备MgNH4PO4时通常在镁盐(如氯化镁)溶液中加Na2HPO4 、氨水和铵盐溶液(如氯化铵),反应式为MgCl2+Na2HPO4+NH3=2NaCl+MgNH4PO4↓。在此反应中,如果不加铵盐,在碱性溶液中,Mg2+将会被氨水沉淀,其离子方程式为____________________ ;加入铵盐之后,可防止产生Mg(OH)2沉淀。请用电离平衡原理解释原因:_________
(4)H3PO3与碘水反应,碘水的棕黄色褪去,生成磷酸,向上述反应后的溶液中加入过量的AgNO3溶液,生成黄色沉淀。则H3PO3与碘水反应的化学方程式为___________ ;黄色沉淀是_________ ,可用作于_____________________ (写出任意一种用途即可)。
P(s,红磷)+
 O2(g)=
O2(g)= P4O10(s)+738.5 kJ
P4O10(s)+738.5 kJ P4(s,白磷)+ 5O2(g)=P4O10(s)+2983.2 kJ
(1)则白磷转化为红磷的热化学方程式
(2)红磷在KOH溶液的悬浊液中和KOCl作用,可以生成K6P6O12的钾盐和KCl等产物。请写出该反应的化学方程式,并标出电子转移方向和数目。
(3)制备MgNH4PO4时通常在镁盐(如氯化镁)溶液中加Na2HPO4 、氨水和铵盐溶液(如氯化铵),反应式为MgCl2+Na2HPO4+NH3=2NaCl+MgNH4PO4↓。在此反应中,如果不加铵盐,在碱性溶液中,Mg2+将会被氨水沉淀,其离子方程式为
(4)H3PO3与碘水反应,碘水的棕黄色褪去,生成磷酸,向上述反应后的溶液中加入过量的AgNO3溶液,生成黄色沉淀。则H3PO3与碘水反应的化学方程式为
您最近一年使用:0次
14-15高三上·上海奉贤·期末
解题方法
9 . 工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。常用的处理方法有两种。
方法1:还原沉淀法。
该法的工艺流程为:
其中第①步存在平衡:2 CrO42-(黄色)+2H+ Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
(1)若第①步中平衡体系的pH=2,则该溶液显_________ 色;向该溶液中加入Ba(NO3)2溶液(已知BaCrO4
为黄色沉淀)则平衡_________ 移动(填“向左”或“向右”或“不变”),溶液颜色将_________ 。
(2)能说明第①步反应达平衡状态的是_________ (选填编号)
A Cr2O72-和CrO42-的浓度相同 B 2υ(Cr2O72-)=υ(CrO42-) C 溶液的颜色不变
(3)若改变条件使平衡状态的第①步反应向正反应方向移动,则该反应_________ (选填编号)
A 平衡常数K值可以不改变 B 再达平衡前正反应速率一定大于逆反应速率
C Cr2O72-的浓度一定增大 D 平衡移动时正反应速率一定先增大后减小
(4)第②步中,还原1 mol Cr2O72-离子,需要_________ mol的FeSO4•7H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至_________ 。
方法2:电解法。
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)用Fe做电极的原因为________ 。
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)_________ ,溶液中同时生成的沉淀还有________ 。
方法1:还原沉淀法。
该法的工艺流程为:

其中第①步存在平衡:2 CrO42-(黄色)+2H+
 Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O(1)若第①步中平衡体系的pH=2,则该溶液显
为黄色沉淀)则平衡
(2)能说明第①步反应达平衡状态的是
A Cr2O72-和CrO42-的浓度相同 B 2υ(Cr2O72-)=υ(CrO42-) C 溶液的颜色不变
(3)若改变条件使平衡状态的第①步反应向正反应方向移动,则该反应
A 平衡常数K值可以不改变 B 再达平衡前正反应速率一定大于逆反应速率
C Cr2O72-的浓度一定增大 D 平衡移动时正反应速率一定先增大后减小
(4)第②步中,还原1 mol Cr2O72-离子,需要
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至方法2:电解法。
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)用Fe做电极的原因为
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)
您最近一年使用:0次



