解题方法
1 . 某温度下,等物质的量的碘和环戊烯(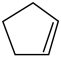 )在刚性容器内发生反应生成环戊二烯(
)在刚性容器内发生反应生成环戊二烯( ):
):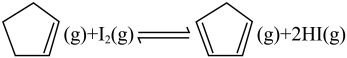
 。达到平衡后,采取以下措施是不能增加环戊烯的平衡转化率的是
。达到平衡后,采取以下措施是不能增加环戊烯的平衡转化率的是
 )在刚性容器内发生反应生成环戊二烯(
)在刚性容器内发生反应生成环戊二烯( ):
):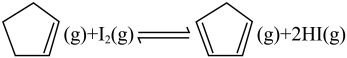
 。达到平衡后,采取以下措施是不能增加环戊烯的平衡转化率的是
。达到平衡后,采取以下措施是不能增加环戊烯的平衡转化率的是| A.增加环戊烯浓度 | B.增加碘浓度 |
| C.及时分离环戊二烯 | D.提高温度 |
您最近一年使用:0次
2 . 在密闭容器中发生反应: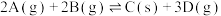
 ,达到平衡时采取下列措施,能使正反应速率
,达到平衡时采取下列措施,能使正反应速率 和A的转化率均增大的是
和A的转化率均增大的是
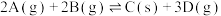
 ,达到平衡时采取下列措施,能使正反应速率
,达到平衡时采取下列措施,能使正反应速率 和A的转化率均增大的是
和A的转化率均增大的是| A.移走少量C | B.降低温度 |
| C.缩小容积,增大压强 | D.容积不变,充入Ar |
您最近一年使用:0次
名校
解题方法
3 . HNO3是重要的化工原料,浓HNO3与Cu反应的装置如图1所示:
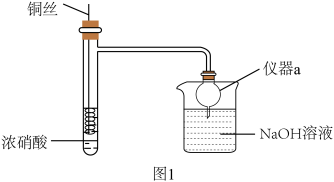
回答下列问题:
(1)仪器a的名称是_______ ,在该实验中的作用为_______ 。
(2)关于该实验下列说法错误的是_______。
(3)某小组同学发现Cu与浓HNO3反应所得混合溶液为绿色,Cu与稀HNO3反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈_______ 色,证明猜想a不成立。
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到_______ ,5min后,溶液完全变为蓝色,证明猜想b成立。
(4)另一组同学查阅资料发现:NO2能与水反应生成HNO2,进而发生下述反应:
①由此该组同学认为通过实验说明猜想b成立不严谨,理由是_______ 。
②写出NO2与水反应生成HNO2的化学方程式_______ 。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是_______ 。

回答下列问题:
(1)仪器a的名称是
(2)关于该实验下列说法错误的是_______。
| A.该反应需要加热才能进行 | B.可通过抽动铜丝控制反应开始和停止 |
| C.反应后迅速生成大量红棕色气体 | D.烧杯中仅发生中和反应 |
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到

(4)另一组同学查阅资料发现:NO2能与水反应生成HNO2,进而发生下述反应:

①由此该组同学认为通过实验说明猜想b成立不严谨,理由是
②写出NO2与水反应生成HNO2的化学方程式
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是
您最近一年使用:0次
2023-02-09更新
|
1337次组卷
|
3卷引用:广东省佛山市2023届普通高中教学质量检测(一)化学试题
4 . 已知反应: 。起始以物质的量之比为1:1充入反应物,不同压强条件下,
。起始以物质的量之比为1:1充入反应物,不同压强条件下, 的平衡转化率随温度的变化情况如图所示(M、N点标记为▲)。下列有关说法正确的是
的平衡转化率随温度的变化情况如图所示(M、N点标记为▲)。下列有关说法正确的是

 。起始以物质的量之比为1:1充入反应物,不同压强条件下,
。起始以物质的量之比为1:1充入反应物,不同压强条件下, 的平衡转化率随温度的变化情况如图所示(M、N点标记为▲)。下列有关说法正确的是
的平衡转化率随温度的变化情况如图所示(M、N点标记为▲)。下列有关说法正确的是
A.降低温度, 的转化率可达到100% 的转化率可达到100% |
| B.N点时的反应速率一定比M点的快 |
| C.降低温度,该反应平衡常数K一定减小 |
D.从平衡混合气中分离出 和 和 ,可提高 ,可提高 和 和 的利用率 的利用率 |
您最近一年使用:0次
22-23高二上·浙江·期中
名校
5 . 关于甲醇制氢反应CH3OH(g)+H2O(g) CO2(g)+3H2(g) ∆H>0,既可以加快反应速率,又可以提高H2平衡产率的措施有
CO2(g)+3H2(g) ∆H>0,既可以加快反应速率,又可以提高H2平衡产率的措施有
 CO2(g)+3H2(g) ∆H>0,既可以加快反应速率,又可以提高H2平衡产率的措施有
CO2(g)+3H2(g) ∆H>0,既可以加快反应速率,又可以提高H2平衡产率的措施有| A.加入催化剂 | B.增大压强 | C.升高温度 | D.降低CO2(g)浓度 |
您最近一年使用:0次
名校
解题方法
6 . 用下列装置不能达到实验目的的是
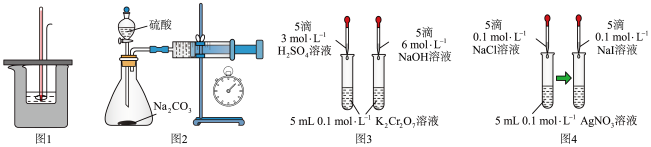

| A.图1:测量强酸强碱中和反应的反应热 |
B.图2:测定 和稀硫酸反应的速率 和稀硫酸反应的速率 |
| C.图3:验证浓度对化学平衡的影响 |
D.图4:证明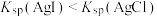 |
您最近一年使用:0次
2023-01-14更新
|
362次组卷
|
3卷引用:广东省佛山市2022~2023学年高二上学期期末考试化学试题
名校
7 . 小组同学探究盐溶液对反应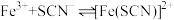 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ. (黄色)
(黄色)
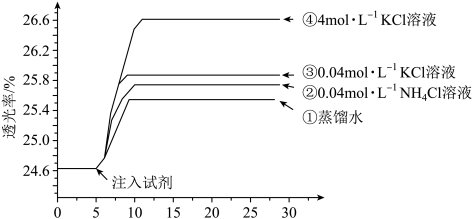
下列说法不正确的是
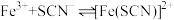 (血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。
(血红色)的影响。将2mL0.01mol/LFeCl3的溶液与2mL0.02mol/L的KSCN溶液混合,分别加入等体积的试剂①~④,测得平衡后体系的透光率如下图所示。已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略。
ⅱ.
 (黄色)
(黄色)
下列说法不正确的是
A.注入试剂①后溶液透光率增大,一定是由于 平衡逆向移动引起的 平衡逆向移动引起的 |
| B.透光率③比②高,可能是阳离子种类或溶液pH导致的 |
C.透光率④比③高,可能发生了反应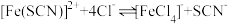 |
D.若要证明试剂③中Cl—对平衡体系有影响,还应使用与试剂③等体积的0.04mol/L的KNO3溶液进行对比实验(已知NO 对实验无影响) 对实验无影响) |
您最近一年使用:0次
2023-01-13更新
|
653次组卷
|
9卷引用:广东省华南师范大学附属中学2022届高三下学期押题预测(一)化学试题
名校
8 . NO在催化剂条件下可被 H2还原为无害物质,反应为:2H2(g)+2NO(g) N2(g)+2H2O(g),在密闭容器中按c(NO)∶c(H2)=1∶1充入,反应结果如图,下列说法正确的是
N2(g)+2H2O(g),在密闭容器中按c(NO)∶c(H2)=1∶1充入,反应结果如图,下列说法正确的是
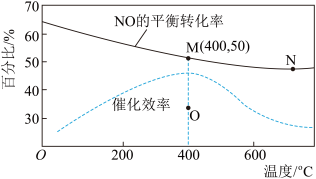
 N2(g)+2H2O(g),在密闭容器中按c(NO)∶c(H2)=1∶1充入,反应结果如图,下列说法正确的是
N2(g)+2H2O(g),在密闭容器中按c(NO)∶c(H2)=1∶1充入,反应结果如图,下列说法正确的是
| A.若投料比不变,增大起始时c(NO)和c(H2), 可以提高NO平衡转化率 |
| B.其它条件不变,将水蒸气分离出来,可以增大反应速率和NO平衡转化率 |
| C.N点比M点的平衡常数大 |
| D.若不用催化剂,M点平衡转化率会降至O点 |
您最近一年使用:0次
2023-01-09更新
|
648次组卷
|
3卷引用:广东省深圳市福田区红岭中学2022-2023学年高三下学期第五次模拟化学试题
名校
解题方法
9 . 下列实验操作对应的现象和结论均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向FeCl3和KSCN混合溶液中加入少量KCl固体 | 溶液颜色变浅 | 平衡FeCl3+3KSCN Fe(SCN)3+3KCl向逆反应方向移动 Fe(SCN)3+3KCl向逆反应方向移动 |
| B | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸性:HX<HY |
| C | 将0.1mol/L的氨水稀释为0.01mol/L,测量稀释前后溶液pH | 稀释后pH减小 | 稀释后氨水的电离程度减小 |
| D | 向浓度均为0.1mol•L-1的NaCl与NaI的混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-09更新
|
160次组卷
|
2卷引用:广东省江门市第一中学2022-2023学年高二上学期期末考试(线上考试)化学试题
名校
解题方法
10 . “绿水青山就是金山银山”,现在人们越来越注重对环境的保护,污水的处理和废旧电池的回收成为环境保护的重要课题。
Ⅰ.工业上常用还原沉淀法处理含铬废水(Cr2O 和CrO
和CrO ),其流程为
),其流程为
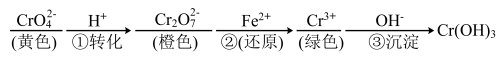
已知步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
(1)步骤①中存在反应2CrO +2H+
+2H+ Cr2O
Cr2O +H2O,若向K2Cr2O7溶液中加NaOH浓溶液,能出现的现象是
+H2O,若向K2Cr2O7溶液中加NaOH浓溶液,能出现的现象是_______ ,原因是 _______ 。
(2)步骤③中,当将溶液的pH调节至_______ 时,可认为废水中的铬元素已基本除尽。(当溶液中c(Cr3+)≤10-5mol·L-1时,可视作该离子沉淀完全)
Ⅱ.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
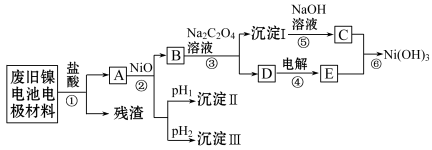
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(3)根据上表数据判断步骤②依次析出沉淀Ⅱ_______ 和沉淀Ⅲ_______ (填化学式),则pH1_______ pH2(填“>”“=”或“<”)。
(4)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是_______ 。第③步反应后的操作名称是 _______ 。
(5)试写出⑥的离子方程式_______ 。
Ⅰ.工业上常用还原沉淀法处理含铬废水(Cr2O
 和CrO
和CrO ),其流程为
),其流程为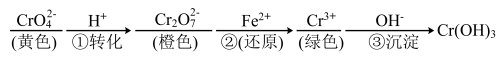
已知步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。(1)步骤①中存在反应2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O,若向K2Cr2O7溶液中加NaOH浓溶液,能出现的现象是
+H2O,若向K2Cr2O7溶液中加NaOH浓溶液,能出现的现象是(2)步骤③中,当将溶液的pH调节至
Ⅱ.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(3)根据上表数据判断步骤②依次析出沉淀Ⅱ
(4)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是
(5)试写出⑥的离子方程式
您最近一年使用:0次



