1 . 回答下列问题。
(1)已知下列热化学方程式:
Ⅰ.
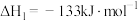
Ⅱ.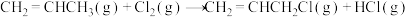
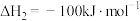
在相同条件下, 的正反应的活化能
的正反应的活化能 为
为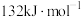 ,则逆反应的活化能
,则逆反应的活化能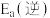 为
为___________  。
。
(2)查阅资料得知,反应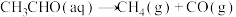 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:
第Ⅰ步反应为 (慢反应);
(慢反应);
第Ⅱ步为快反应。
增大I2的浓度___________ (填“能”或“不能”)明显增大总反应的平均速率,理由为___________ 。
(3)氯化铜晶体(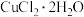 )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
___________ (填字母,下同)。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的___________ 。
a.Cu b.CuO c.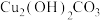 d.NaOH
d.NaOH
③SOCl2与水反应的化学方程式为___________ 。
④SOCl2与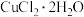 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是___________ 。
(1)已知下列热化学方程式:
Ⅰ.

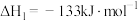
Ⅱ.
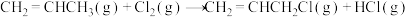
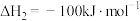
在相同条件下,
 的正反应的活化能
的正反应的活化能 为
为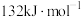 ,则逆反应的活化能
,则逆反应的活化能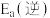 为
为 。
。(2)查阅资料得知,反应
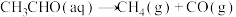 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:第Ⅰ步反应为
 (慢反应);
(慢反应);第Ⅱ步为快反应。
增大I2的浓度
(3)氯化铜晶体(
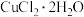 )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下: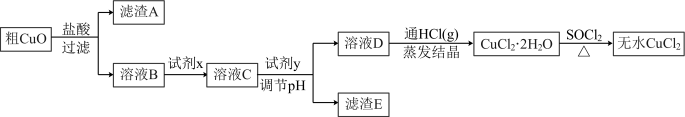
 |  |  | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
已知:氯化亚砜(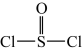 )熔点-105℃,沸点78.8℃,易水解。
)熔点-105℃,沸点78.8℃,易水解。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去
 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的a.Cu b.CuO c.
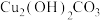 d.NaOH
d.NaOH③SOCl2与水反应的化学方程式为
④SOCl2与
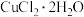 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是
您最近半年使用:0次
2 . 有一处于平衡状态的反应:3A(s)+2B(g) 3C(g),ΔH>0,为了使平衡向生成C的方向移动,应选择的条件
3C(g),ΔH>0,为了使平衡向生成C的方向移动,应选择的条件
 3C(g),ΔH>0,为了使平衡向生成C的方向移动,应选择的条件
3C(g),ΔH>0,为了使平衡向生成C的方向移动,应选择的条件| A.增大压强 | B.升高温度 | C.使用催化剂 | D.增大A物质的量 |
您最近半年使用:0次
3 . 某兴趣小组以重铬酸钾( )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。
已知:① 溶液存在平衡:
溶液存在平衡: 。
。
②含铬元素的离子在溶液中的颜色: (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。 的正反应是
的正反应是_____ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_____ (填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是______ 。
(5)继续实验Ⅲ:______ 。
②第二步溶液变绿色:该反应的离子方程式是_______ 。
 )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。已知:①
 溶液存在平衡:
溶液存在平衡: 。
。②含铬元素的离子在溶液中的颜色:
 (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验Ⅲ:
实验Ⅲ: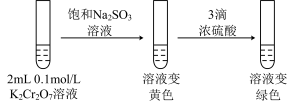
②第二步溶液变绿色:该反应的离子方程式是
您最近半年使用:0次
4 . 硫酸是重要的化工原料,它的年产量可以用来衡量一个国家的化工生产水平,以黄铁矿为原
料进行接触法制硫酸的流程如下:___________ (填设备名称)中与氧气反应的方程式,每生成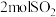 转移
转移___________ mol电子。
(2)在转化阶段,下列条件能使平衡向生成 的方向移动的是_________。
的方向移动的是_________。
(3)硫酸工业生产中 吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收
吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收 所用硫酸的适宜浓度为98.3%,适宜温度为
所用硫酸的适宜浓度为98.3%,适宜温度为___________ ,而工业生产中一般采用60℃的可能原因是___________ 。
料进行接触法制硫酸的流程如下:

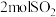 转移
转移(2)在转化阶段,下列条件能使平衡向生成
 的方向移动的是_________。
的方向移动的是_________。| A.不采用常温而加热至400℃-500℃ | B.使用 作为催化剂 作为催化剂 |
| C.向容器中通入过量空气 | D.进入接触室前的混合气体需要先净化 |
(3)硫酸工业生产中
 吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收
吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收 所用硫酸的适宜浓度为98.3%,适宜温度为
所用硫酸的适宜浓度为98.3%,适宜温度为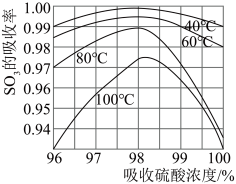
您最近半年使用:0次
5 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: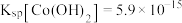 ;
;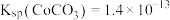 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)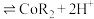 ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的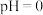 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: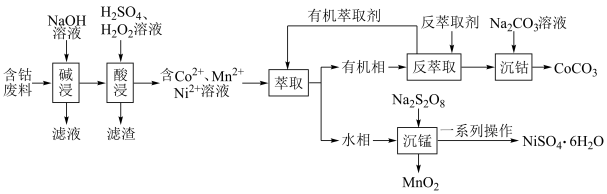
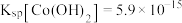 ;
;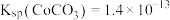 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)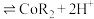 ,若萃取剂的量一定时,
,若萃取剂的量一定时,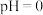 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为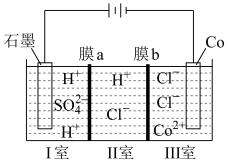
您最近半年使用:0次
6 . N2H4、N2O4常用作火箭发射的推进剂。火箭推进剂发生的反应为:2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g)。下列有关说法正确的是
A.充有N2O4的密闭容器中存在:N2O4(g) 2NO2(g),当c(N2O4)=c(NO2)时,该可逆反应到达限度 2NO2(g),当c(N2O4)=c(NO2)时,该可逆反应到达限度 |
| B.碱性N2H4-空气燃料电池工作时,负极电极反应式为N2H4+4e-+4OH-=N2+4H2O |
| C.反应每生成0.9molN2,转移电子的数目为2.4×6.02×1023 |
D.N2H4的水溶液中存在:N2H4+H2O 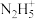 +OH-,向稀溶液中加水稀释, +OH-,向稀溶液中加水稀释,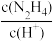 值变大 值变大 |
您最近半年使用:0次
7 . 下列有关实验装置、原理和操作正确,且能达到相应实验目的的是
|
|
|
|
| A.测定Fe2+的浓度 | B.配制100mL一定物质的量浓度的硫酸溶液 | C.测定中和热 | D.探究温度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
8 . 下列有关实验探究方案设计合理的是
| 选项 | 实验方案 | 实验目的 |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,观察气体产生的速率 | 比较Cu2+和Fe3+的催化效果 |
| B | 先将注射器充满NO2气体,然后将活塞往里推,压缩体积,观察注射器内气体颜色先变深后变浅 | 验证压强对平衡的影响 |
| C | 在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL1mol·L-1和40mL18mol·L-1的硫酸,比较两者收集10mL氢气所用的时间
| 探究硫酸浓度对反应速率的影响 |
| D | 在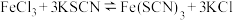 平衡体系中加入KCl晶体,观察并比较实验现象 平衡体系中加入KCl晶体,观察并比较实验现象 | 探究离子浓度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
9 . 根据实验目的,下列实验操作及现象与结论均正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 比较CH3COO-和 的水解常数 的水解常数 | 分别测浓度均为0.1mol·L-1的CH3COONH4和NaHCO3溶液的pH, 后者大于前者 | Kh(CH3COO-)<Kh( ) ) |
| B | 验证Cl2与H2O的反应存在限度 | 取两份新制氯水,分别滴加AgNO3溶液和淀粉-KI溶液,前者有白色沉淀,后者溶液变蓝色 | 氯气与水的反应存在限度 |
| C | 探究氢离子浓度对 (黄色)。 (黄色)。 (橙红色)相互转化的影响 (橙红色)相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸溶液,黄色变为橙红色 | 增大c(H+),转化平衡向生成 的方向移动 的方向移动 |
| D | 比较AgCl与AgI的溶度积大小 | 向2mL0.1 AgNO3溶液中先滴加4滴0.1 AgNO3溶液中先滴加4滴0.1 KCl溶液,再滴加4滴0.1 KCl溶液,再滴加4滴0.1 KI溶液,先产生白色沉淀,再产生黄色沉淀 KI溶液,先产生白色沉淀,再产生黄色沉淀 | AgCl转化为AgI,AgI的溶度积小于AgCl的 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
10 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=___________ kJ/mol。
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(2)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
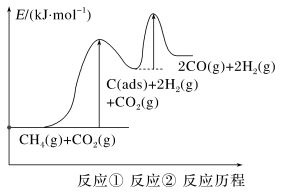
①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
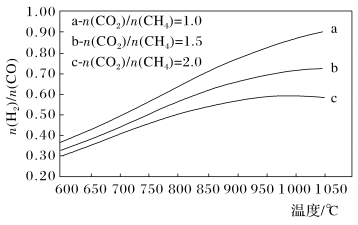
随着进料比 的增加,
的增加,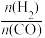 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(2)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,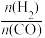 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加,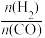 的值
的值
您最近半年使用:0次


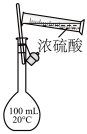
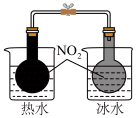 (热水浴气体颜色较深,冰水浴气体颜色较浅)
(热水浴气体颜色较深,冰水浴气体颜色较浅)


