1 . 回答下列问题。
(1)已知下列热化学方程式:
Ⅰ.
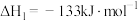
Ⅱ.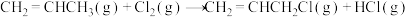
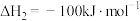
在相同条件下, 的正反应的活化能
的正反应的活化能 为
为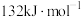 ,则逆反应的活化能
,则逆反应的活化能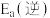 为
为___________  。
。
(2)查阅资料得知,反应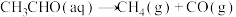 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:
第Ⅰ步反应为 (慢反应);
(慢反应);
第Ⅱ步为快反应。
增大I2的浓度___________ (填“能”或“不能”)明显增大总反应的平均速率,理由为___________ 。
(3)氯化铜晶体(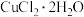 )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
___________ (填字母,下同)。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的___________ 。
a.Cu b.CuO c.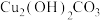 d.NaOH
d.NaOH
③SOCl2与水反应的化学方程式为___________ 。
④SOCl2与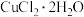 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是___________ 。
(1)已知下列热化学方程式:
Ⅰ.

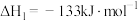
Ⅱ.
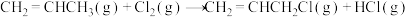
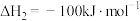
在相同条件下,
 的正反应的活化能
的正反应的活化能 为
为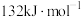 ,则逆反应的活化能
,则逆反应的活化能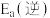 为
为 。
。(2)查阅资料得知,反应
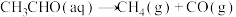 在含有少量I2的溶液中分两步进行:
在含有少量I2的溶液中分两步进行:第Ⅰ步反应为
 (慢反应);
(慢反应);第Ⅱ步为快反应。
增大I2的浓度
(3)氯化铜晶体(
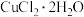 )常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:
)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下: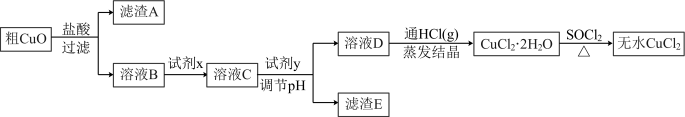
 |  |  | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
已知:氯化亚砜(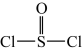 )熔点-105℃,沸点78.8℃,易水解。
)熔点-105℃,沸点78.8℃,易水解。
a.KMnO4溶液 b.氯水 c.溴水 d.H2O2溶液
②溶液C中加入试剂y可以调节溶液pH,从而除去
 而不引入杂质。试剂y可选用下列物质中的
而不引入杂质。试剂y可选用下列物质中的a.Cu b.CuO c.
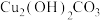 d.NaOH
d.NaOH③SOCl2与水反应的化学方程式为
④SOCl2与
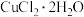 混合并加热,可得到无水CuCl2的原因是
混合并加热,可得到无水CuCl2的原因是
您最近半年使用:0次
2 . 某兴趣小组以重铬酸钾( )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。
已知:① 溶液存在平衡:
溶液存在平衡: 。
。
②含铬元素的离子在溶液中的颜色: (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。 的正反应是
的正反应是_____ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_____ (填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是______ 。
(5)继续实验Ⅲ:______ 。
②第二步溶液变绿色:该反应的离子方程式是_______ 。
 )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。已知:①
 溶液存在平衡:
溶液存在平衡: 。
。②含铬元素的离子在溶液中的颜色:
 (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验Ⅲ:
实验Ⅲ: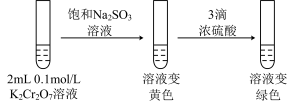
②第二步溶液变绿色:该反应的离子方程式是
您最近半年使用:0次
3 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: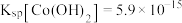 ;
;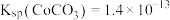 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)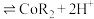 ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的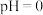 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: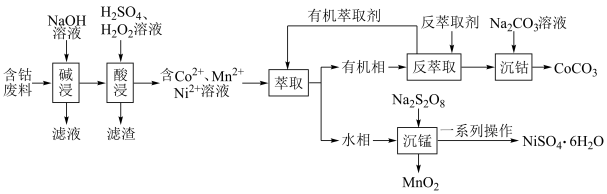
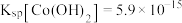 ;
;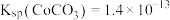 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)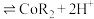 ,若萃取剂的量一定时,
,若萃取剂的量一定时, ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为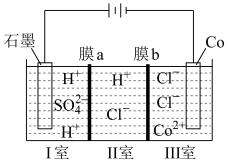
您最近半年使用:0次
名校
4 . 恒温恒容,可逆反应N2O4(g) 2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
 2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是
2NO2(g)。充入1molN2O4气体,反应达平衡状态。若再充入1molN2O4气体,下列说法错误的是| A.NO2的体积分数增大 | B.达新平衡后平衡体系压强比原平衡大 |
| C.平衡正向移动 | D.达新平衡后N2O4转化率降低 |
您最近半年使用:0次
名校
5 . 下列有关对应图像的说法正确的是

A.据①知,某温度下,平衡状态由A变到B时,平衡常数 |
B.据平衡常数的负对数(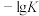 )—温度(T)图像②知,30℃时,B点对应状态的 )—温度(T)图像②知,30℃时,B点对应状态的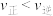 |
C.由 的稳定性与溶液pH的关系可知图③中 的稳定性与溶液pH的关系可知图③中 |
D.图④所示体系中气体平均摩尔质量: , , |
您最近半年使用:0次
解题方法
6 . 利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比
2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
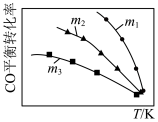
 2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比
2CO2(g)+N2(g),可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
| A.若m=2,反应达平衡时,NO的转化率为40%,则N2的体积分数为15.4% |
B.该反应的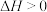 |
C.投料比: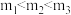 |
| D.汽车排气管中的催化剂可提高NO的平衡转化率 |
您最近半年使用:0次
7 . 对SO2、NOx、CO2和CO进行回收利用是节能减排的重要课题。某温度下,向恒容密闭容器中充入NO2、SO2发生反应:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是___________ (填序号)。
a.使用高效催化剂 b.向容器中充入氩气 c.降低温度 d.减小NO的物质的量
②下列能说明反应达到平衡状态的是___________ (填字母)。
a.混合气体的密度保持不变
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
(2)在体积为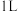 密闭容器中充入
密闭容器中充入 和
和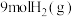 ,发生反应
,发生反应 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
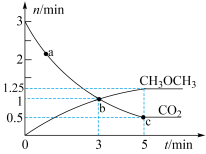
①反应到达3min时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②0~5min内,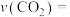
___________  。
。
③反应达到平衡状态时, 的体积分数为
的体积分数为___________ %(保留1位小数)。
④a、b、c三点中代表达到平衡的是___________ ,a点的正反应速率___________ (填>、<或=)b点的逆反应速率。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是
a.使用高效催化剂 b.向容器中充入氩气 c.降低温度 d.减小NO的物质的量
②下列能说明反应达到平衡状态的是
a.混合气体的密度保持不变
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
(2)在体积为
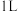 密闭容器中充入
密闭容器中充入 和
和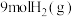 ,发生反应
,发生反应 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
①反应到达3min时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②0~5min内,
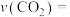
 。
。③反应达到平衡状态时,
 的体积分数为
的体积分数为④a、b、c三点中代表达到平衡的是
您最近半年使用:0次
名校
解题方法
8 . 五氧化二钒(V2O5)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有V2O5、VOSO4及少量Fe2O3、Al2O3等杂质)回收V2O5的部分工艺流程如下:
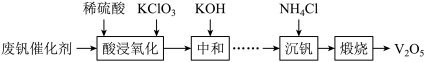
已知:a.常温下,部分含钒物质在水中的溶解性见下表:
b.+5价钒在溶液中的主要存在形式与溶液pH的关系见下表:
(1)“酸浸、氧化”时,VO2+发生反应的离子方程式为___________ 。
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是___________ 。
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可表示为ROH+VO
 RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________ (填“酸性”或“碱性”),理由是___________ 。
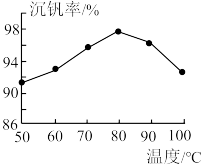
②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。图1中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是___________ 。
(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图2所示,加热分解NH4VO3制备V2O5需要控制的温度为___________ 。


已知:a.常温下,部分含钒物质在水中的溶解性见下表:
| 物质 | V2O5 | VOSO4 | (VO2)2SO4 | NH4VO3 |
| 溶解性 | 难溶 | 可溶 | 易溶 | 难溶 |
| pH | <6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | V2O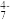 | VO |
(1)“酸浸、氧化”时,VO2+发生反应的离子方程式为
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可表示为ROH+VO

 RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。图1中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是

(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图2所示,加热分解NH4VO3制备V2O5需要控制的温度为

您最近半年使用:0次
解题方法
9 . 某学习小组欲利用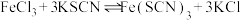 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变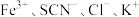 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是___________ (填A或B)。原因是:___________ 。
(2)取 溶液X,加入5滴
溶液X,加入5滴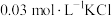 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:①___________ 对平衡产生了影响;②不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.为了探究KCl对 平衡体系的影响某学习小组同学进行如下探究:各取
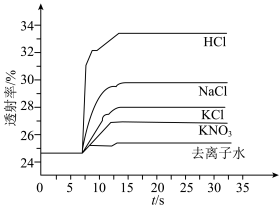
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
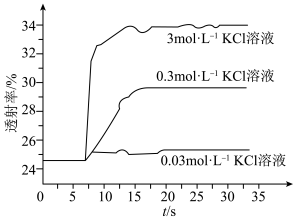
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响___________ 移动(填“正向、逆向或不”)。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:___________ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:
a.溶液中的 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②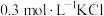 溶液、③
溶液、③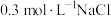 溶液、④
溶液、④ 溶液、⑤
溶液、⑤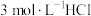 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是___________ 。盐效应影响较大的阳离子是___________ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)已知 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:___________ 。
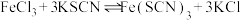 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
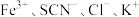 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是(2)取
 溶液X,加入5滴
溶液X,加入5滴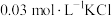 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:① 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.为了探究KCl对
 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。 猜想②:
 产生的影响。
产生的影响。 猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:a.溶液中的
 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取
 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②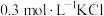 溶液、③
溶液、③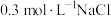 溶液、④
溶液、④ 溶液、⑤
溶液、⑤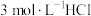 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)已知
 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:
您最近半年使用:0次
名校
10 . 现有一份“将二氧化硫转化为硫酸铵”的资料,摘录如下:
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在400℃时废气以5 m3·h-1的速率通过五氧化二钒催化剂层与20 L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是___________ ,简述不采用2∶1的理由是___________ 。
(2)通过计算,说明为什么废气以5 m3·h-1的速率与20 L·h-1速率的氨气混合___________ 。
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵___________ 吨,消耗氨气___________ 吨。
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在400℃时废气以5 m3·h-1的速率通过五氧化二钒催化剂层与20 L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是
(2)通过计算,说明为什么废气以5 m3·h-1的速率与20 L·h-1速率的氨气混合
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵
您最近半年使用:0次



