1 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 实验结论 |
| A | 比较CH3COO-和 的水解常数 的水解常数 | 分别测浓度均为0.1mol/L的CH3COONH4和NaHCO3溶液的pH,后者大于前者 | Kh(CH3COO-)<Kh( ) ) |
| B | 检验铁锈中是否含有二价铁 | 将铁锈溶于浓盐酸,滴入高锰酸钾溶液,紫色褪去 | 铁锈中含有二价铁 |
| C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| D | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液 | 生成黑色沉淀 | Ksp(ZnS)>Ksp(CuS) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . I.一定条件下,在容积为 的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。
的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。
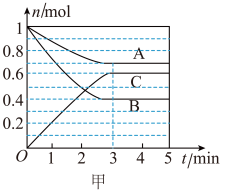
(1)该反应的化学方程式为___________ 。
(2)向一恒温恒容的密闭容器中充入 和
和 发生该反应,
发生该反应, 时达到平衡状态I,在
时达到平衡状态I,在 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,v(正)随时间的变化如图乙所示。
时重新达到平衡状态Ⅱ,v(正)随时间的变化如图乙所示。
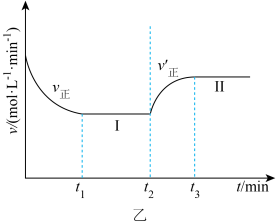
①根据图乙判断,在 时刻改变的外界条件是
时刻改变的外界条件是___________ 。
②平衡时A的体积分数
___________ 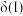 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
Ⅱ.在密闭容器中充入一定量的 ,发生反应:
,发生反应: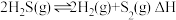 ,如图丙所示为
,如图丙所示为 气体分解生成
气体分解生成 和
和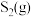 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
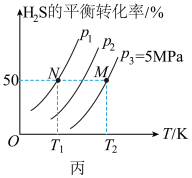
(3)
___________ (填“>”“<”或“=”)0。
(4)图丙中压强( 、
、 、
、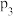 )由大到小的顺序为
)由大到小的顺序为___________ 。
(5)图丙中M点对应的平衡常数
___________ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。
的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。
(1)该反应的化学方程式为
(2)向一恒温恒容的密闭容器中充入
 和
和 发生该反应,
发生该反应, 时达到平衡状态I,在
时达到平衡状态I,在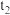 时改变某一条件,
时改变某一条件, 时重新达到平衡状态Ⅱ,v(正)随时间的变化如图乙所示。
时重新达到平衡状态Ⅱ,v(正)随时间的变化如图乙所示。
①根据图乙判断,在
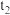 时刻改变的外界条件是
时刻改变的外界条件是②平衡时A的体积分数

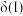 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。Ⅱ.在密闭容器中充入一定量的
 ,发生反应:
,发生反应: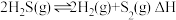 ,如图丙所示为
,如图丙所示为 气体分解生成
气体分解生成 和
和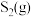 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)

(4)图丙中压强(
 、
、 、
、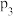 )由大到小的顺序为
)由大到小的顺序为(5)图丙中M点对应的平衡常数

您最近一年使用:0次
名校
3 . 下列实验目的对应的实验方案设计、现象和结论都正确的是
| 选项 | 实验方案设计 | 现象和结论 |
| A | 用pH计测量 、 、 的pH,比较溶液pH大小 的pH,比较溶液pH大小 |  的pH比 的pH比 大,说明 大,说明 酸性比 酸性比 强 强 |
| B | 将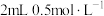 的 的 溶液加热后置于冷水中 溶液加热后置于冷水中 | 溶液由黄绿色变为蓝绿色,说明降低温度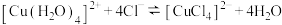 向逆方向移动 向逆方向移动 |
| C | 向平衡体系 中加入适量 中加入适量 固体 固体 | 溶液颜色变浅,说明生成物浓度增大,平衡逆向移动 |
| D | 向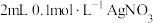 溶液中先滴加4滴 溶液中先滴加4滴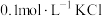 溶液,再滴加4滴 溶液,再滴加4滴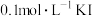 溶液 溶液 | 先产生白色沉淀,再产生黄色沉淀,说明 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-13更新
|
190次组卷
|
2卷引用:浙江省杭州第二中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 一定温度下,烧杯中有25mL对二甲苯和5mL水,加入bmol HA后充分搅拌并完全溶解,静置平衡后HA在对二甲苯(PX)中浓度为 ,在水(W)中浓度为
,在水(W)中浓度为 。已知:
。已知:
①实验条件下HA在两相间的分配系数: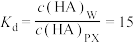 (只与温度有关):
(只与温度有关):
②HA不能在对二甲苯中电离,在水中电离平衡常数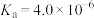 。
。
忽略溶液混合时体积的变化,下列说法错误的是
 ,在水(W)中浓度为
,在水(W)中浓度为 。已知:
。已知:①实验条件下HA在两相间的分配系数:
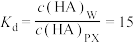 (只与温度有关):
(只与温度有关):②HA不能在对二甲苯中电离,在水中电离平衡常数
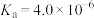 。
。忽略溶液混合时体积的变化,下列说法错误的是
A.水溶液中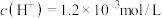 |
B.若向平衡体系中再加入对二甲苯,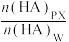 减小 减小 |
C.若向平衡体系中再加入20mL水,平衡后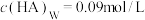 |
D.若向平衡体系中再加入NaOH固体,使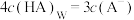 ,平衡后 ,平衡后 |
您最近一年使用:0次
2023-12-05更新
|
298次组卷
|
3卷引用:重庆市南开中学校2023-2024学年高三上学期第四次质量检测化学试题
真题
名校
5 . 在恒温恒容密闭容器中充入一定量 ,发生如下反应:
,发生如下反应: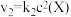 和
和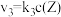 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。
下列说法正确的是
 ,发生如下反应:
,发生如下反应: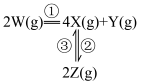
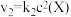 和
和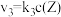 ,其中
,其中 分别为反应②和③的速率常数,反应③的活化能大于反应②。测得
分别为反应②和③的速率常数,反应③的活化能大于反应②。测得 的浓度随时间的变化如下表。
的浓度随时间的变化如下表。 | 0 | 1 | 2 | 3 | 4 | 5 |
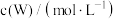 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A.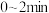 内,X的平均反应速率为 内,X的平均反应速率为 |
| B.若增大容器容积,平衡时Y的产率增大 |
C.若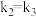 ,平衡时 ,平衡时 |
D.若升高温度,平衡时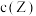 减小 减小 |
您最近一年使用:0次
2023-11-29更新
|
3266次组卷
|
5卷引用:2023年河北省高考化学试卷
名校
6 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与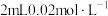 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与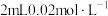 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。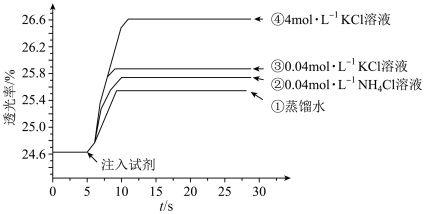
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
362次组卷
|
7卷引用:北京市对外经济贸易大学附属中学2022-2023学年高二上学期期中考试化学试题
解题方法
7 . 实验室以LiCoO2废渣为原料制备CoCO3,其部分实验过程如下。
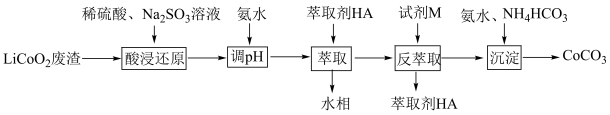
已知:Co2+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:2HA(有机层)+Co2+(水层) CoA2(有机层)+2H+(水层)
CoA2(有机层)+2H+(水层)
(1)为了提高酸浸过程中钴的浸出率,实验中可采取的措施有___________。(填字母)
(2)“酸浸还原”中,LiCoO2在Na2SO3的作用下转化为Li2SO4和CoSO4,写出该反应的化学方程式:___________ 。
(3)“反萃取”时加入试剂M,试剂M为___________ (填化学式),向有机相中加入试剂M溶液能进行反萃取的原因为___________ 。
(4)已知:常温下,Ksp[Co(OH)2]=2×10-15。若反萃取后的溶液中c(Co2+)=0.02mol•L-1,则“沉淀”过程需控制溶液pH的范围是___________ ,“沉淀”过程发生反应的离子方程式为___________ 。

已知:Co2+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为:2HA(有机层)+Co2+(水层)
 CoA2(有机层)+2H+(水层)
CoA2(有机层)+2H+(水层)(1)为了提高酸浸过程中钴的浸出率,实验中可采取的措施有___________。(填字母)
| A.适当提高酸浸温度 | B.缩短酸浸时间 |
| C.增加LiCoO2废渣的投入量 | D.将LiCoO2废渣粉碎并适当加快搅拌 |
(2)“酸浸还原”中,LiCoO2在Na2SO3的作用下转化为Li2SO4和CoSO4,写出该反应的化学方程式:
(3)“反萃取”时加入试剂M,试剂M为
(4)已知:常温下,Ksp[Co(OH)2]=2×10-15。若反萃取后的溶液中c(Co2+)=0.02mol•L-1,则“沉淀”过程需控制溶液pH的范围是
您最近一年使用:0次
8 . 一定温度下,把0.3molM(g)和0.1molN(s)加入容积为1L的恒容密闭容器中,发生反应 ,经5s反应达到平衡,0~5s内P(g)的平均反应速率为
,经5s反应达到平衡,0~5s内P(g)的平均反应速率为 ,同时生成0.1molQ(g)。下列叙述中错误的是
,同时生成0.1molQ(g)。下列叙述中错误的是
 ,经5s反应达到平衡,0~5s内P(g)的平均反应速率为
,经5s反应达到平衡,0~5s内P(g)的平均反应速率为 ,同时生成0.1molQ(g)。下列叙述中错误的是
,同时生成0.1molQ(g)。下列叙述中错误的是A.反应达到平衡状态时, 的体积分数为 的体积分数为 |
B.该温度下,反应的平衡常数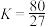 |
C.反应达到平衡后,再通入一定量的 ,再次达到平衡时 ,再次达到平衡时 的平衡浓度增大 的平衡浓度增大 |
D.若起始时加入 和 和 ,平衡时 ,平衡时 的体积分数为 的体积分数为 |
您最近一年使用:0次
名校
解题方法
9 . 某实验小组对 分别与
分别与 、
、 的反应进行实验探究。
的反应进行实验探究。
实验药品: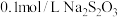 溶液(
溶液( );
);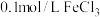 溶液(
溶液( );
);
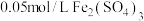 溶液(
溶液( )。
)。
实验过程
资料:ⅰ. 在酸性条件下不稳定,发生反应
在酸性条件下不稳定,发生反应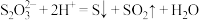 :
:
ⅱ. (暗紫色),
(暗紫色), 遇
遇 无明显现象
无明显现象
(1)配制 溶液时,需要用盐酸酸化,结合离子方程式解释原因:
溶液时,需要用盐酸酸化,结合离子方程式解释原因:_____ 。
(2)对实验I中现象进行分析:
①查阅资料: 可将
可将 氧化成
氧化成 ,反应的离子方程式是
,反应的离子方程式是_____ 。
②结合反应速率与平衡移动原理解释实验中先出现紫色,后紫色褪去的原因_____ 。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是_____
②由实验Ⅳ和实验Ⅴ得出的结论是_____ 。
 分别与
分别与 、
、 的反应进行实验探究。
的反应进行实验探究。实验药品:
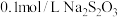 溶液(
溶液( );
);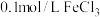 溶液(
溶液( );
);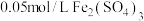 溶液(
溶液( )。
)。实验过程
| 实验编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验操作 |  | 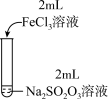 | 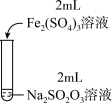 |
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色褪去,久置后不出现淡黄色浑浊 | 溶液呈紫色,静置后紫色缓慢褪去,久置后不出现淡黄色浑浊 |
 在酸性条件下不稳定,发生反应
在酸性条件下不稳定,发生反应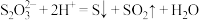 :
:ⅱ.
 (暗紫色),
(暗紫色), 遇
遇 无明显现象
无明显现象(1)配制
 溶液时,需要用盐酸酸化,结合离子方程式解释原因:
溶液时,需要用盐酸酸化,结合离子方程式解释原因:(2)对实验I中现象进行分析:
①查阅资料:
 可将
可将 氧化成
氧化成 ,反应的离子方程式是
,反应的离子方程式是②结合反应速率与平衡移动原理解释实验中先出现紫色,后紫色褪去的原因
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | Ⅳ | Ⅴ |
| 实验操作 |  | 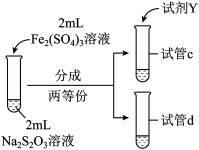 |
| 实验现象 | 紫色褪去时间 | 紫色褪去时间 |
②由实验Ⅳ和实验Ⅴ得出的结论是
您最近一年使用:0次
名校
解题方法
10 . 实验小组模拟工业上回收“分银渣”中的银,过程如下:
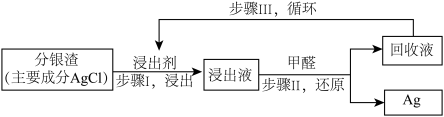
①Ⅰ中反应: (杂质不反应)
(杂质不反应)
②在上述反应的温度下,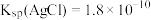 、
、
(1)过程Ⅰ中,向 溶液中加入分银渣,10分钟后,固体质量减少
溶液中加入分银渣,10分钟后,固体质量减少 ,则反应速率
,则反应速率
___________ (忽略溶液体积变化)。
(2)“分银”时, 与
与 反应生成
反应生成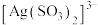 ,该反应的平衡常数
,该反应的平衡常数
___________ 。
(3)其他条件不变,反应Ⅰ在敞口容器中进行,若反应时间过长反而银的产率降低,银产率降低的可能原因是___________ (用离子方程式解释)。
(4)配平步骤Ⅱ中反应的离子方程式并标出电子转移的方向和数目:_________
___________ ___________
___________ ___________
___________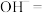 ___________
___________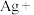 ___________
___________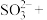 ___________
___________ ___________
___________
(5)Ⅲ中回收液可直接循环使用,但循环多次后,银浸出率降低。从回收液离子浓度变化和平衡移动的角度分析原因:___________ 。

①Ⅰ中反应:
 (杂质不反应)
(杂质不反应)②在上述反应的温度下,
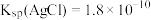 、
、
(1)过程Ⅰ中,向
 溶液中加入分银渣,10分钟后,固体质量减少
溶液中加入分银渣,10分钟后,固体质量减少 ,则反应速率
,则反应速率
(2)“分银”时,
 与
与 反应生成
反应生成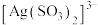 ,该反应的平衡常数
,该反应的平衡常数
(3)其他条件不变,反应Ⅰ在敞口容器中进行,若反应时间过长反而银的产率降低,银产率降低的可能原因是
(4)配平步骤Ⅱ中反应的离子方程式并标出电子转移的方向和数目:
___________
 ___________
___________ ___________
___________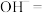 ___________
___________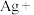 ___________
___________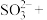 ___________
___________ ___________
___________
(5)Ⅲ中回收液可直接循环使用,但循环多次后,银浸出率降低。从回收液离子浓度变化和平衡移动的角度分析原因:
您最近一年使用:0次



