名校
解题方法
1 . 探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
ⅰ.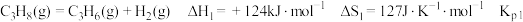
ⅱ.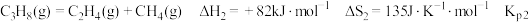
ⅲ.
已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数 见下表。
见下表。
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ_____ 反应 ⅱ(填“>”或“<”)。
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:_____ 。
②平衡体系中检测不到 ,可认为存在反应:
,可认为存在反应: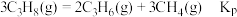 ,下列相关说法正确的是
,下列相关说法正确的是_____ (填标号)。
a.
b.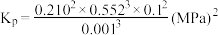
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性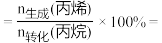
_____ (列出计算式)。
(3)丙烷甲醇共进料时,还发生反应:ⅳ.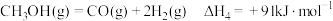 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
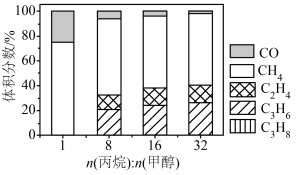
①进料比n(丙烷):n(甲醇) 时,体系总反应:
时,体系总反应: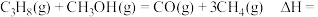
______  。
。
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是______ 。
ⅰ.
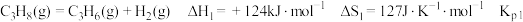
ⅱ.
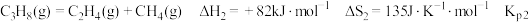
ⅲ.

已知:
 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数 见下表。
见下表。| 物质 | 丙烯 | 乙烯 | 甲烷 | 丙烷 | 氢气 |
| 体积分数(%) | 21 | 23.7 | 55.2 | 0.1 | 0 |
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:
②平衡体系中检测不到
 ,可认为存在反应:
,可认为存在反应: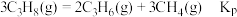 ,下列相关说法正确的是
,下列相关说法正确的是a.

b.
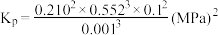
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性
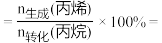
(3)丙烷甲醇共进料时,还发生反应:ⅳ.
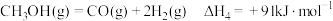 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷):n(甲醇)
 时,体系总反应:
时,体系总反应: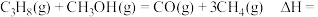
 。
。②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是
您最近一年使用:0次
名校
解题方法
2 . I、II、III三个容积均为2L的恒容密闭容器中均投入1mol CO2 和3mol H2 ,在不同温度下发生反应:CO2(g) + 3H2⇌CH3OH(g) + H2O(g) 。反应10min,测得各容器内CO2的物质的量分别如图所示。下列说法正确的是
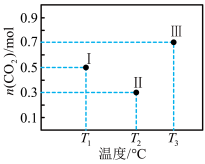

| A.升高温度、增大压强均有利于提高 H2的平衡转化率 |
| B.10min后,向容器Ⅲ中再加入1mol CO2 (g)和1mol H2O (g),此时反应逆向进行 |
| C.容器Ⅱ中的平均速率:v(CO2) =0.07 mol·L-1·min-1 |
| D.10min时,容器Ⅰ中 v(正) = v(逆) |
您最近一年使用:0次
3 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
将等体积的 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。
实验记录如下:
(1)基态 的电子排布式
的电子排布式___________ 。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或
(蓝色)或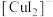 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去 的原理是
的原理是___________ 。
ii.查阅资料, (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:___________ ,___________ 。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,___________ (填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________ 。
(4)上述实验结果, 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
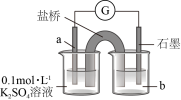
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为___________ ,b试剂为___________ 。
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。将等体积的
 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。实验记录如下:
 | 实验现象 | |
| 实验Ⅰ | 0.01 | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1 | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4 |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 的电子排布式
的电子排布式(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
 (蓝色)或
(蓝色)或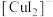 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去
 的原理是
的原理是ii.查阅资料,
 (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为
您最近一年使用:0次
2023-11-03更新
|
273次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高三上学期期中联考化学试题
名校
4 . 合成氨反应:N2+3H2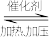 2NH3在密闭容器中进行。下列有关说法正确的是
2NH3在密闭容器中进行。下列有关说法正确的是
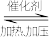 2NH3在密闭容器中进行。下列有关说法正确的是
2NH3在密闭容器中进行。下列有关说法正确的是| A.其他条件相同时在不同容器中发生反应,使用催化剂可能使相同时间内H2的转化率更高 |
| B.若在恒温恒容条件下达到平衡后增大氨气浓度,平衡将逆向移动,氨气产率下降 |
| C.其他条件不变,升高温度,平衡逆向移动,正反应速率下降 |
| D.其他条件不变,降低NH3的浓度,平衡正向移动,正反应速率增大 |
您最近一年使用:0次
名校
解题方法
5 . 某温度下,改变0.1mol/LK2Cr2O7溶液的pH时,各种含铬元素微粒及OH-浓度变化如图所示(已知H2CrO4是二元酸),下列有关说法中正确的是


| A.该温度下的Kw=10-13 |
B.溶液中存在平衡 +H2O⇌2 +H2O⇌2 +2H+,该温度下此反应的K=10-13.2 +2H+,该温度下此反应的K=10-13.2 |
| C.向0.1mol/LK2Cr2O7溶液中加入一定量NaOH固体,溶液橙色加深 |
D.E点溶液中存在:c(K+)<2c( )+3c( )+3c( ) ) |
您最近一年使用:0次
2022-04-29更新
|
788次组卷
|
4卷引用:湖北省武汉外国语学校2022-2023学年高二上学期期末考试化学试题
湖北省武汉外国语学校2022-2023学年高二上学期期末考试化学试题 东北三省四城市联考暨沈阳市2021-2022学年高三质量监测(二)化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)辽宁省沈阳市同泽中学2022-2023学年高二12月月考化学试题
名校
解题方法
6 . 下列有关实验现象的解释或所得结论正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某补血口服液中滴加几滴酸性 溶液 溶液 | 酸性 溶液紫色褪去 溶液紫色褪去 | 该补血口服液中一定含有 |
| B | 用蒸馏水溶解 固体,并继续加水稀释 固体,并继续加水稀释 | 溶液由绿色逐渐变为蓝色 | 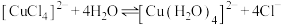 正向移动 正向移动 |
| C | 将25℃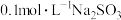 溶液加热到40℃,用传感器监测溶液pH变化 溶液加热到40℃,用传感器监测溶液pH变化 | 溶液的pH逐渐减小 | 温度升高, 水解平衡正向移动 水解平衡正向移动 |
| D | 将铜与浓硫酸反应产生的气体通入 溶液中 溶液中 | 产生白色沉淀 | 该气体中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-01更新
|
1273次组卷
|
8卷引用:湖北武汉市2022届高三5月第一次模拟考试化学试题
名校
解题方法
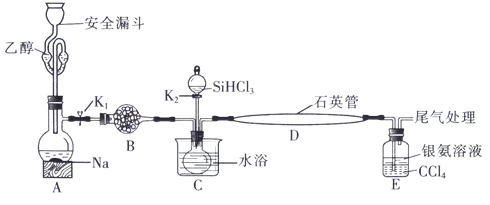
7 . 高纯硅被誉为“信息革命的催化剂”。某小组模拟工业上用 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:① 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为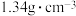 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
② ;
;
③银氨溶液中存在: 。
。
回答下列问题:
(1)装置B中试剂宜选择___________ (填字母,单选)。
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加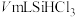 ;
;
④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为___________ (填序号)。
(3)E中CCl4的作用是防倒吸和___________ 。“防倒吸”原理是___________ 。用化学平衡原理解释银氨溶液中有白色沉淀生成:___________ 。
(4)石英管中发生反应的化学方程式为___________ 。
(5)本实验制得高纯硅ag,则SiHCl3的利用率为___________ (只列计算式)。实验结束后,有同学认为根据高纯硅与消耗钠或乙醇的量也可以计算SiHCl3的利用率,这种观点___________ (填“是”或“否”)正确。
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为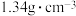 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
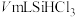 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
您最近一年使用:0次
2021-07-04更新
|
522次组卷
|
2卷引用:湖北省2020-2021学年高二下学期7月统一调研测试化学试题
19-20高三·江苏苏州·期末
名校
8 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
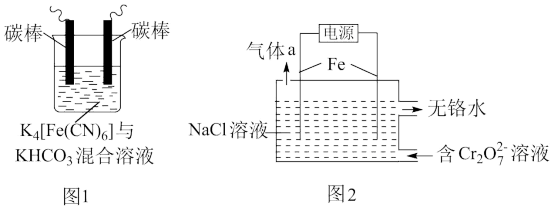
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
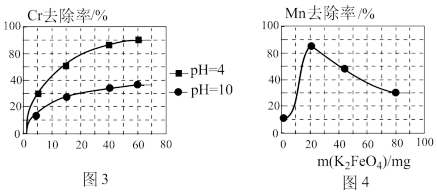
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题
湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题(已下线)【苏州新东方】化学试卷(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
解题方法
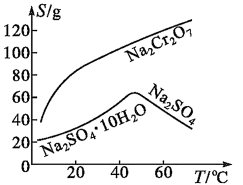
9 . 重铬酸钠是一种用途极广的氧化剂,以铬铁矿[主要成分Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体,同时回收Cr的主要工艺流程如图:
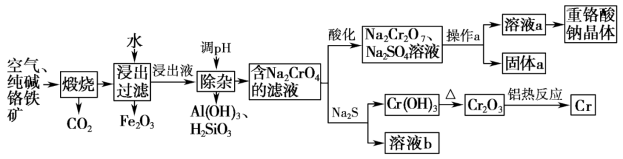
已知部分物质的溶解度曲线如图所示。
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为___________ 。
(2)将Fe2O3溶于稀硫酸后得到对应盐溶液,检验该溶液中金属阳离子的方法是___________ 。
(3)若通过加入稀硫酸调节溶液pH使铝元素转化为Al(OH)3,所发生反应的离子方程式为___________ 。
(4)Na2CrO4经酸化转化为Na2Cr2O7的原理为___________ (结合离子方程式用平衡移动原理解释)。
(5)操作a的实验步骤为___________ 。
(6)加入Na2S溶液反应后,硫元素全部以S2O 的形式存在,该反应中氧化剂和还原剂的物质的量之比为
的形式存在,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(7)含铬废水会对环境造成污染,要经过化学处理才能排放。现将含CrO 的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于
的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________ mol•L−1,CrO 才能沉淀完全[当溶液中c(CrO
才能沉淀完全[当溶液中c(CrO )≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
)≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]

已知部分物质的溶解度曲线如图所示。

请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为
(2)将Fe2O3溶于稀硫酸后得到对应盐溶液,检验该溶液中金属阳离子的方法是
(3)若通过加入稀硫酸调节溶液pH使铝元素转化为Al(OH)3,所发生反应的离子方程式为
(4)Na2CrO4经酸化转化为Na2Cr2O7的原理为
(5)操作a的实验步骤为
(6)加入Na2S溶液反应后,硫元素全部以S2O
 的形式存在,该反应中氧化剂和还原剂的物质的量之比为
的形式存在,该反应中氧化剂和还原剂的物质的量之比为(7)含铬废水会对环境造成污染,要经过化学处理才能排放。现将含CrO
 的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于
的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于 才能沉淀完全[当溶液中c(CrO
才能沉淀完全[当溶液中c(CrO )≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
)≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
您最近一年使用:0次
10 . 天然气净化过程中产生有毒的 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。
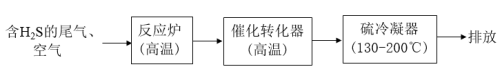
(1)工业上用克劳斯工艺处理含 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
反应炉中的反应: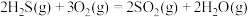 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1
催化转化器中的反应: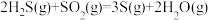 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______ 。
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是______ 。
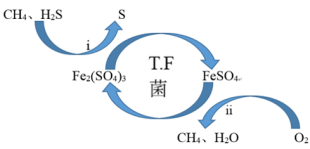
A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3) 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
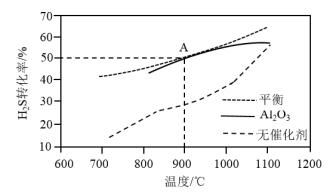
①在约1100℃时,有无 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为______ 。
②在压强p、温度T, 催化条件下,将
催化条件下,将 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实______ ,平衡常数Kp=______ (以分压表示,分压=总压×物质的量分数)
(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:
纯碱溶液吸收少量  的离子方程式为
的离子方程式为______ 。
 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。(1)工业上用克劳斯工艺处理含
 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
反应炉中的反应:
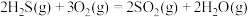 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1催化转化器中的反应:
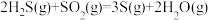 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1克劳斯工艺中获得气态硫黄的总反应的热化学方程式:
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是

A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3)
 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
①在约1100℃时,有无
 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为②在压强p、温度T,
 催化条件下,将
催化条件下,将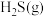 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知
 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:| 电离平衡常数 |  |  |
 |  | 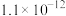 |
 | 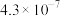 | 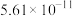 |
 的离子方程式为
的离子方程式为
您最近一年使用:0次
2021-01-03更新
|
1241次组卷
|
9卷引用:八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)
八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)(已下线)大题06 化学反应原理综合题(一)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)2022年浙江省6月高考真题变式题26-31(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(原理综合题)(已下线)03 化学反应原理综合题型集训之Kp计算(解析)-备战2023年高考化学大题逐空突破系列(全国通用)福建省福州第三中学2023届高三下学期第一次质量检测化学试题辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题



