名校
解题方法
1 . 某废矿渣的主要成分有 、
、 、
、 、
、 ,为节约和充分利用资源,通过如下工艺流程回收铁、镍。
,为节约和充分利用资源,通过如下工艺流程回收铁、镍。
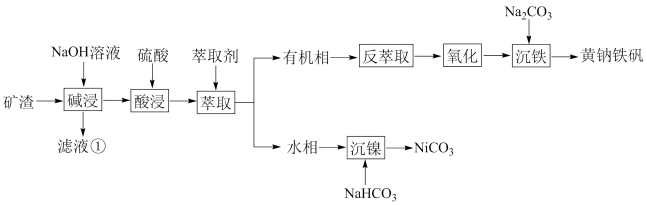
已知:i.黄钠铁矾 有稳定、颗粒大、易沉降、易过滤、几乎不溶于水等特点;
有稳定、颗粒大、易沉降、易过滤、几乎不溶于水等特点;
ii.常温下,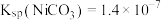 ;
;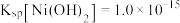 。
。
回答下列问题:
(1)滤液①中,主要存在的钠盐有_____________________ 。
(2)“萃取”可将金属离子进行富集与分离,原理如下:
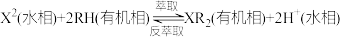 。
。
则“反萃取”应控制在____________________ (填“碱性”、“酸性”或“中性”)环境进行。
(3)“氧化”中加入 ,反应的氧化剂和还原剂的物质的量比为
,反应的氧化剂和还原剂的物质的量比为____________________ 。
(4)“沉镍”过程同时产生一种气体,该反应的离子方程式为_________________________ ,“沉镍”时若溶液 过大会导致
过大会导致 的产率下降,原因是
的产率下降,原因是__________________________ 。
(5)“沉铁”过程反应的离子方程式为_________________________ 。
(6)定量分析:
测定“酸漫”后的溶液中 的浓度,可确定萃取剂添加的量。取“酸浸”后的溶液
的浓度,可确定萃取剂添加的量。取“酸浸”后的溶液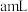 ,然后用
,然后用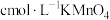 溶液滴定至终点,平行测定三次,平均消耗
溶液滴定至终点,平行测定三次,平均消耗 溶液
溶液 。则溶液中
。则溶液中 的物质的量浓度为
的物质的量浓度为___________  。
。
 、
、 、
、 、
、 ,为节约和充分利用资源,通过如下工艺流程回收铁、镍。
,为节约和充分利用资源,通过如下工艺流程回收铁、镍。
已知:i.黄钠铁矾
 有稳定、颗粒大、易沉降、易过滤、几乎不溶于水等特点;
有稳定、颗粒大、易沉降、易过滤、几乎不溶于水等特点;ii.常温下,
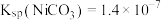 ;
;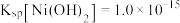 。
。回答下列问题:
(1)滤液①中,主要存在的钠盐有
(2)“萃取”可将金属离子进行富集与分离,原理如下:
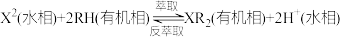 。
。则“反萃取”应控制在
(3)“氧化”中加入
 ,反应的氧化剂和还原剂的物质的量比为
,反应的氧化剂和还原剂的物质的量比为(4)“沉镍”过程同时产生一种气体,该反应的离子方程式为
 过大会导致
过大会导致 的产率下降,原因是
的产率下降,原因是(5)“沉铁”过程反应的离子方程式为
(6)定量分析:
测定“酸漫”后的溶液中
 的浓度,可确定萃取剂添加的量。取“酸浸”后的溶液
的浓度,可确定萃取剂添加的量。取“酸浸”后的溶液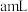 ,然后用
,然后用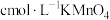 溶液滴定至终点,平行测定三次,平均消耗
溶液滴定至终点,平行测定三次,平均消耗 溶液
溶液 。则溶液中
。则溶液中 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
名校
2 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与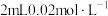 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与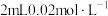 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。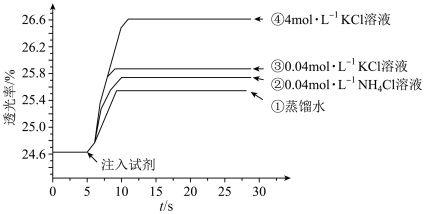
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
362次组卷
|
7卷引用:广东省广州市第二中学2023-2024学年高二上学期期中考试化学试题
名校
3 . 25℃时,下列有关电解质溶液的说法正确的是
| A.氯水存在Cl2(g)+H2O(l)⇌HClO(aq)+H+(aq)+Cl-(aq),向平衡体系加水,c(Cl-)/c(HClO)不变 |
B.室温下向10mL0.1mo1•L-1的氨水中加水稀释后,溶液中 的值增大 的值增大 |
| C.等体积等浓度的盐酸、硫酸、醋酸三种溶液中,c(H+)相等 |
| D.向醋酸溶液中加入少量冰醋酸,醋酸电离平衡向右移动,电离程度增大 |
您最近一年使用:0次
2023-10-26更新
|
862次组卷
|
3卷引用:广东省广州市铁一中学2023-2024学年高二上学期10月月考化学试题
解题方法
4 . 某小组同学探究盐对Fe3+ +3SCN- Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。
实验I:探究KCl对Fe3+和SCN-平衡体系的影响
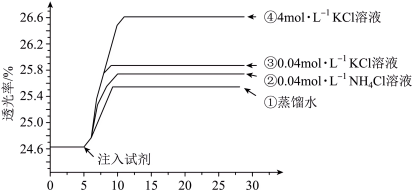
将已用稀盐酸酸化的0.005 mol·L-1 FeCl3溶液和0.01 mol·L-1 KSCN溶液等体积混合,静置至体系平衡,得红色溶液X,分别取3 mL溶液X放入比色皿中,分别滴加0.1 mL的试剂①~④,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:i.Cl-与Fe3+能发生络合反应:Fe3+ +4C1- [FeCl4]-(黄色);
[FeCl4]-(黄色);
ii.Fe3+与NO 不能形成配位化合物;
不能形成配位化合物;
iii.溶液的透光率与溶液颜色深浅有关,颜色越深,透光率越低,忽略[FeCl4]-对透光率的影响。
(1)本实验配制溶液时用到的玻璃仪器除烧杯、量筒、玻璃棒、容量瓶外,还需要___________ ,用稀盐酸酸化FeCl3溶液的目的是___________ 。
(2)注入试剂①后溶液透光率升高,甲同学认为是溶液稀释导致颜色变浅,乙同学认为还可能是稀释的过程中,Fe3+ +3SCN- Fe(SCN)3平衡向
Fe(SCN)3平衡向___________ (填“正”或“逆”)反应方向移动。
(3)注入试剂④后的溶液透光率比注入试剂①后高,结合平衡移动原理分析其原因___________ 。
(4)注入试剂③后的溶液透光率比注入试剂②后高,可能是___________ 导致的(答出一种影响因素即可,不需详细说明理由)。
实验II:探究不同盐对Fe3+和SCN-平衡体系的影响
取2 mL溶液X,分别加入下列试剂进行实验,一段时间后测得各溶液的透光率如下表。
(5)丙同学发现A3>A2>A1,查阅资料认为可能的原因:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。推断盐效应较强的金属阳离子为___________ (填离子符号),试分析该离子盐效应对Fe3+和SCN-平衡体系有影响的原因___________ 。
(6)拓展应用:盐效应对多种平衡体系有影响。
分析c(Na2SO4)在0~0.20 mol·L-1范围内,PbSO4溶解度发生变化的原因:___________ 。
(7)FeCl3用途十分广泛,请写出一种其在生活中的用途___________ 。
 Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。实验I:探究KCl对Fe3+和SCN-平衡体系的影响
将已用稀盐酸酸化的0.005 mol·L-1 FeCl3溶液和0.01 mol·L-1 KSCN溶液等体积混合,静置至体系平衡,得红色溶液X,分别取3 mL溶液X放入比色皿中,分别滴加0.1 mL的试剂①~④,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:i.Cl-与Fe3+能发生络合反应:Fe3+ +4C1-
 [FeCl4]-(黄色);
[FeCl4]-(黄色);ii.Fe3+与NO
 不能形成配位化合物;
不能形成配位化合物;iii.溶液的透光率与溶液颜色深浅有关,颜色越深,透光率越低,忽略[FeCl4]-对透光率的影响。
(1)本实验配制溶液时用到的玻璃仪器除烧杯、量筒、玻璃棒、容量瓶外,还需要
(2)注入试剂①后溶液透光率升高,甲同学认为是溶液稀释导致颜色变浅,乙同学认为还可能是稀释的过程中,Fe3+ +3SCN-
 Fe(SCN)3平衡向
Fe(SCN)3平衡向(3)注入试剂④后的溶液透光率比注入试剂①后高,结合平衡移动原理分析其原因
(4)注入试剂③后的溶液透光率比注入试剂②后高,可能是
实验II:探究不同盐对Fe3+和SCN-平衡体系的影响
取2 mL溶液X,分别加入下列试剂进行实验,一段时间后测得各溶液的透光率如下表。
| 序号 | 加入试剂 | 溶液透光率 |
| 1 | 1 mL蒸馏水 | A1 |
| 2 | 1 mL 3 mol·L-1 KNO3 | A2 |
| 3 | 1 mL 3 mol·L-1 NaNO3 | A3 |
(5)丙同学发现A3>A2>A1,查阅资料认为可能的原因:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。推断盐效应较强的金属阳离子为
(6)拓展应用:盐效应对多种平衡体系有影响。
| c(Na2SO4)/(mol·L-1) | 0 | 0.01 | 0.02 | 0.04 | 0.10 | 0.20 |
| PbSO4溶解度/mg | 4.5 | 0.48 | 0.42 | 0.39 | 0.48 | 0.69 |
(7)FeCl3用途十分广泛,请写出一种其在生活中的用途
您最近一年使用:0次
5 .  团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将
团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将 和
和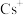 反应,测定笼内
反应,测定笼内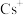 的浓度,计算
的浓度,计算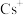 取代
取代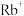 反应的平衡常数
反应的平衡常数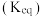 ,反应示意图和所测数据如图。有关说法错误的是
,反应示意图和所测数据如图。有关说法错误的是
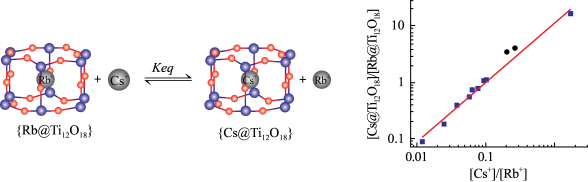
(图中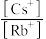 表示平衡时铯离子浓度和铷离子浓度之比,其它类似)
表示平衡时铯离子浓度和铷离子浓度之比,其它类似)
 团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将
团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将 和
和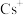 反应,测定笼内
反应,测定笼内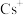 的浓度,计算
的浓度,计算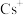 取代
取代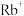 反应的平衡常数
反应的平衡常数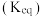 ,反应示意图和所测数据如图。有关说法错误的是
,反应示意图和所测数据如图。有关说法错误的是
(图中
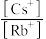 表示平衡时铯离子浓度和铷离子浓度之比,其它类似)
表示平衡时铯离子浓度和铷离子浓度之比,其它类似)A. |
B.研究发现: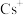 的直径显著大于 的直径显著大于 团簇表面的孔径,且 团簇表面的孔径,且 的骨架结构在 的骨架结构在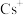 交换过程中没有被破坏。据此推断: 交换过程中没有被破坏。据此推断: 团簇表面的孔是柔性的 团簇表面的孔是柔性的 |
C. 团簇属于超分子,且该团簇对于 团簇属于超分子,且该团簇对于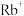 具有比 具有比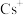 大的亲和力 大的亲和力 |
D.已知冠醚18-冠-6能识别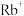 而不能识别 而不能识别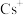 ,则往体系中加18-冠-6时,上述平衡会正向移动 ,则往体系中加18-冠-6时,上述平衡会正向移动 |
您最近一年使用:0次
2023-05-16更新
|
222次组卷
|
2卷引用:广东省江门市新会第一中学2023-2024学年高三上学期9月月考化学试题
9-10高二下·北京·期末
名校
6 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是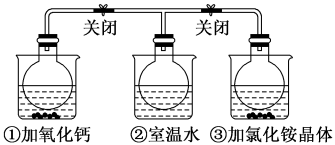
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1134次组卷
|
23卷引用:广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题
广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15
解题方法
7 . CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成分为CoO、Co2O3,还含有Al2O3、ZnO 等杂质) 为原料制备CoCO3的一种工艺流程如下:
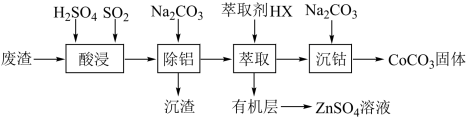
已知:①常温下,Ksp(CoCO3)=1.6×10-7
②相关金属离子[c(Mn+)=1.0mol·L-1]形成氢氧化物沉淀的pH范围如下:
(1)“酸浸”时加快溶解的方法有_______ (写出一种)。
(2)写出“酸浸”时发生氧化还原反应的化学方程式_______ 。
(3)“除铝”过程中需要调节溶液pH 的范围为_______ ,形成沉渣时发生反应的离子方程式为_______ 。
(4)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_______ 。
(5)“沉钴”后经过滤、洗涤、干燥可得CoCO3固体,其中洗涤沉淀的方法是_______ 。
(6)当Co2+沉淀完全时[c(Co2+)≤1×10-5mol·L-1],溶液中c(CO )至少应大于
)至少应大于_______ 。
(7)在空气中煅烧CoCO3生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴的氧化物的化学式为_______ 。

已知:①常温下,Ksp(CoCO3)=1.6×10-7
②相关金属离子[c(Mn+)=1.0mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
(2)写出“酸浸”时发生氧化还原反应的化学方程式
(3)“除铝”过程中需要调节溶液pH 的范围为
(4)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)
 ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是(5)“沉钴”后经过滤、洗涤、干燥可得CoCO3固体,其中洗涤沉淀的方法是
(6)当Co2+沉淀完全时[c(Co2+)≤1×10-5mol·L-1],溶液中c(CO
 )至少应大于
)至少应大于(7)在空气中煅烧CoCO3生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴的氧化物的化学式为
您最近一年使用:0次
解题方法
8 . 室温下,初始浓度为1.0mol·L-1的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示。下列说法正确的是
)随c(H+)的变化如图所示。下列说法正确的是

 )随c(H+)的变化如图所示。下列说法正确的是
)随c(H+)的变化如图所示。下列说法正确的是
| A.随着c(H+)增大,溶液由橙色变为黄色 |
B.由A点可以得出2CrO +2H+=Cr2O +2H+=Cr2O +H2O的K=5×1013 +H2O的K=5×1013 |
C.溶液pH变化过程中c(Na+)=2c(CrO )+4c(Cr2O )+4c(Cr2O ) ) |
D.当溶液pH=7时,c(Na+)=2c(CrO )+2c(Cr2O )+2c(Cr2O ) ) |
您最近一年使用:0次
名校
9 . 工业上采用高浓度含砷废水制取 ,工艺流程如下:
,工艺流程如下:

已知含砷废水中砷元素以+3价的形式存在。不同pH时,三价砷的物种分布如下图所示:

(1) 第一步电离方程式
第一步电离方程式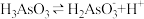 的电离常数为
的电离常数为 ,则
,则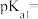
___________ (已知 )
)
(2)“调pH”时,控制溶液的pH=6,“沉砷”时会生成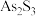 沉淀。写出“沉砷”时反应的离子方程式:
沉淀。写出“沉砷”时反应的离子方程式:___________
(3)“沉砷”时会发生副反应: ,从而降低砷元素的沉淀率。为减少副反应的发生,采取的方法是加入
,从而降低砷元素的沉淀率。为减少副反应的发生,采取的方法是加入 的同时加入少量
的同时加入少量 ,生成的
,生成的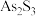 沉淀中会混有FeS。加入少量
沉淀中会混有FeS。加入少量 能抑制副反应的原因是(用平衡移动原理解释)
能抑制副反应的原因是(用平衡移动原理解释)___________
(4)“焙烧”含少量FeS的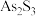 可以得到
可以得到 和
和 的混合物。
的混合物。 是一种酸性氧化物,选择合适的溶液X,将砷元素转化为
是一种酸性氧化物,选择合适的溶液X,将砷元素转化为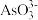 从混合物中浸出。写出“浸出”反应的离子方程式:
从混合物中浸出。写出“浸出”反应的离子方程式:___
(5)保持溶液X的浓度不变,为了提高焙烧后固体中砷元素的浸出速率,可以采取的方法有(填两条):
①________
②________
 ,工艺流程如下:
,工艺流程如下:
已知含砷废水中砷元素以+3价的形式存在。不同pH时,三价砷的物种分布如下图所示:

(1)
 第一步电离方程式
第一步电离方程式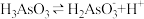 的电离常数为
的电离常数为 ,则
,则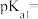
 )
)(2)“调pH”时,控制溶液的pH=6,“沉砷”时会生成
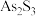 沉淀。写出“沉砷”时反应的离子方程式:
沉淀。写出“沉砷”时反应的离子方程式:(3)“沉砷”时会发生副反应:
 ,从而降低砷元素的沉淀率。为减少副反应的发生,采取的方法是加入
,从而降低砷元素的沉淀率。为减少副反应的发生,采取的方法是加入 的同时加入少量
的同时加入少量 ,生成的
,生成的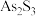 沉淀中会混有FeS。加入少量
沉淀中会混有FeS。加入少量 能抑制副反应的原因是(用平衡移动原理解释)
能抑制副反应的原因是(用平衡移动原理解释)(4)“焙烧”含少量FeS的
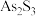 可以得到
可以得到 和
和 的混合物。
的混合物。 是一种酸性氧化物,选择合适的溶液X,将砷元素转化为
是一种酸性氧化物,选择合适的溶液X,将砷元素转化为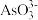 从混合物中浸出。写出“浸出”反应的离子方程式:
从混合物中浸出。写出“浸出”反应的离子方程式:(5)保持溶液X的浓度不变,为了提高焙烧后固体中砷元素的浸出速率,可以采取的方法有(填两条):
①
②
您最近一年使用:0次
2021-11-15更新
|
301次组卷
|
2卷引用:广东省汕头市澄海中学2021-2022学年高二上学期期中考试化学试题
名校
10 . 进入实验室后,一切行动听指挥。不听老师指挥或者不听课的同学就容易做错这一题。下列实验设计或实验现象描述正确的是
①水溶液中,K2Cr2O7存在以下平衡:Cr2O +H2O
+H2O CrO
CrO +2H+,加入2-3滴NaOH溶液,溶液变黄
+2H+,加入2-3滴NaOH溶液,溶液变黄
②探究温度对反应速率的影响:在两支试管中分别混合等体积、同浓度的Na2S2O3溶液和稀硫酸,一支放在热水中,另一支放在冰水中,观察出现浑浊的先后
③[Cu(H2O)4]2+(蓝色)+4C1- [CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
[CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
④把装有NO2与N2O4混合气体的平衡球一端置于冷水,一端置于热水中,置于冷水中的颜色更深
⑤实验室用足量的Zn和稀硫酸反应制备H2,加入几滴CuSO4溶液,反应速率加快,产生H2的量不变
①水溶液中,K2Cr2O7存在以下平衡:Cr2O
 +H2O
+H2O CrO
CrO +2H+,加入2-3滴NaOH溶液,溶液变黄
+2H+,加入2-3滴NaOH溶液,溶液变黄②探究温度对反应速率的影响:在两支试管中分别混合等体积、同浓度的Na2S2O3溶液和稀硫酸,一支放在热水中,另一支放在冰水中,观察出现浑浊的先后
③[Cu(H2O)4]2+(蓝色)+4C1-
 [CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
[CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色④把装有NO2与N2O4混合气体的平衡球一端置于冷水,一端置于热水中,置于冷水中的颜色更深
⑤实验室用足量的Zn和稀硫酸反应制备H2,加入几滴CuSO4溶液,反应速率加快,产生H2的量不变
| A.②④⑤ | B.②③⑤ | C.①⑤ | D.①②④ |
您最近一年使用:0次



