名校
1 . 以下说法中操作正确、能达到目的且判断正确的是
选项 | 操作 | 目的 | 判断 |
A | 向 | 使 | 错误,根据反应 |
B | 合成氨时在经济性良好的范围内选择尽可能高的压强 | 增加 转化率 转化率 | 正确,压强增大使得反应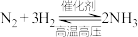 向右进行 向右进行 |
C | 向两支盛有2ml0.2mol/L的乙二酸试管中滴加1ml浓度分别为0.1mol/L和0.2mol/L的 溶液 溶液 | 探究反应物浓度对反应速率的影响 | 正确,浓度越大反应速率越快, 褪色越快 褪色越快 |
D | 向滴有KSCN溶液的 溶液中加入 溶液中加入 固体 固体 | 探究浓度对平衡的影响 | 正确,增加 浓度,使 浓度,使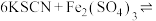 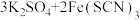 平衡移动 平衡移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 已知: 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: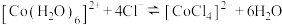 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:

以下结论和解释正确的是
 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: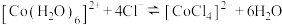 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
| A.由实验①可推知正反应为放热反应 |
B.等物质的量的 和 和 中 中 键数目之比为3∶2 键数目之比为3∶2 |
C.实验②是由于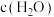 增大,导致平衡逆向移动 增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: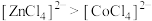 |
您最近一年使用:0次
名校
解题方法
3 . 下列有关实验现象和解释或结论都正确的组合是
| 选项 | 实验操作 | 现象 | 解释或结论 |
A | 相同条件下,分别测量0.1molL1和0.01molL1醋酸溶液的导电性 | 前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 向FeCl3和KSCN的混合溶液中加入KCl固体 | 血红色溶液变浅 | 增大KCl的浓度,使得平衡逆向移动 |
C | 两支试管各盛4mL0.1mol/L酸性高锰酸钾溶液,分别加入2mL0.1mol/L草酸溶液和2mL0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
D | 把充有NO2和N2O4的平衡球装置分别放入热水和冷水中 | 热水中颜色更深 | 其他条件不变时,温度升高,平衡向吸热反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-04更新
|
597次组卷
|
4卷引用:湖南师范大学附属中学2023-2024学年高二上学期入学考试化学试题
名校
解题方法
4 . 某探究小组设计实验测定反应 的平衡常数并探究常温下稀释对该平衡移动方向的影响。步骤如下:
的平衡常数并探究常温下稀释对该平衡移动方向的影响。步骤如下:
(1)实验Ⅰ:配制 溶液和
溶液和 溶液。各取
溶液。各取 混合(忽略反应引起的溶液体积变化,下同),测得平衡时
混合(忽略反应引起的溶液体积变化,下同),测得平衡时 浓度为
浓度为 。
。
(2)实验Ⅱ:将 溶液、
溶液、 溶液与
溶液与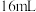 水混合,测得平衡时
水混合,测得平衡时 浓度为
浓度为 。
。
下列分析正确的是
 的平衡常数并探究常温下稀释对该平衡移动方向的影响。步骤如下:
的平衡常数并探究常温下稀释对该平衡移动方向的影响。步骤如下:(1)实验Ⅰ:配制
 溶液和
溶液和 溶液。各取
溶液。各取 混合(忽略反应引起的溶液体积变化,下同),测得平衡时
混合(忽略反应引起的溶液体积变化,下同),测得平衡时 浓度为
浓度为 。
。(2)实验Ⅱ:将
 溶液、
溶液、 溶液与
溶液与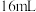 水混合,测得平衡时
水混合,测得平衡时 浓度为
浓度为 。
。下列分析正确的是
| A.配溶液所用玻璃仪器只需容量瓶、量筒和玻璃棒 |
B. |
| C.该组实验可作为判断稀释对该平衡移动方向影响的证据 |
D.测得该反应的 |
您最近一年使用:0次
2023-04-11更新
|
323次组卷
|
2卷引用:湖南省益阳市2023届高三下学期4月教学质量检测化学试题
名校
5 . 相同温度和压强下,研究Cl2在不同溶液中的溶解度(用溶解Cl2的物质的量浓度表示)随溶液浓度的变化。在NaCl溶液和盐酸中Cl2的溶解度以及各种含氯微粒的浓度变化如下图。

下列说法不正确的是

下列说法不正确的是
A.由图1可知,Cl2溶于NaCl溶液时还发生了反应Cl2+Cl-=Cl |
B.随NaCl溶液浓度增大,Cl2+H2O H++Cl-+HClO平衡逆移,Cl2溶解度减小 H++Cl-+HClO平衡逆移,Cl2溶解度减小 |
| C.随盐酸浓度增加Cl2与H2O的反应被抑制,生成Cl3-为主要反应从而抑制Cl2溶解 |
| D.由上述实验可知,H+浓度增大促进 Cl2溶解,由此推知在稀硫酸中,随硫酸浓度增大Cl2的溶解度会增大 |
您最近一年使用:0次
6 . 下列有关说法中,正确的是
A.在 KMnO4 酸性溶液做电解质的原电池中,MnO 一定向负极移动 一定向负极移动 |
| B.常温常压下能发生自发反应的两种物质,在常温常压下一定不能大量共存 |
| C.燃烧反应一定有电子的转移,并一定伴随着能量的放出 |
| D.其他条件不变时,向平衡体系 mA(g)+nB(g)=pC(g)中加入一定量的A,A的转化率一定减小 |
您最近一年使用:0次
名校
解题方法
7 . 某实验小组对KSCN的性质进行探究,设计如下实验:
(1)SCN—存在两种结构式,分别为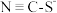 和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式
和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式__________________ 。
(2)①用离子方程式表示实验I溶液变红的原因_______ 。
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO ,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是
,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是___ (选填“阳离子交换膜”“阴离子交换膜”或“质子交换膜”)。
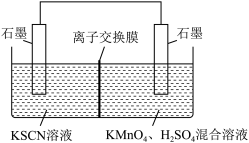
(3)针对实验II“红色明显变浅”的现象,实验小组进行探究。
甲同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN⇌[Fe(SCN)]2+平衡左移,红色明显变浅,而Zn2+与SCN-不络合,于是甲设计了如下实验:
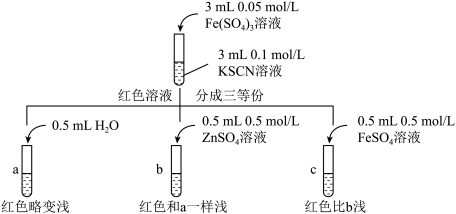
由此推测,实验II“红色明显变浅”的原因是____________ 。
(4)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(III),反应的化学方程式为Ti2(SO4)3+2NH4Fe(SO4)2=2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是_____________ 。
| 试管中试剂 | 实验 | 滴加试剂 | 现象 |
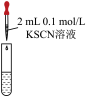 | I | i.先加1mL0.1mol/LFeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后褪色 |
II | iii.先加1 mL 0.05 mol/LFe2(SO4)3溶液 iv.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | iii.溶液变红 iv.红色明显变浅 |
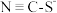 和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式
和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式(2)①用离子方程式表示实验I溶液变红的原因
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO
 ,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是
,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是
(3)针对实验II“红色明显变浅”的现象,实验小组进行探究。
甲同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN⇌[Fe(SCN)]2+平衡左移,红色明显变浅,而Zn2+与SCN-不络合,于是甲设计了如下实验:

由此推测,实验II“红色明显变浅”的原因是
(4)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(III),反应的化学方程式为Ti2(SO4)3+2NH4Fe(SO4)2=2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是
您最近一年使用:0次
2020-08-28更新
|
435次组卷
|
2卷引用:湖南省长沙市第一中学2020届高三第6次月考化学试题

 和生石灰混合体系加压
和生石灰混合体系加压 的K的表达式可知,压强增大不能使
的K的表达式可知,压强增大不能使

