名校
1 . 以下说法中操作正确、能达到目的且判断正确的是
选项 | 操作 | 目的 | 判断 |
A | 向 | 使 | 错误,根据反应 |
B | 合成氨时在经济性良好的范围内选择尽可能高的压强 | 增加 转化率 转化率 | 正确,压强增大使得反应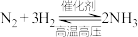 向右进行 向右进行 |
C | 向两支盛有2ml0.2mol/L的乙二酸试管中滴加1ml浓度分别为0.1mol/L和0.2mol/L的 溶液 溶液 | 探究反应物浓度对反应速率的影响 | 正确,浓度越大反应速率越快, 褪色越快 褪色越快 |
D | 向滴有KSCN溶液的 溶液中加入 溶液中加入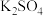 固体 固体 | 探究浓度对平衡的影响 | 正确,增加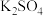 浓度,使 浓度,使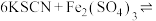 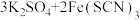 平衡移动 平衡移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 已知: 呈粉红色,
呈粉红色,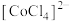 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: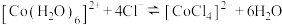 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:

以下结论和解释正确的是
 呈粉红色,
呈粉红色,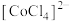 呈蓝色,
呈蓝色, 为无色。现将
为无色。现将 溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: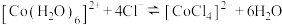 ,用该溶液做实验,溶液的颜色变化如下:
,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是
| A.由实验①可推知正反应为放热反应 |
B.等物质的量的 和 和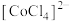 中 中 键数目之比为3∶2 键数目之比为3∶2 |
C.实验②是由于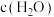 增大,导致平衡逆向移动 增大,导致平衡逆向移动 |
D.由实验③可知配离子的稳定性: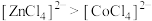 |
您最近一年使用:0次
名校
解题方法
3 . 某探究小组设计实验测定反应 的平衡常数并探究常温下稀释对该平衡移动方向的影响。步骤如下:
的平衡常数并探究常温下稀释对该平衡移动方向的影响。步骤如下:
(1)实验Ⅰ:配制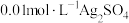 溶液和
溶液和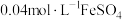 溶液。各取
溶液。各取 混合(忽略反应引起的溶液体积变化,下同),测得平衡时
混合(忽略反应引起的溶液体积变化,下同),测得平衡时 浓度为
浓度为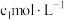 。
。
(2)实验Ⅱ:将 溶液、
溶液、 溶液与
溶液与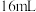 水混合,测得平衡时
水混合,测得平衡时 浓度为
浓度为 。
。
下列分析正确的是
 的平衡常数并探究常温下稀释对该平衡移动方向的影响。步骤如下:
的平衡常数并探究常温下稀释对该平衡移动方向的影响。步骤如下:(1)实验Ⅰ:配制
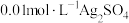 溶液和
溶液和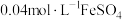 溶液。各取
溶液。各取 混合(忽略反应引起的溶液体积变化,下同),测得平衡时
混合(忽略反应引起的溶液体积变化,下同),测得平衡时 浓度为
浓度为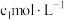 。
。(2)实验Ⅱ:将
 溶液、
溶液、 溶液与
溶液与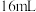 水混合,测得平衡时
水混合,测得平衡时 浓度为
浓度为 。
。下列分析正确的是
| A.配溶液所用玻璃仪器只需容量瓶、量筒和玻璃棒 |
B. |
| C.该组实验可作为判断稀释对该平衡移动方向影响的证据 |
D.测得该反应的 |
您最近一年使用:0次
2023-04-11更新
|
323次组卷
|
2卷引用:湖南省邵东市第一中学2023-2024学年高二上学期10月月考化学试题
名校
4 .  常用作制革工业的鞣革剂,工业上以铬铁矿(主要成分为
常用作制革工业的鞣革剂,工业上以铬铁矿(主要成分为 ,含
,含 、
、 氧化物等杂质)为主要原料制备
氧化物等杂质)为主要原料制备 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:
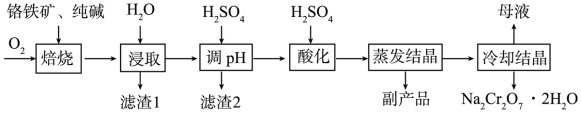
(1)铬铁矿“焙烧”前,为提高焙烧效率,可采取的措施有___________ (任写一点)。
(2)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(3)“滤渣1”的主要成分为 等难溶于水的物质,则“滤渣2”的主要成分为
等难溶于水的物质,则“滤渣2”的主要成分为___________ (填化学式)。
(4)已知各离子浓度的对数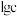 与
与 的关系如图甲所示。当溶液中某种粒子浓度
的关系如图甲所示。当溶液中某种粒子浓度 时,可认为该离子已除尽,则“调
时,可认为该离子已除尽,则“调 ”时
”时 的理论范围为
的理论范围为___________ ;“酸化”的目的是___________ 。
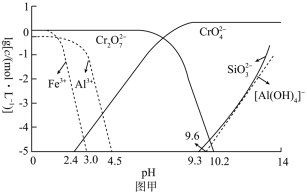
(5)利用膜电解技术,以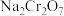 为主要原料制备
为主要原料制备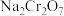 的工作原理如图乙所示(a、b电极材料均为石墨):a极与电源的
的工作原理如图乙所示(a、b电极材料均为石墨):a极与电源的___________ 极相连,制备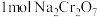 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重___________ g。
(6)为了测定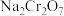 产品的纯度,可采用
产品的纯度,可采用 标准溶液通过氧化还原反应滴定
标准溶液通过氧化还原反应滴定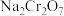 溶液。下列关于滴定分析的操作,正确的是___________(填标号)。
溶液。下列关于滴定分析的操作,正确的是___________(填标号)。
 常用作制革工业的鞣革剂,工业上以铬铁矿(主要成分为
常用作制革工业的鞣革剂,工业上以铬铁矿(主要成分为 ,含
,含 、
、 氧化物等杂质)为主要原料制备
氧化物等杂质)为主要原料制备 的工艺流程如图。回答下列问题:
的工艺流程如图。回答下列问题:
(1)铬铁矿“焙烧”前,为提高焙烧效率,可采取的措施有
(2)基态
 原子的价电子排布式为
原子的价电子排布式为(3)“滤渣1”的主要成分为
 等难溶于水的物质,则“滤渣2”的主要成分为
等难溶于水的物质,则“滤渣2”的主要成分为(4)已知各离子浓度的对数
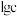 与
与 的关系如图甲所示。当溶液中某种粒子浓度
的关系如图甲所示。当溶液中某种粒子浓度 时,可认为该离子已除尽,则“调
时,可认为该离子已除尽,则“调 ”时
”时 的理论范围为
的理论范围为

(5)利用膜电解技术,以
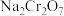 为主要原料制备
为主要原料制备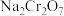 的工作原理如图乙所示(a、b电极材料均为石墨):a极与电源的
的工作原理如图乙所示(a、b电极材料均为石墨):a极与电源的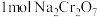 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重(6)为了测定
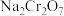 产品的纯度,可采用
产品的纯度,可采用 标准溶液通过氧化还原反应滴定
标准溶液通过氧化还原反应滴定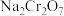 溶液。下列关于滴定分析的操作,正确的是___________(填标号)。
溶液。下列关于滴定分析的操作,正确的是___________(填标号)。A.用移液管量取 待测液转移至锥形瓶中 待测液转移至锥形瓶中 |
| B.滴定开始时可以让液体成线状快速流下,接近滴定终点时减慢滴加速率,必要时采用半滴操作 |
| C.排气泡时应使管尖弯曲向上,用右手挤压玻璃珠上方,使液体充满管尖 |
| D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直 |
您最近一年使用:0次
2022-09-09更新
|
171次组卷
|
2卷引用:湖南省株洲市攸县第一中学2022-2023学年高三上学期第三次月考化学试题
名校
5 . 相同温度和压强下,研究Cl2在不同溶液中的溶解度(用溶解Cl2的物质的量浓度表示)随溶液浓度的变化。在NaCl溶液和盐酸中Cl2的溶解度以及各种含氯微粒的浓度变化如下图。

下列说法不正确的是

下列说法不正确的是
A.由图1可知,Cl2溶于NaCl溶液时还发生了反应Cl2+Cl-=Cl |
B.随NaCl溶液浓度增大,Cl2+H2O H++Cl-+HClO平衡逆移,Cl2溶解度减小 H++Cl-+HClO平衡逆移,Cl2溶解度减小 |
| C.随盐酸浓度增加Cl2与H2O的反应被抑制,生成Cl3-为主要反应从而抑制Cl2溶解 |
| D.由上述实验可知,H+浓度增大促进 Cl2溶解,由此推知在稀硫酸中,随硫酸浓度增大Cl2的溶解度会增大 |
您最近一年使用:0次
名校
6 . 某实验小组从电极反应角度探究银镜反应中物质氧化性和还原性的变化。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式_______ 。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、_______ 。
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:_______ 。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是_______ 。
(3)设计实验进一步验证。
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因_______ 。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是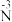 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是_______ 。
(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因_______ 。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
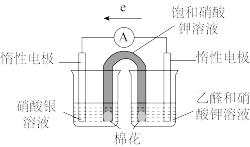
| 实验操作及现象: 实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转; 实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大; 实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小 |
(3)设计实验进一步验证。
| 实验 | 实验操作 | 实验现象 |
| Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁 |
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是
 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因
您最近一年使用:0次
2022-04-02更新
|
1048次组卷
|
7卷引用:湖南省常德市第一中学2022-2023学年高三下学期5月月考化学试题
7 . 2022年1月24日,习近平总书记在十九届中共中央政治局第三十六次集中学习时强调,实现碳达峰碳中和是贯彻新发展理念、构建新发展格局、推动高质量发展的内在要求。因此,二氧化碳的合理利用成为研究热点。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH1=-159.5kJ/mol
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.5kJ/mol
总反应III:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3
反应III的ΔH3=________ kJ/mol,据此判断该反应在________ (填“低温”、“高温”或“任意温度”)条件下能自发进行。
(2)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,以CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1=-122.5kJ/mol
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、II,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图1所示。

(已知:CH3OCH3的选择性=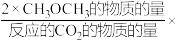 100%)
100%)
其中表示平衡时CH3OCH3的选择性的曲线是_______ (填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是________ ;为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为________ (填标号)。
a.高温、高压 b.低温、高压 c.高温、低压 d.低温、低压
②对于反应II的反应速率v=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
a.降低温度,k正-k逆________ (填“增大”、“减小”或”不变”);
b.在一定温度和压强下的反应II,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时,v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=________ 。
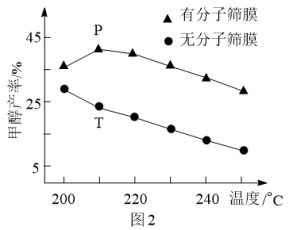
(3)用H2还原CO2可以合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图2所示。P点甲醇产率高于T点的原因为___________ 。
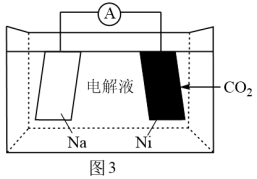
(4)CO2的再利用技术是促进可持续发展的措施之一,南开大学化学学院陈军院士课题组则成功研制出新型的Na-CO2电池,如图3是一种Na-CO2二次电池,其中钠和负载碳纳米管的镍网分别作为电极材料,电池放电产物为Na2CO3和C,则放电时正极电极反应式为___________ 。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH1=-159.5kJ/mol
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.5kJ/mol
总反应III:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3
反应III的ΔH3=
(2)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,以CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1=-122.5kJ/mol
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、II,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图1所示。

(已知:CH3OCH3的选择性=
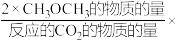 100%)
100%)其中表示平衡时CH3OCH3的选择性的曲线是
a.高温、高压 b.低温、高压 c.高温、低压 d.低温、低压
②对于反应II的反应速率v=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
a.降低温度,k正-k逆
b.在一定温度和压强下的反应II,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时,v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=
(3)用H2还原CO2可以合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图2所示。P点甲醇产率高于T点的原因为

(4)CO2的再利用技术是促进可持续发展的措施之一,南开大学化学学院陈军院士课题组则成功研制出新型的Na-CO2电池,如图3是一种Na-CO2二次电池,其中钠和负载碳纳米管的镍网分别作为电极材料,电池放电产物为Na2CO3和C,则放电时正极电极反应式为

您最近一年使用:0次
2022-03-29更新
|
428次组卷
|
2卷引用:湖南省娄底市第五中学2022届高三下学期5月月考化学试题
名校
解题方法
8 . 某实验小组对KSCN的性质进行探究,设计如下实验:
(1)SCN—存在两种结构式,分别为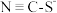 和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式
和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式__________________ 。
(2)①用离子方程式表示实验I溶液变红的原因_______ 。
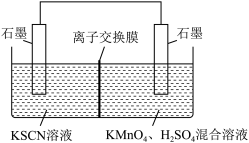
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO ,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是
,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是___ (选填“阳离子交换膜”“阴离子交换膜”或“质子交换膜”)。
(3)针对实验II“红色明显变浅”的现象,实验小组进行探究。
甲同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN⇌[Fe(SCN)]2+平衡左移,红色明显变浅,而Zn2+与SCN-不络合,于是甲设计了如下实验:
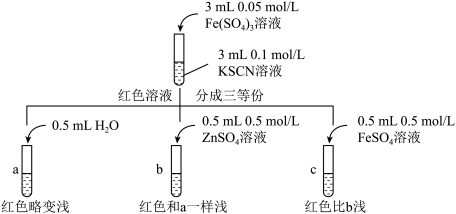
由此推测,实验II“红色明显变浅”的原因是____________ 。
(4)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(III),反应的化学方程式为Ti2(SO4)3+2NH4Fe(SO4)2=2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是_____________ 。
| 试管中试剂 | 实验 | 滴加试剂 | 现象 |
 | I | i.先加1mL0.1mol/LFeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后褪色 |
II | iii.先加1 mL 0.05 mol/LFe2(SO4)3溶液 iv.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | iii.溶液变红 iv.红色明显变浅 |
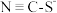 和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式
和S=C=N-,SCN-是二者的互变异构的混合物,请写出S=C=N-的电子式(2)①用离子方程式表示实验I溶液变红的原因
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO
 ,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是
,并设计如图实验装置证实了猜想是成立的。其中电解质溶液中的离子交换膜是
(3)针对实验II“红色明显变浅”的现象,实验小组进行探究。
甲同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN⇌[Fe(SCN)]2+平衡左移,红色明显变浅,而Zn2+与SCN-不络合,于是甲设计了如下实验:

由此推测,实验II“红色明显变浅”的原因是
(4)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(III),反应的化学方程式为Ti2(SO4)3+2NH4Fe(SO4)2=2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是
您最近一年使用:0次
2020-08-28更新
|
435次组卷
|
2卷引用:湖南省长沙市第一中学2020届高三第6次月考化学试题
名校
9 . 已知碳酸钙的分解为可逆反应,一定温度下,在容积为2L的恒容密闭容器甲中盛有10.0g纯净碳酸钙固体,反应达到平衡后,剩余固体8.9g;相同温度下,另有一真空密闭容器乙(活塞的质量与摩擦均不计,侧面足够长)中同样盛有10.0g纯净碳酸钙固体,在恒压下反应达到平衡后体积恰好为1L(不考虑固体体积)。下列说法正确的是
| A.平衡后再向乙容器中充入0.02molCO2气体,至容器体积不再变化时,c(CO2)=0.0125mol/L |
| B.平衡后再向乙容器中充入0.02molAr,至容器体积不再变化时,c(CO2)=0.0125mol/L |
| C.达到平衡后,容器乙中剩余固体质量小于容器甲中剩余固体质量 |
| D.甲、乙两容器的情况下,反应的平衡常数K都为0.025mol/L |
您最近一年使用:0次
10 . CO2催化重整CH4的反应:(Ⅰ)CH4(g)+CO2(g)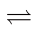 2CO(g)+2H2(g);ΔH1,
2CO(g)+2H2(g);ΔH1,
主要副反应:(Ⅱ)H2(g)+CO2(g)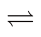 CO(g)+H2O(g);ΔH2>0,
CO(g)+H2O(g);ΔH2>0,
(Ⅲ)4H2(g)+CO2(g) CH4(g)+2H2O(g);ΔH3<0。
CH4(g)+2H2O(g);ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )
 2CO(g)+2H2(g);ΔH1,
2CO(g)+2H2(g);ΔH1,主要副反应:(Ⅱ)H2(g)+CO2(g)
 CO(g)+H2O(g);ΔH2>0,
CO(g)+H2O(g);ΔH2>0,(Ⅲ)4H2(g)+CO2(g)
 CH4(g)+2H2O(g);ΔH3<0。
CH4(g)+2H2O(g);ΔH3<0。在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )

| A.ΔH1=2ΔH2-ΔH3<0 |
| B.其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行 |
| C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量 |
| D.T℃时,在2.0L容器中加入2mol CH4、2mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81 |
您最近一年使用:0次
2020-06-16更新
|
877次组卷
|
6卷引用:湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题
湖南省新高考联盟2021届高三下学期3月提升检测化学(A)试题河北省廊坊市2021-2022学年上学期高三年级9月调研考试化学试题江苏省盐城市2020届高三下学期第三次模拟考试(6月)化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)四川省绵阳市高中2022-2023学年高二上学期期末摸底考试化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)

 和生石灰混合体系加压
和生石灰混合体系加压 的K的表达式可知,压强增大不能使
的K的表达式可知,压强增大不能使

