名校
解题方法
1 . I、II、III三个容积均为2L的恒容密闭容器中均投入1mol CO2 和3mol H2 ,在不同温度下发生反应:CO2(g) + 3H2⇌CH3OH(g) + H2O(g) 。反应10min,测得各容器内CO2的物质的量分别如图所示。下列说法正确的是
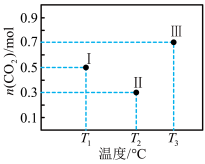

| A.升高温度、增大压强均有利于提高 H2的平衡转化率 |
| B.10min后,向容器Ⅲ中再加入1mol CO2 (g)和1mol H2O (g),此时反应逆向进行 |
| C.容器Ⅱ中的平均速率:v(CO2) =0.07 mol·L-1·min-1 |
| D.10min时,容器Ⅰ中 v(正) = v(逆) |
您最近一年使用:0次
名校
2 . 下列工业生产中采用的措施与目的相符合的是
| A.石油是重要的化工原料,其分馏的目的是为了获得乙烯、丙烯等短链不饱和烃 |
| B.SO2接触法制SO3在高温条件下进行,以提高SO3产率 |
| C.合成氨工业中原料气必须经过净化,以防止催化剂中毒 |
| D.海带提碘时通过浓缩提高碘离子浓度,以减少氧化剂的用量 |
您最近一年使用:0次
名校
3 . 25℃,向40mL 0.05mol/L  溶液中加入10mL 0.15mo/L KSCN溶液,混合溶液中
溶液中加入10mL 0.15mo/L KSCN溶液,混合溶液中 与反应时间(t)的变化如图所示(不考虑盐类水解),D点浓度不再变化。下列说法不正确的是
与反应时间(t)的变化如图所示(不考虑盐类水解),D点浓度不再变化。下列说法不正确的是
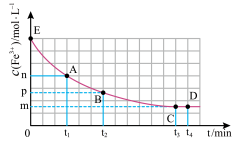
 溶液中加入10mL 0.15mo/L KSCN溶液,混合溶液中
溶液中加入10mL 0.15mo/L KSCN溶液,混合溶液中 与反应时间(t)的变化如图所示(不考虑盐类水解),D点浓度不再变化。下列说法不正确的是
与反应时间(t)的变化如图所示(不考虑盐类水解),D点浓度不再变化。下列说法不正确的是
A.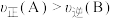 |
| B.E点对应的坐标为(0,0.04) |
C.该反应平衡常数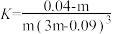 |
D. 时加入50mL 0.1mol/L KCl溶液,平衡不移动 时加入50mL 0.1mol/L KCl溶液,平衡不移动 |
您最近一年使用:0次
解题方法
4 . 下列叙述中,不能用勒夏特列原理解释的是
| A.新制氯水光照下颜色变浅 |
B.红棕色的 气体体系加压后颜色先变深后变浅 气体体系加压后颜色先变深后变浅 |
C.对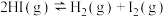 平衡体系增大压强使气体颜色变深 平衡体系增大压强使气体颜色变深 |
D.向橙色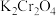 溶液中加入一定浓度的NaOH溶液后,溶液变为黄色 溶液中加入一定浓度的NaOH溶液后,溶液变为黄色 |
您最近一年使用:0次
名校
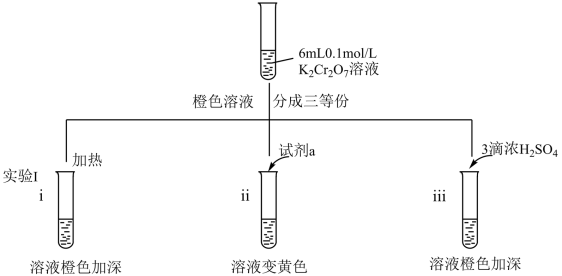
5 . 某兴趣小组以重铬酸钾⟨ )溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。下列关于该实验的说法不正确的是
)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。下列关于该实验的说法不正确的是
已知:① 溶液存在平衡:
溶液存在平衡: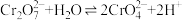 。
。
②含铬元素的离子在溶液中的颜色: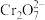 (橙色);
(橙色); (黄色);
(黄色); (绿色)。
(绿色)。
 )溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。下列关于该实验的说法不正确的是
)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。下列关于该实验的说法不正确的是
已知:①
 溶液存在平衡:
溶液存在平衡: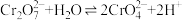 。
。②含铬元素的离子在溶液中的颜色:
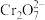 (橙色);
(橙色); (黄色);
(黄色); (绿色)。
(绿色)。A.ⅰ可证明反应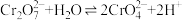 的正反应放热 的正反应放热 |
B.ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂 可以是 可以是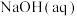 |
| C.向ⅲ所得橙色溶液中加入乙醇,溶液将由橙色变为绿色 |
| D.ⅲ平衡逆向移动可能原因不仅仅是增大了生成物的浓度 |
您最近一年使用:0次
6 . 下列事实中,不能用勒夏特列原理解释的是
A.常压环境更有利于工业上 催化氧化制 催化氧化制 |
| B.用浓氨水和氢氧化钠固体快速制取氨气 |
| C.新制氯水中加入适量碳酸钠固体制高浓度次氯酸溶液 |
| D.氯化钠固体和浓硫酸共热制少量氯化氢气体 |
您最近一年使用:0次
名校
7 . 科学探究是化学学科核心素养之一,下列实验方案设计中,能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明浓度对平衡FeCl3+3KSCN Fe(SCN)3+3KCl的影响 Fe(SCN)3+3KCl的影响 | 向FeCl3和KSCN的混合溶液中,加入少量的KCl固体 |
| B | 氯气与水的反应存在限度 | 取两份新制氯水,分别滴加AgNO3溶液和KI溶液 |
| C | KI3溶液中存在平衡: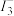  I2+I- I2+I- | 向盛有KI3溶液(显黄色)的①、②两支试管中分别滴加淀粉溶液、AgNO3溶液 |
| D | 证明HClO的酸性比CH3COOH弱 | 室温下,用pH试纸分别测定0.1mol·L-1的NaClO溶液和0.1mol·L-1的CH3COONa溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-12更新
|
156次组卷
|
2卷引用:湖北省武汉市部分重点中学2023-2024学年高二上学期期中联考化学试题
8 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
将等体积的 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。
实验记录如下:
(1)基态 的电子排布式
的电子排布式___________ 。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或
(蓝色)或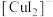 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去 的原理是
的原理是___________ 。
ii.查阅资料, (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:___________ ,___________ 。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,___________ (填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________ 。
(4)上述实验结果, 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
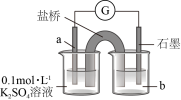
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为___________ ,b试剂为___________ 。
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。将等体积的
 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。实验记录如下:
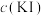 | 实验现象 | |
| 实验Ⅰ | 0.01 | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1 | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4 |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 的电子排布式
的电子排布式(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
 (蓝色)或
(蓝色)或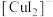 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去
 的原理是
的原理是ii.查阅资料,
 (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为
您最近一年使用:0次
2023-11-03更新
|
274次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高三上学期期中联考化学试题
名校
9 . 下列事实不能用勒夏特列原理解释的是
| A.实验室中常用排饱和食盐水的方式收集氯气 |
B.红棕色的 气体,加压后颜色先变深后变浅 气体,加压后颜色先变深后变浅 |
| C.合成氨工业中使用铁触媒作催化剂 |
D. 溶液加热后颜色由蓝绿色变为黄绿色 溶液加热后颜色由蓝绿色变为黄绿色 |
您最近一年使用:0次
2023-10-26更新
|
161次组卷
|
2卷引用:湖北省宜城市第一中学等六校2023-2024学年高二上学期期中考试化学试题
名校
10 . 实验教学是化学学科的重要辅助手段。下列实验方案、现象、得出的结论均正确的是
| 选项 | 实验操作及现象 | 结论及解释 |
| A | 常温下,用胶头滴管将待测NaOH溶液滴在湿润的pH试纸上,与标准比色卡对照 | 测得pH为13 |
| B | 在KSCN与FeCl3的混合液中再加入少量KCl固体,溶液颜色不变 | 增大Cl-浓度,平衡不移动 |
| C | 在相同条件下向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5% H2O2和1mL FeCl3溶液,可观察到后者产生气泡速度更快 | Fe3+可加快H2O2分解速率 |
| D | 某温度下,相同pH的盐酸与醋酸分别稀释相同倍数,稀释后溶液pH:盐酸>醋酸 | 酸性:盐酸<醋酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-08更新
|
385次组卷
|
3卷引用:湖北省孝感市2023-2024学年高二上学期11月期中考试化学试题



