名校
1 . 硫及其化合物在生产生活中有广泛的应用。请回答:
(1)室温下, 溶液呈碱性的原因是
溶液呈碱性的原因是___________ (用离子方程式表示)。
(2)下列关于硫及其化合物的说法,正确的是___________(填字母)。
(3)光谱研究表明, 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
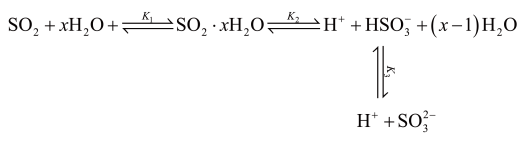
其中 为各步的平衡常数,且
为各步的平衡常数,且 (
( 表示
表示 的平衡压强)。
的平衡压强)。
①当 的平衡压强为
的平衡压强为 时,测得
时,测得 ,则溶液的
,则溶液的
___________  。(用含
。(用含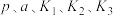 的式子表示)
的式子表示)
②滴加 至
至 时,溶液中
时,溶液中 。如果溶液中
。如果溶液中 ,需加
,需加 将溶液
将溶液 调整为约等于
调整为约等于___________ 。
(4)“钙基固硫”是利用石灰石将燃煤烟气中的 转化为
转化为 。但高温时
。但高温时 会与
会与 反应而影响脱硫效率。相关反应如下:
反应而影响脱硫效率。相关反应如下:
Ⅰ.
Ⅱ.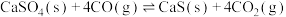
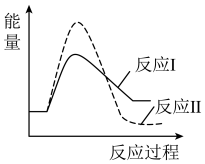
当 时,反应
时,反应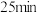 ,体系中
,体系中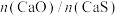 的比值随温度变化如下表所示:
的比值随温度变化如下表所示:
请结合题给反应过程能量图说明, 时,比值随温度升高逐渐减小的原因是
时,比值随温度升高逐渐减小的原因是______ 。
(5)氨水也可吸收 :
: ,
,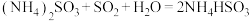 。能提高
。能提高 去除率的措施有___________(填字母)。
去除率的措施有___________(填字母)。
(1)室温下,
 溶液呈碱性的原因是
溶液呈碱性的原因是(2)下列关于硫及其化合物的说法,正确的是___________(填字母)。
| A.硫元素在自然界中只能以化合态形式存在 |
B. 通入紫色石蕊试液,溶液先变红后褪色 通入紫色石蕊试液,溶液先变红后褪色 |
C.酸雨是 的降水,主要是由污染物 的降水,主要是由污染物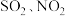 造成 造成 |
| D.浓硫酸中加入少量胆矾晶体,搅拌,固体逐渐变成白色 |
 的水溶液中存在下列平衡:
的水溶液中存在下列平衡: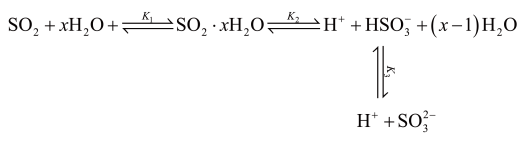
其中
 为各步的平衡常数,且
为各步的平衡常数,且 (
( 表示
表示 的平衡压强)。
的平衡压强)。①当
 的平衡压强为
的平衡压强为 时,测得
时,测得 ,则溶液的
,则溶液的
 。(用含
。(用含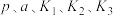 的式子表示)
的式子表示)②滴加
 至
至 时,溶液中
时,溶液中 。如果溶液中
。如果溶液中 ,需加
,需加 将溶液
将溶液 调整为约等于
调整为约等于(4)“钙基固硫”是利用石灰石将燃煤烟气中的
 转化为
转化为 。但高温时
。但高温时 会与
会与 反应而影响脱硫效率。相关反应如下:
反应而影响脱硫效率。相关反应如下:Ⅰ.

Ⅱ.
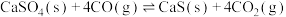

当
 时,反应
时,反应 ,体系中
,体系中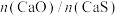 的比值随温度变化如下表所示:
的比值随温度变化如下表所示:| 温度 | 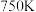 |  |  |
| 比值 | 3.57 | 1.08 | 3.42 |
 时,比值随温度升高逐渐减小的原因是
时,比值随温度升高逐渐减小的原因是(5)氨水也可吸收
 :
: ,
,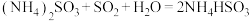 。能提高
。能提高 去除率的措施有___________(填字母)。
去除率的措施有___________(填字母)。| A.增大氨水浓度 | B.加热煮沸 |
| C.降低烟气的流速 | D.补充 ,将 ,将 氧化为 氧化为 |
您最近一年使用:0次
23-24高二上·浙江·期末
解题方法
2 . 为验证反应Fe3++Ag=Fe2++Ag+,利甩如图电池装置进行实验。
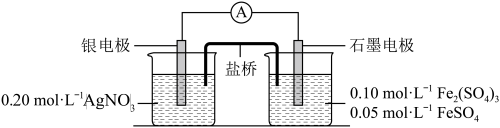
(1)由Fe2(SO4)3固体配制500 mL0.1 mol/LFe2(SO4)3溶液。在烧杯中溶解固体时,先加入一定体积的_______ 稀溶液,搅拌后再加入一定体积的水。
(2)电流表显示电流由银电极流向石墨电极。可知, 盐桥中的阳离子进入_______ 电极溶液中。
(3)根据(2)实验结果,可知石墨电极的电极反应式为_______ ,银电极的电极反应式为_______ 。因此,Fe3+氧化性小于_______ 。
(4)电池装置中,盐桥连接两电极电解质溶液。如果盐桥中电解质为KNO3,反应一段时间后,可以观察到电流表指针反转,原因是_______ 。

(1)由Fe2(SO4)3固体配制500 mL0.1 mol/LFe2(SO4)3溶液。在烧杯中溶解固体时,先加入一定体积的
(2)电流表显示电流由银电极流向石墨电极。可知, 盐桥中的阳离子进入
(3)根据(2)实验结果,可知石墨电极的电极反应式为
(4)电池装置中,盐桥连接两电极电解质溶液。如果盐桥中电解质为KNO3,反应一段时间后,可以观察到电流表指针反转,原因是
您最近一年使用:0次
3 . 现有反应

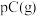 ,ΔH<0,达到平衡后,减小压强,混合物体系中C的质量分数减小,则:
,ΔH<0,达到平衡后,减小压强,混合物体系中C的质量分数减小,则:
(1)该反应
_______ p(填“>”“=”或“<”)。
(2)该反应在一定条件下能否自发进行_______ (填“能”或“不能”),说明理由_______ 。
(3)若B是有色物质,A、C均无色,则加入C(容器容积不变)时混合物的颜色_______ (填“变深”、“变浅”或“不变”);若容器容积不变,充入氖气时,容器内压强增大,这时化学平衡_______ 移动(填“正向”、“逆向”或“不”)。


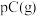 ,ΔH<0,达到平衡后,减小压强,混合物体系中C的质量分数减小,则:
,ΔH<0,达到平衡后,减小压强,混合物体系中C的质量分数减小,则:(1)该反应

(2)该反应在一定条件下能否自发进行
(3)若B是有色物质,A、C均无色,则加入C(容器容积不变)时混合物的颜色
您最近一年使用:0次
名校
4 . 填空。
(1)实验室常用排饱和食盐水法代替排水法收集 。请用方程式和必要的文字解释原因
。请用方程式和必要的文字解释原因_______ 。
(2)苯胺(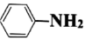 )与甲苯(
)与甲苯( )的相对分子质量相近,但苯胺沸点(184.4℃)高于甲苯沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺沸点(184.4℃)高于甲苯沸点(110.6℃),原因是_______ 。
(1)实验室常用排饱和食盐水法代替排水法收集
 。请用方程式和必要的文字解释原因
。请用方程式和必要的文字解释原因(2)苯胺(
 )与甲苯(
)与甲苯( )的相对分子质量相近,但苯胺沸点(184.4℃)高于甲苯沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺沸点(184.4℃)高于甲苯沸点(110.6℃),原因是
您最近一年使用:0次
2021-09-21更新
|
295次组卷
|
2卷引用:浙江省嘉兴市2022届高三上学期9月基础测试化学试题
5 . (1)用一个离子反应方程式说明 和
和 结合
结合 能力的相对强弱
能力的相对强弱______ 。
(2)冰的密度比水的密度小,能浮在水面上。主要原因是______ 。
(3)用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体
______ 。
 和
和 结合
结合 能力的相对强弱
能力的相对强弱(2)冰的密度比水的密度小,能浮在水面上。主要原因是
(3)用平衡移动原理解释为什么用饱和食盐水除去氯气中的杂质气体

您最近一年使用:0次
19-20高三·浙江·阶段练习
6 . 雾霾由多种污染物形成,包含颗粒物(PM2.5)、氮氧化物(NOx)、CO、 SO2等。化学在解决雾霾污染问题中有着重要的作用。
(1)研究发现利用NH3可除去硝酸工业尾气中的NO。NH3与NO的物质的量之比分别为1:2、1:1.5、3:1时,NO 脱除率随温度变化的曲线如图所示。

①曲线c对应的NH3与NO的物质的量之比是_______ ,其理由是_______ 。
②曲线a中,NO的起始浓度为6×10-4 mg/m3,若从X点到Y点经过20 s,则该时间段内NO的脱除速率为_______ mg/(m3.s)。
(2)若反应2NO(g)+2CO(g)⇌ N2(g)+2CO2(g) 的正、逆反应速率分别可表示为v正=k正c2(NO) 。c2(CO);v逆=k逆c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1 L的恒容密闭容器中加入4 mol NO和4 mol CO发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。

①a点时,v正:v逆=_______ 。
②测得平衡时体系压强为p,Kp为用气体分压表示的平衡常数,分压=总压×物质的量分数,则平衡常数Kp=_______ (用含p的式子表示)。
(3)某研究小组探究该反应中催化剂对脱氨率(NO的转化率)的影响。将等物质的量的NO和CO以一定的流速分别通过催化剂a、b,发生反应2NO(g)+2CO(g) N2(g) +2CO2(g)。 相同时间、不同温度下测得使用催化剂a时脱氮率与温度的关系如图中曲线I所示。已知催化效率b>a,催化剂b的活性在450℃时最大(未达平衡)。请在图中画出使用催化剂b时所对应的曲线(从300℃开始画)
N2(g) +2CO2(g)。 相同时间、不同温度下测得使用催化剂a时脱氮率与温度的关系如图中曲线I所示。已知催化效率b>a,催化剂b的活性在450℃时最大(未达平衡)。请在图中画出使用催化剂b时所对应的曲线(从300℃开始画)_______ 。

(1)研究发现利用NH3可除去硝酸工业尾气中的NO。NH3与NO的物质的量之比分别为1:2、1:1.5、3:1时,NO 脱除率随温度变化的曲线如图所示。

①曲线c对应的NH3与NO的物质的量之比是
②曲线a中,NO的起始浓度为6×10-4 mg/m3,若从X点到Y点经过20 s,则该时间段内NO的脱除速率为
(2)若反应2NO(g)+2CO(g)⇌ N2(g)+2CO2(g) 的正、逆反应速率分别可表示为v正=k正c2(NO) 。c2(CO);v逆=k逆c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1 L的恒容密闭容器中加入4 mol NO和4 mol CO发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。

①a点时,v正:v逆=
②测得平衡时体系压强为p,Kp为用气体分压表示的平衡常数,分压=总压×物质的量分数,则平衡常数Kp=
(3)某研究小组探究该反应中催化剂对脱氨率(NO的转化率)的影响。将等物质的量的NO和CO以一定的流速分别通过催化剂a、b,发生反应2NO(g)+2CO(g)
 N2(g) +2CO2(g)。 相同时间、不同温度下测得使用催化剂a时脱氮率与温度的关系如图中曲线I所示。已知催化效率b>a,催化剂b的活性在450℃时最大(未达平衡)。请在图中画出使用催化剂b时所对应的曲线(从300℃开始画)
N2(g) +2CO2(g)。 相同时间、不同温度下测得使用催化剂a时脱氮率与温度的关系如图中曲线I所示。已知催化效率b>a,催化剂b的活性在450℃时最大(未达平衡)。请在图中画出使用催化剂b时所对应的曲线(从300℃开始画)
您最近一年使用:0次
7 . (1)过氧化钠(Na2O2)是常见的供氧剂,是航空航天和潜水常用呼吸面具的主要成分,请写出过氧化钠的电子式:___ 。
(2)1g甲烷气体完全燃烧生成液态水时放56kJ的热量,请写出甲烷完全燃烧的热化学方程式:___ 。
(3)取久置硫酸酸化的硫酸亚铁溶液加入KSCN溶液,溶液显血红色,请用离子方程式解释原因①:___ ;②Fe3++3SCN-=Fe(SCN)3。
(4)酸性:H2SO4<HClO4,HClO4的沸点为90℃,已知能发生H2SO4(浓)+NaClO4 HClO4+NaHSO4,试从化学平衡移动的角度说明反应能发生的理由:
HClO4+NaHSO4,试从化学平衡移动的角度说明反应能发生的理由:___ 。
(2)1g甲烷气体完全燃烧生成液态水时放56kJ的热量,请写出甲烷完全燃烧的热化学方程式:
(3)取久置硫酸酸化的硫酸亚铁溶液加入KSCN溶液,溶液显血红色,请用离子方程式解释原因①:
(4)酸性:H2SO4<HClO4,HClO4的沸点为90℃,已知能发生H2SO4(浓)+NaClO4
 HClO4+NaHSO4,试从化学平衡移动的角度说明反应能发生的理由:
HClO4+NaHSO4,试从化学平衡移动的角度说明反应能发生的理由:
您最近一年使用:0次
名校
8 . 在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O 2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
(1)向上述溶液中加入NaOH溶液,溶液呈______ 色
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈______ 色
(3)向原溶液中逐渐加入足量硝酸钡溶液 已知BaCrO4为黄色沉淀
已知BaCrO4为黄色沉淀 ,则平衡
,则平衡 ______  填“向左移动”或“向右移动”
填“向左移动”或“向右移动” ,溶液颜色将
,溶液颜色将 ______ .
 2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.(1)向上述溶液中加入NaOH溶液,溶液呈

(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈

(3)向原溶液中逐渐加入足量硝酸钡溶液
 已知BaCrO4为黄色沉淀
已知BaCrO4为黄色沉淀 ,则平衡
,则平衡  填“向左移动”或“向右移动”
填“向左移动”或“向右移动” ,溶液颜色将
,溶液颜色将
您最近一年使用:0次
2019-11-03更新
|
82次组卷
|
2卷引用:浙江省宁波市北仑中学2019-2020学年高二下学期期中考试化学(选考)试题
15-16高三上·安徽安庆·阶段练习
解题方法
9 . 工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:
CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:
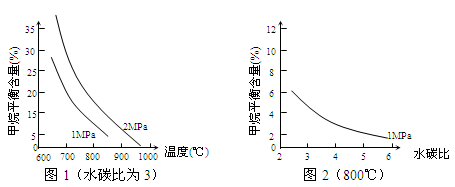
(1)CH4(g)+H2O(g) CO(g)+3H2(g) 的△H
CO(g)+3H2(g) 的△H_______ 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将_____________ 移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是_______________________ 。
(3)其他条件不变,请在图2中画出 压强为2 MPa时,甲烷平衡含量(%)与水碳比之间关系曲线___________ 。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少________ ?(写出计算过程,结果保留小数点后一位数字。)
 CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:
CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:
(1)CH4(g)+H2O(g)
 CO(g)+3H2(g) 的△H
CO(g)+3H2(g) 的△H(2)温度对该反应的反应速率和平衡移动的影响是
(3)其他条件不变,请在图2中
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少
您最近一年使用:0次
2016-12-09更新
|
338次组卷
|
3卷引用:2021年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷01
名校
10 . Ⅰ.在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈___________ 色,因为___________ 。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈___________ 色,因为_______________ 。
Ⅱ.将CoCl2溶于浓盐酸中能形成CoCl42—。溶液中存在如下平衡:CoCl42-(蓝色) + 6H2O Co(H2O)62+(粉红色)+ 4Cl-
Co(H2O)62+(粉红色)+ 4Cl-
(3)一般情况下,CoCl2溶液呈紫色,将盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则正反应方向为___________ 反应(填“吸热”或“放热”)。
(4)该反应平衡常数表达式为______________________ ,加水稀释平衡向____________ 方向(填“正”或“逆”)移动。
(5)向溶液中加入少量AgNO3固体,溶液颜色变为_______ 色。
 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。(1)向上述溶液中加入NaOH溶液,溶液呈
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈
Ⅱ.将CoCl2溶于浓盐酸中能形成CoCl42—。溶液中存在如下平衡:CoCl42-(蓝色) + 6H2O
 Co(H2O)62+(粉红色)+ 4Cl-
Co(H2O)62+(粉红色)+ 4Cl-(3)一般情况下,CoCl2溶液呈紫色,将盛有CoCl2溶液的试管放在热水中溶液逐渐变成蓝色,则正反应方向为
(4)该反应平衡常数表达式为
(5)向溶液中加入少量AgNO3固体,溶液颜色变为
您最近一年使用:0次



