1 . 盐酸羟胺(化学式为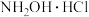 )是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
)是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
实验室以环己酮肟、盐酸为原料制备盐酸羟胺的反应原理如下:
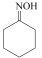 (环己酮肟)
(环己酮肟)
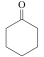 (环己酮)
(环己酮)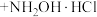
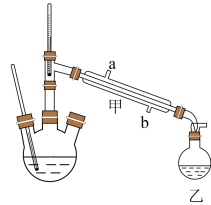
制备盐酸羟胺的实验装置如图所示(加热、搅拌和夹持装置已省略)。
盐酸羟胺在不同温度下的溶解度如下表:
(1)仪器甲中进水口应为___________ 。
A.a处 B.b处 C.a处或b处均可
(2)反应过程中,将环已酮不断蒸出的主要原因是___________ 。
(3)容器乙中收集到环己酮的水溶液,环已酮和水之间存在的相互作用有___________。
(4)反应后,从三口烧瓶的溶液中获取盐酸羟胺的实验方法为___________。
称取0.500g由上述方法制得的盐酸羟胺产品,加水配制成100mL溶液。量取20.00mL于锥形瓶中,加入适量稀硫酸酸化,再加入过量硫酸铁铵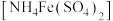 溶液充分反应,接着加入足量磷酸溶液(与
溶液充分反应,接着加入足量磷酸溶液(与 形成无色配合物),最后用
形成无色配合物),最后用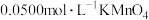 的酸性溶液滴定,达到滴定终点时消耗
的酸性溶液滴定,达到滴定终点时消耗 的酸性溶液的体积为11.35mL。
的酸性溶液的体积为11.35mL。
反应原理为:①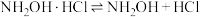
②
③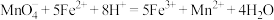
(5)将反应②补充完整,并标出电子转移的方向和数目___________ 。
(6)配制上述盐酸羟胺溶液所需要的定量仪器有___________ 。
A.电子天平 B.100mL容量瓶 C.滴定管 D.量筒
判断滴定终点的现象为___________ 。
(7)通过计算判断该产品的纯度级别___________ 。(写出计算过程)
已知:
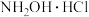 )是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。
)是一种重要的化工产品,可作还原剂、显像剂等,其熔点为152℃,易溶于水。实验室以环己酮肟、盐酸为原料制备盐酸羟胺的反应原理如下:
 (环己酮肟)
(环己酮肟)
 (环己酮)
(环己酮)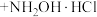
制备盐酸羟胺的实验装置如图所示(加热、搅拌和夹持装置已省略)。

盐酸羟胺在不同温度下的溶解度如下表:
| 温度(℃) | 溶解度(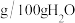 ) ) |
| 20 | 46.7 |
| 40 | 54.9 |
| 60 | 63.2 |
| 80 | 71.1 |
A.a处 B.b处 C.a处或b处均可
(2)反应过程中,将环已酮不断蒸出的主要原因是
(3)容器乙中收集到环己酮的水溶液,环已酮和水之间存在的相互作用有___________。
| A.共价键 | B.离子键 | C.氢键 | D.范德华力 |
| A.冷却结晶 | B.渗析 | C.蒸馏 | D.萃取、分液 |
称取0.500g由上述方法制得的盐酸羟胺产品,加水配制成100mL溶液。量取20.00mL于锥形瓶中,加入适量稀硫酸酸化,再加入过量硫酸铁铵
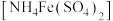 溶液充分反应,接着加入足量磷酸溶液(与
溶液充分反应,接着加入足量磷酸溶液(与 形成无色配合物),最后用
形成无色配合物),最后用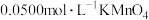 的酸性溶液滴定,达到滴定终点时消耗
的酸性溶液滴定,达到滴定终点时消耗 的酸性溶液的体积为11.35mL。
的酸性溶液的体积为11.35mL。反应原理为:①
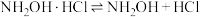
②

③
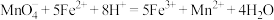
(5)将反应②补充完整,并标出电子转移的方向和数目
(6)配制上述盐酸羟胺溶液所需要的定量仪器有
A.电子天平 B.100mL容量瓶 C.滴定管 D.量筒
判断滴定终点的现象为
(7)通过计算判断该产品的纯度级别
| 纯度级别 | 优级纯 | 分析纯 | 化学纯 |
质量分数 | 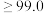 |  |  |

您最近一年使用:0次
2024-01-13更新
|
364次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
上海市四区联考2023-2024学年高三上学期化学一模试卷(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)上海市嘉定区第二中学2023-2024学年高三上学期第一次质量调研 化学试卷
名校
解题方法
2 . 实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是____ 。
(2)写出C中制备NaHSO3的离子方程式____ 。
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
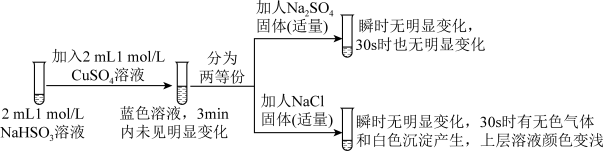
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO 的还原性
的还原性
b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_____ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
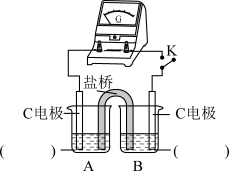
ⅰ.补全电化学装置示意图____ 。
ⅱ.写出B中的电极反应方程式____ 。
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,____ ,使HSO 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+ HAuCl4
HAuCl4
(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:____ 。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO
 的还原性
的还原性b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 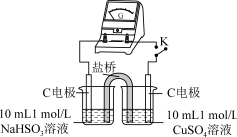 | 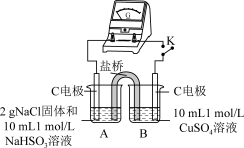 |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

ⅰ.补全电化学装置示意图
ⅱ.写出B中的电极反应方程式
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+
 HAuCl4
HAuCl4(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:
您最近一年使用:0次
名校
解题方法
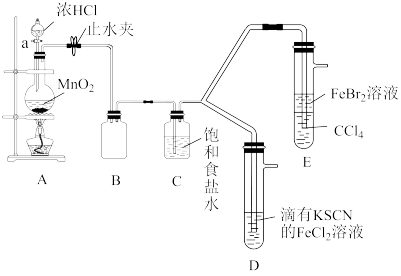
3 . 硫氰酸钾(KSCN),是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
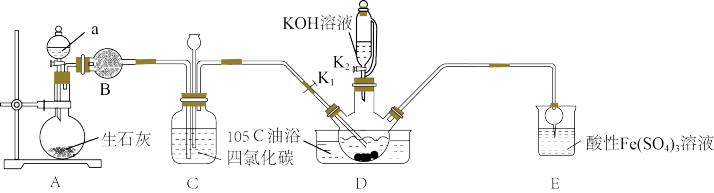
已知:① 不溶于
不溶于 和
和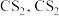 不溶于水且密度比水大;
不溶于水且密度比水大;
②D中三颈烧瓶内盛放 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且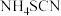 在高于170℃时易分解,
在高于170℃时易分解,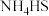 在高于25℃时即分解。
在高于25℃时即分解。
回答下列问题:
(1)试剂a是____ ,装置D中盛装KOH溶液的仪器名称是_______ 。
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是___ 。
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是___ 。
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经___ (填操作名称)、减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰酸钾晶体。
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因___ 。
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:____ 。

已知:①
 不溶于
不溶于 和
和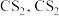 不溶于水且密度比水大;
不溶于水且密度比水大;②D中三颈烧瓶内盛放
 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且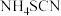 在高于170℃时易分解,
在高于170℃时易分解,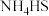 在高于25℃时即分解。
在高于25℃时即分解。回答下列问题:
(1)试剂a是
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:
您最近一年使用:0次
2021-03-11更新
|
1367次组卷
|
7卷引用:辽宁省葫芦岛市2021届高三第二次模拟考试化学试题
辽宁省葫芦岛市2021届高三第二次模拟考试化学试题(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)山东省潍坊市2021届高三第一次模拟考试化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)福建省厦门外国语学校2021届高三5月高考适应性考试化学试题(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】
名校
解题方法
4 . 根据下列实验设计,回答问题:

(1)利用实验(I)探究锌与 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___________ 。
(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在: (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
①依据题意写出其中的离子方程式___________ ,
②用平衡移动原理解释D颜色变浅的原因:___________ ;
③加水稀释,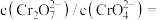
___________ (答“变大”、“变小”或“不变”)
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应: 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:
①由实验i、实验ii可得出的结论是___________ 。
②关于实验i中 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂: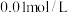 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入 酸性
酸性 溶液,
溶液,___________ ,最后加入 草酸溶液。
草酸溶液。
③基于以上实验与分析,推测实验(III)设计___________ (填“能”或“不能”)达到实验目的。

(1)利用实验(I)探究锌与
 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在:
 (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,①依据题意写出其中的离子方程式
②用平衡移动原理解释D颜色变浅的原因:
③加水稀释,
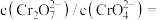
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应:
 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入 酸性 酸性 溶液,再加入1滴 溶液,再加入1滴 硫酸和9滴蒸馏水、最后加入 硫酸和9滴蒸馏水、最后加入 草酸溶液 草酸溶液 | 前 内溶液紫色无明显变化,后颜色逐渐变浅, 内溶液紫色无明显变化,后颜色逐渐变浅,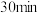 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入 酸性 酸性 溶液,再加入10滴 溶液,再加入10滴 硫酸,最后加入 硫酸,最后加入 草酸溶液 草酸溶液 |  内溶液紫色无明显变化,后颜色迅速变浅,约 内溶液紫色无明显变化,后颜色迅速变浅,约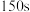 后几乎变为无色 后几乎变为无色 |
②关于实验i中
 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。提供的试剂:
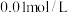 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。补全实验ⅲ的操作:向试管中先加入
 酸性
酸性 溶液,
溶液, 草酸溶液。
草酸溶液。③基于以上实验与分析,推测实验(III)设计
您最近一年使用:0次
5 . 已知铁离子、氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如图实验探究其氧化性强弱:
(1)装置A中发生反应的离子方程式是_______ 。
(2)整套实验装置存在一处明显的不足,请指出:_______ 。
(3)用改正后的装置进行实验,实验过程如表:
(4)因忙于观察和记录,没有及时停止反应,D、E中均发生新的变化。
D装置中:血红色慢慢褪去。
E装置中: 层颜色逐渐加深,直至变成红色。
层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料为:
①请用平衡移动原理(结合上述资料)解释 过量时D中溶液血红色褪去的原因:
过量时D中溶液血红色褪去的原因:_______ 。
②现设计简单实验证明上述解释:取少量褪色后的溶液,滴加_______ 溶液,若溶液颜色_______ ,则上述解释是合理的。
小组同学另查得资料为:
③欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入 溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:_______ 。

(1)装置A中发生反应的离子方程式是
(2)整套实验装置存在一处明显的不足,请指出:
(3)用改正后的装置进行实验,实验过程如表:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变血红色; E装置中:水层溶液变黄,振荡后,  层明显变化;一段时间后 层明显变化;一段时间后 | 氧化性由强到弱的顺序为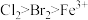 |
D装置中:血红色慢慢褪去。
E装置中:
 层颜色逐渐加深,直至变成红色。
层颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料为:
ⅰ.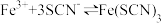 是一个可逆反应。 是一个可逆反应。ⅱ. 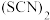 性质与卤素单质类似。氧化性: 性质与卤素单质类似。氧化性: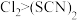 。 。 |
 过量时D中溶液血红色褪去的原因:
过量时D中溶液血红色褪去的原因:②现设计简单实验证明上述解释:取少量褪色后的溶液,滴加
小组同学另查得资料为:
ⅲ. 和 和 反应生成 反应生成 , , 呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。ⅳ. 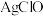 、 、 均可溶于水。 均可溶于水。 |
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入
 溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
您最近一年使用:0次
解题方法
6 . 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
I.探究反应产生的气体成分。
(1)经检验反应产生的气体有H2,实验室检验H2的方法为_______ 。
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
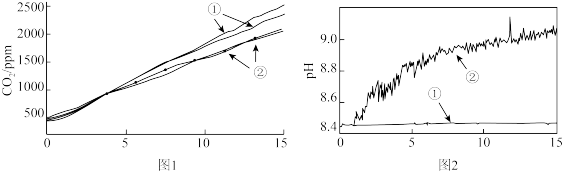
图1中曲线②对应的CO2含量逐渐增大的原因为_______ (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为_______ 。
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:
(3)结合实验1和4,可知溶液中的HCO 加快了反应的发生。
加快了反应的发生。
①实验4中横线处内容为_______ 。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为
能加快该反应的原因为_______ 。
III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为_______ (填字母编号)。

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=_______ 。
| 实验序号 | 实验操作 | 实验现象 |
| 1 | 向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
(1)经检验反应产生的气体有H2,实验室检验H2的方法为
(2)小组成员认为反应产生的气体中可能有CO2,并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
| 实验序号 | 实验操作 |
| 2 | 分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线 |
| 3 | 分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线 |

图1中曲线②对应的CO2含量逐渐增大的原因为
II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO
 加快了该反应的发生,对比实验1设计实验如下:
加快了该反应的发生,对比实验1设计实验如下:| 实验序号 | 实验操作 | 实验现象 |
| 4 | 向_______溶液中加入长3 cm的镁条 | 持续快速产生大量气泡,溶液略显浑浊 |
 加快了反应的发生。
加快了反应的发生。①实验4中横线处内容为
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO
 能加快该反应的原因为
能加快该反应的原因为III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
(4)甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为

(5)乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=
您最近一年使用:0次
2022-04-09更新
|
1140次组卷
|
7卷引用:河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题
河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(实验探究题)(已下线)化学-2022年高考押题预测卷01(福建卷)(已下线)化学-2022年高考押题预测卷03(山东卷)(已下线)押江苏卷第17题 化学实验综合题 -备战2022年高考化学临考题号押题(江苏卷)
名校
7 . 相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:
资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3- Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21
(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为___________ ,B的作用为___________ 。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________ 。
(3)D中用NaOH溶液进行尾气处理,存在的问题是___________ 、___________ 。
(实验2)通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。
(4)取实验2中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是___________ 。
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是___________ 。
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:___________ [Fe(C2O4)3]3-
___________ FeC2O4↓+___________ ↑+___________
(实验3)又设计以下装置直接比较Fe2+和C2O 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
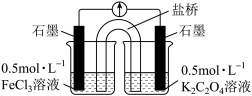
(7)描述达到预期目的可能产生的现象:___________ 。
 )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-
 Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是
(3)D中用NaOH溶液进行尾气处理,存在的问题是
(实验2)通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。操作 | 现象 |
| 在避光处,向10mL 0.5 mol·L-1FeCl3溶液中缓慢加入0.5 mol·L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到亮绿色溶液和亮绿色晶体 |
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:

(实验3)又设计以下装置直接比较Fe2+和C2O
 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
(7)描述达到预期目的可能产生的现象:
您最近一年使用:0次
2020-12-11更新
|
1229次组卷
|
4卷引用:黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题
黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)黑龙江省哈尔滨市第九中学2021届高三上学期第四次验收化学试卷重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题
8 . 为探讨化学平衡移动原理与氧化还原反应规律的联系,小睿同学通过改变浓度研究:“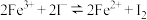 ”反应中Fe3+和Fe2+的相互转化。实验如下:
”反应中Fe3+和Fe2+的相互转化。实验如下:
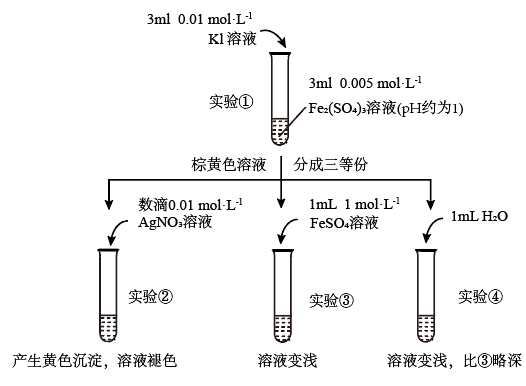
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到_______ 。
(2)实验④是实验③的_______ 试验,目的是_______ 。
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致 的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
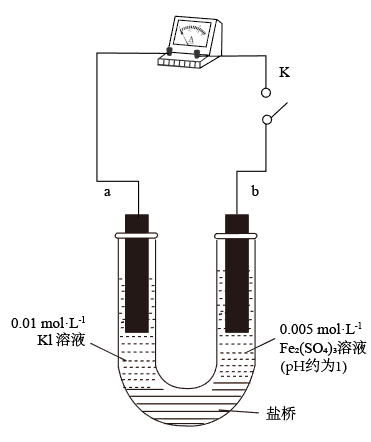
①K闭合时,指针向右偏转,b作_______ 极。
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是_______ 。
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是_______ 。
②与(3)实验对比,不同的操作是_______ 。
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是_______ 。
 ”反应中Fe3+和Fe2+的相互转化。实验如下:
”反应中Fe3+和Fe2+的相互转化。实验如下:
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到
(2)实验④是实验③的
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致
 的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是
②与(3)实验对比,不同的操作是
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是
您最近一年使用:0次
2021-04-26更新
|
289次组卷
|
3卷引用:2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)
(已下线)2.3.2 影响化学平衡状态的因素-2021-2022学年高二化学课后培优练(人教版选修4)江苏省昆山市2020-2021学年高二下学期期中教学质量调研化学试题江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题
名校
解题方法
9 . 氯化亚铜为白色难溶于水,不溶于乙醇的固体。可用作催化剂、脱色剂,实验室制备它的流程之一如下: 的装置如图所示:
的装置如图所示:
(1)B中试剂是________ (填名称),装置A中发生反应的物质不可能是下列中的___________ (填标号)。
A. 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO
(2)适合点燃C处酒精灯的标志是______________ ,进入C处反应装置中的气体中含有少量HCl,实验中没有除去HCl的原因是________________________ 。
(3)试剂a可以是NaOH,也可以是_________ (填一种),写出NaOH与尾气主要反应的化学方程式____________________ 。
(4)“还原”过程中浓盐酸的作用是_____________ 。向 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是____________________ 。
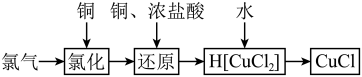
 的装置如图所示:
的装置如图所示: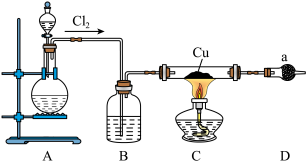
(1)B中试剂是
A.
 、浓盐酸 B.浓盐酸、
、浓盐酸 B.浓盐酸、 C.浓硫酸、NaCl、KClO
C.浓硫酸、NaCl、KClO(2)适合点燃C处酒精灯的标志是
(3)试剂a可以是NaOH,也可以是
(4)“还原”过程中浓盐酸的作用是
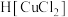 中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
中加水后,析出的CuCl经水洗后立即用乙醇洗涤,真空干燥,密封保存,真空干燥的目的是
您最近一年使用:0次
2024-06-06更新
|
55次组卷
|
2卷引用:2024届湘豫名校高三下学期考前保温卷理综试题-高中化学
10 . 二氯异氰尿酸钠(NaC3N3O3Cl2,摩尔质量为220g/mol)是一种高效广谱杀菌消毒剂,常温下为白色固体,难溶于冷水,可用次氯酸钠与氰尿酸(C3H3N3O3)制得,其制备原理为:2NaClO+C3H3N3O3=NaC3N3O3Cl2+NaOH+H2O。某小组选择下列部分装置制备二氯异氰尿酸钠并测定产品纯度。
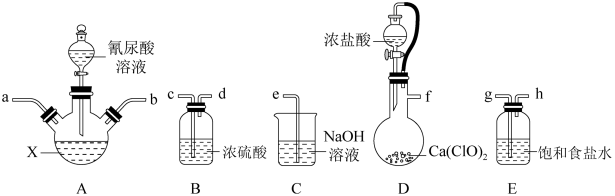
回答下列问题:
(1)A装置中盛装X试剂的仪器名称是___________ ,D中软导管的作用是___________ 。
(2)请选择合适的装置,按气流从左至右方向组装,则导管连接顺序为___________ (填小写字母)。
(3)D中发生反应的离子方程式为___________ 。
(4)X试剂为饱和NaOH溶液。实验时先向A中通入氯气,生成高浓度的NaClO溶液后,再加入氰尿酸溶液。在加入氰尿酸溶液后还要继续通入一定量的氯气,其原因是___________ 。
(5)反应结束后,A中浊液经过滤、___________ 、干燥得到粗产品。该系列操作需要用到如图所示的玻璃仪器有___________ (填字母)。

(6)粗产品中NaC3N3O3Cl2含量测定。称取ag粗产品溶于无氧蒸馏水中配制成250mL溶液,取25.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用cmol/LNa2S2O3标准溶液进行滴定,加入淀粉指示剂,滴定至终点,平均消耗VmLNa2S2O3溶液。(假设杂质不与KI反应,过程中涉及的反应为: +3H++4I-=C3H3N3O3+2I2+2Cl-,I2+2
+3H++4I-=C3H3N3O3+2I2+2Cl-,I2+2 =2I-+
=2I-+ )。则NaC3N3O3Cl2的含量为
)。则NaC3N3O3Cl2的含量为___________ %(用含a、c、V的代数式表示)。

回答下列问题:
(1)A装置中盛装X试剂的仪器名称是
(2)请选择合适的装置,按气流从左至右方向组装,则导管连接顺序为
(3)D中发生反应的离子方程式为
(4)X试剂为饱和NaOH溶液。实验时先向A中通入氯气,生成高浓度的NaClO溶液后,再加入氰尿酸溶液。在加入氰尿酸溶液后还要继续通入一定量的氯气,其原因是
(5)反应结束后,A中浊液经过滤、

(6)粗产品中NaC3N3O3Cl2含量测定。称取ag粗产品溶于无氧蒸馏水中配制成250mL溶液,取25.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min。用cmol/LNa2S2O3标准溶液进行滴定,加入淀粉指示剂,滴定至终点,平均消耗VmLNa2S2O3溶液。(假设杂质不与KI反应,过程中涉及的反应为:
 +3H++4I-=C3H3N3O3+2I2+2Cl-,I2+2
+3H++4I-=C3H3N3O3+2I2+2Cl-,I2+2 =2I-+
=2I-+ )。则NaC3N3O3Cl2的含量为
)。则NaC3N3O3Cl2的含量为
您最近一年使用:0次



