解题方法
1 . 将二氧化碳转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因此加氢制甲醇被广泛关注。在催化剂作用下主要发生以下反应。
Ⅰ.

Ⅱ.
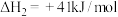
Ⅲ.

(1)反应Ⅲ自发进行的条件是______ 。
(2)恒温恒容条件下,原料气 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为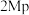 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
______ 。(对于气相反应,用组分B的平衡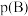 代替
代替 ,记作
,记作 。
。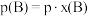 ,p为平衡压强,
,p为平衡压强,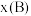 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。)
在 ,
,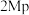 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
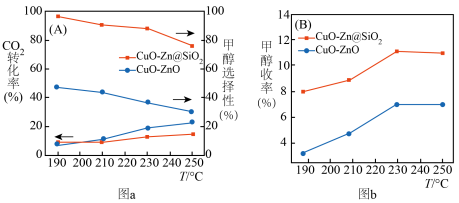
(3)分析在该压强下的最适合反应条件为______ 。
(4)推测在一定温度范围内,随着反应温度的升高, 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是______ 。
(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
(6)在 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线__________ 。
Ⅰ.


Ⅱ.

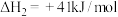
Ⅲ.


(1)反应Ⅲ自发进行的条件是
(2)恒温恒容条件下,原料气
 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为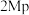 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
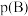 代替
代替 ,记作
,记作 。
。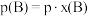 ,p为平衡压强,
,p为平衡压强,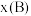 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。) 在
 ,
,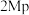 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
(3)分析在该压强下的最适合反应条件为
(4)推测在一定温度范围内,随着反应温度的升高,
 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
A. 催化剂中 催化剂中 抑制了 抑制了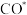 的解吸附,从而抑制 的解吸附,从而抑制 的生成。 的生成。 |
B. 催化剂上主要通过甲酸盐路径加氢生成甲醇。 催化剂上主要通过甲酸盐路径加氢生成甲醇。 |
| C.增大流速,原料气与催化剂碰撞机会多,甲醇产率一定增加。 |
D.随着温度升高,有利于 在催化剂表面反应,平衡转化率增大。 在催化剂表面反应,平衡转化率增大。 |
(6)在
 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
您最近一年使用:0次
名校
解题方法
2 . 请根据有关知识,填写下列空白:
(1)一种难溶的废弃矿渣杂卤石,其主要成分可表示为K2SO4·MgSO4·2CaSO4·2H2O,已知它在水溶液中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s) 2K+(aq)+4
2K+(aq)+4 (aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
(aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
用化学平衡移动原理解释Ca(OH)2溶液能溶解出杂卤石中K+的原因:_____ 。
(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L−1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.8×10−10,忽略溶液的体积变化,请计算:完全沉淀后,溶液中c(Ag+)=_____ mol·L−1.
(3)N2H4是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。
写出N2H4(g)完全燃烧生成氮气和气态水热化学方程式_____ 。
(4)硫酸亚铁溶液常压蒸干得到的固体物质是_____ ,原因是_____ 。
(5)NH4Cl溶液可作焊接时的除锈剂,原因是_____ 。
(1)一种难溶的废弃矿渣杂卤石,其主要成分可表示为K2SO4·MgSO4·2CaSO4·2H2O,已知它在水溶液中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s)
 2K+(aq)+4
2K+(aq)+4 (aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。
(aq)+Mg2+(aq)+2Ca2+(aq)+2H2O(l)。用化学平衡移动原理解释Ca(OH)2溶液能溶解出杂卤石中K+的原因:
(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L−1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.8×10−10,忽略溶液的体积变化,请计算:完全沉淀后,溶液中c(Ag+)=
(3)N2H4是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。
写出N2H4(g)完全燃烧生成氮气和气态水热化学方程式
(4)硫酸亚铁溶液常压蒸干得到的固体物质是
(5)NH4Cl溶液可作焊接时的除锈剂,原因是
您最近一年使用:0次
3 . 某化学工作者研究在不同 时,
时, 溶液对
溶液对 分解的催化作用。
分解的催化作用。
已知:a. 为红色固体,难溶于水,溶于硫酸生成
为红色固体,难溶于水,溶于硫酸生成 和
和 。
。
b.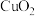 为棕褐色固体,难溶于水,溶于硫酸生成
为棕褐色固体,难溶于水,溶于硫酸生成 和
和 。
。
c. 为弱酸性。
为弱酸性。
请回答下列有关问题:
(1)写出 的电离方程式
的电离方程式___________ ;___________
(2)写出 的电子式
的电子式___________ ; 中
中 原子的杂化类型是
原子的杂化类型是___________ 。经检验生成的气体均为 ,Ⅰ中
,Ⅰ中 催化分解
催化分解 的化学方程式是
的化学方程式是___________ 。
(3)要检验某铜粉是否含 ,写出具体操作、现象及结论
,写出具体操作、现象及结论___________ 。
(4)结合离子方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因:___________ 。
 时,
时, 溶液对
溶液对 分解的催化作用。
分解的催化作用。| 编号 | 实验 | 现象 |
| Ⅰ | 向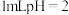 的 的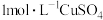 溶液中加入 溶液中加入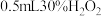 溶液 溶液 | 出现少量气泡 |
| Ⅱ | 向 的 的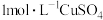 溶液中加入 溶液中加入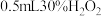 溶液 溶液 | 立即产生少量棕褐色沉淀,出现较明显气泡 |
| Ⅲ | 向 的 的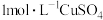 溶液中加入 溶液中加入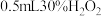 溶液 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
 为红色固体,难溶于水,溶于硫酸生成
为红色固体,难溶于水,溶于硫酸生成 和
和 。
。b.
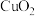 为棕褐色固体,难溶于水,溶于硫酸生成
为棕褐色固体,难溶于水,溶于硫酸生成 和
和 。
。c.
 为弱酸性。
为弱酸性。请回答下列有关问题:
(1)写出
 的电离方程式
的电离方程式(2)写出
 的电子式
的电子式 中
中 原子的杂化类型是
原子的杂化类型是 ,Ⅰ中
,Ⅰ中 催化分解
催化分解 的化学方程式是
的化学方程式是(3)要检验某铜粉是否含
 ,写出具体操作、现象及结论
,写出具体操作、现象及结论(4)结合离子方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因:
您最近一年使用:0次
名校
4 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
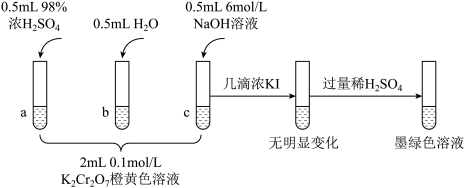
已知:
资料1: (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+ △H=+13.8 kJ/mol;
(黄色)+2H+ △H=+13.8 kJ/mol;
资料2:+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是___________ 。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?___________ (填“是”或“否”),理由是___________ 。
(3)对比试管a、b、c的实验现象,可知c(H+)增加时,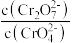
___________ (填“增大”,“减小”,“不变”)。
(4)试管c继续滴加KI溶液、过量稀H2SO4,写出此过程中氧化还原反应的离子方程式___________ 。

已知:
资料1:
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+ △H=+13.8 kJ/mol;
(黄色)+2H+ △H=+13.8 kJ/mol;资料2:+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?
(3)对比试管a、b、c的实验现象,可知c(H+)增加时,
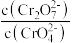
(4)试管c继续滴加KI溶液、过量稀H2SO4,写出此过程中氧化还原反应的离子方程式
您最近一年使用:0次
名校
解题方法
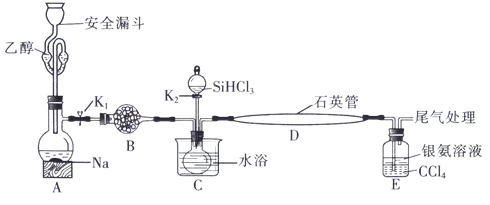
5 . 高纯硅被誉为“信息革命的催化剂”。某小组模拟工业上用 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:① 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为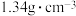 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
② ;
;
③银氨溶液中存在: 。
。
回答下列问题:
(1)装置B中试剂宜选择___________ (填字母,单选)。
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加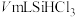 ;
;
④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为___________ (填序号)。
(3)E中CCl4的作用是防倒吸和___________ 。“防倒吸”原理是___________ 。用化学平衡原理解释银氨溶液中有白色沉淀生成:___________ 。
(4)石英管中发生反应的化学方程式为___________ 。
(5)本实验制得高纯硅ag,则SiHCl3的利用率为___________ (只列计算式)。实验结束后,有同学认为根据高纯硅与消耗钠或乙醇的量也可以计算SiHCl3的利用率,这种观点___________ (填“是”或“否”)正确。
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为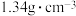 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
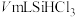 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
您最近一年使用:0次
2021-07-04更新
|
522次组卷
|
2卷引用:吉林省长春外国语学校2022届高三上学期期初考试化学试题
名校
解题方法
6 . SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
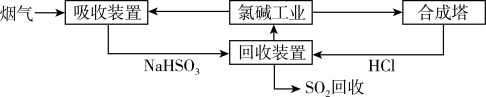
①“吸收装置”中发生反应的离子方程式是___________ 。
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是___________ 。
③上述流程中循环利用的物质是___________ 。
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是___________ (反应a)。为验证该反应,同学们将SO2通入0.05 mol·L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。
关于红褐色液体,以下是同学们的分析推测与实验。
②利用胶体的___________ (填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体。
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是___________ (用离子方程式及必要的文字说明)。
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用___________ (填“酸式”或“碱式”)滴定管量取试样20.00 mL,用0.10 mol·L-1 NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为___________ mol·L-1。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:

①“吸收装置”中发生反应的离子方程式是
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是
③上述流程中循环利用的物质是
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是
关于红褐色液体,以下是同学们的分析推测与实验。
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2  Fe(SO2) Fe(SO2)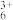 (反应b) (反应b) | ⅰ。制备Fe(OH)3胶体并检验 ⅱ。分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用
您最近一年使用:0次



