名校
解题方法
1 . Ⅰ.分别取40mL0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:
(1)本实验除烧杯、量筒外还缺少的玻璃仪器名称为___________ 。
(2)若某同学通过该实验测定出中和热 偏大,请分析可能的原因是
偏大,请分析可能的原因是___________ (填序号)。
A.用量筒量取盐酸时仰视读数
B.分多次将NaOH溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.为探究化学反应速率的影响因素,设计的实验方案如下表:(已知KI溶液、 溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
(3)写出混合溶液中滴入H2O2溶液反应的离子方程式为___________ 。
(4)表中的V=___________ mL,t1、t2、t3由小到大的顺序为___________ 。
(5)某同学研究浓度对化学平衡的影响。他向5mL 0.1mol/L K2Cr2O7溶液中加入几滴5mol/L NaOH溶液溶液颜色变化为___________ 。
 。请回答下列问题:
。请回答下列问题:(1)本实验除烧杯、量筒外还缺少的玻璃仪器名称为
(2)若某同学通过该实验测定出中和热
 偏大,请分析可能的原因是
偏大,请分析可能的原因是A.用量筒量取盐酸时仰视读数
B.分多次将NaOH溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.为探究化学反应速率的影响因素,设计的实验方案如下表:(已知KI溶液、
 溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)| 向烧杯中加入的试剂及用量/mL | |||||||
| 0.1mol/L KI溶液 | 0.1mol/L H2O2溶液 | 0.1mol/L H2SO4溶液 | 淀粉溶液 | H2O | 时间/s | ||
| ① | 25℃ | 20.0 | 10.0 | 5.0 | 1.0 | 0.0 | t1 |
| ② | 40℃ | 20.0 | 10.0 | 5.0 | 1.0 | 0.0 | t2 |
| ③ | 25℃ | 20.0 | 5.0 | 5.0 | 1.0 | V | t3 |
(4)表中的V=
(5)某同学研究浓度对化学平衡的影响。他向5mL 0.1mol/L K2Cr2O7溶液中加入几滴5mol/L NaOH溶液溶液颜色变化为
您最近一年使用:0次
2023-10-10更新
|
120次组卷
|
2卷引用:四川省宜宾市第四中学校2023-2024学年高二上学期12月月考化学试题
解题方法
2 . 一定温度下,在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____ 。
(2)该反应为_____ 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将_____ (填“增大”、“减小”或“不变”,下同),CO2的转化率将____ 。
(3)若600℃时,向容器中充入1molCO、1molH2O,10min后反应达到平衡,从开始到达到平衡时H2的化学反应速率为____ ,CO的转化率是_____ 。
(4)在830℃时,容器中发生此反应,某时刻测得n(CO2)=3mol、n(H2)=2mol、n(CO)=4mol、n(H2O)=4mol,则此时v正____ v逆(填“大于”、“小于”或“等于”)。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t℃ | 600 | 800 | 830 | 1000 | 1200 |
| K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)若600℃时,向容器中充入1molCO、1molH2O,10min后反应达到平衡,从开始到达到平衡时H2的化学反应速率为
(4)在830℃时,容器中发生此反应,某时刻测得n(CO2)=3mol、n(H2)=2mol、n(CO)=4mol、n(H2O)=4mol,则此时v正
您最近一年使用:0次
名校
3 . 二甲醚简称DME,是一种基础化工原料,可用于燃料电池及制取低碳烯烃等,Kagan提出的一步法制取二甲醚的反应为: ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:

(1)ΔH_______ 0(填“>”或“<”)。进料浓度比c(H2)∶c(CO2)=5的曲线为_______ 点所在曲线(填“A”或“B”),B、C两点用CH3OCH3表示的平均反应速率 (B)
(B)_______  (C)(填“>”、“<”或“=”)。
(C)(填“>”、“<”或“=”)。
(2)在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应: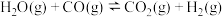 将导致CH3OCH3的产率增大,原因是
将导致CH3OCH3的产率增大,原因是_______ 。
(3)在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是_______ 、_______ 。
(4)当进料浓度比c(H2)∶c(CO2)=3、温度为443K时,测得刚性容器中起始总压为4MPa.计算443K时该反应的平衡常数Kp=_______ (列出计算式,用物质的平衡分压代替其物质的量浓度,气体分压=气体总压×物质的量分数)。
 ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
(1)ΔH
 (B)
(B) (C)(填“>”、“<”或“=”)。
(C)(填“>”、“<”或“=”)。(2)在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应:
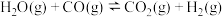 将导致CH3OCH3的产率增大,原因是
将导致CH3OCH3的产率增大,原因是(3)在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是
(4)当进料浓度比c(H2)∶c(CO2)=3、温度为443K时,测得刚性容器中起始总压为4MPa.计算443K时该反应的平衡常数Kp=
您最近一年使用:0次
2021-07-15更新
|
363次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2022届高考三诊模拟考试理科综合化学试题
真题
名校
4 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。
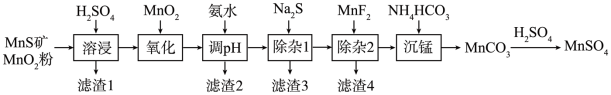
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19595次组卷
|
29卷引用:四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题
四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学
5 . 某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
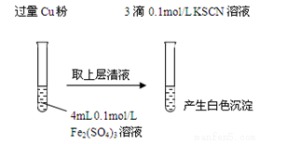
(1) Fe3+与Cu粉发生反应的离子方程式为:________________________________________ 。
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2+ + 4 I-= 2CuI↓+ I2
则Cu2+与SCN-反应的离子方程式为________________________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2+ + NO Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO 产生的原因_______________________________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
① 依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________ (填“快”或“慢”)。
② 乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______________________________ 。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________________________ 。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+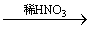 Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。
实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________
实验Ⅰ:将Fe3+转化为Fe2+

(1) Fe3+与Cu粉发生反应的离子方程式为:
(2)探究白色沉淀产生的原因,请填写实验方案:
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL | 产生白色沉淀 | CuSO4与KSCN 反应产生了白色沉淀 |
| 步骤2:取 | 无明显现象 |
则Cu2+与SCN-反应的离子方程式为
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2+ + NO
 Fe(NO)2+(棕色)
Fe(NO)2+(棕色)(3)用离子方程式解释NO 产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
① 依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ
② 乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+
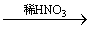 Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

您最近一年使用:0次
2018-10-30更新
|
308次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2019-2020学年高二下学期第一次在线月考化学试题



