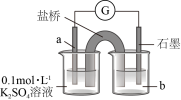
1 . 无水氯化亚铁为白色吸湿性粉末,在空气中易被氧化,易溶于水,不溶于氯仿等有机溶剂。实验室常用无水氯化铁和氯苯反应制备无水氯化亚铁,反应原理为:2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl。实验装置如图所示:

回答下列问题:
(1)装置a的名称是___________ ;连接好装置开始实验前必须进行的操作是___________ 。
(2)搅拌器的作用是___________ 。
(3)从化学平衡的角度解释需要不断蒸出氯化氢的原因是___________ 。
(4)反应结束后,将三颈烧瓶中的固体过滤___________ 、真空干燥后得到纯净的产品,并隔绝空气保存。
(5)氯化亚铁溶液容易被空气中的氧气氧化,反应的离子反应方程式为___________ 。
(6)本次实验共消耗165 g无水氯化铁和225 g氯苯。为测定该反应的转化率,小华同学用2 mol/L的NaOH溶液滴定溶于水的氯化氢,并以甲基橙做指示剂,达到滴定终点时的现象为___________ 。滴定消耗氢氧化钠共250 mL,则氯化铁的转化率为___________ (结果保留三位有效数字)。

回答下列问题:
(1)装置a的名称是
(2)搅拌器的作用是
(3)从化学平衡的角度解释需要不断蒸出氯化氢的原因是
(4)反应结束后,将三颈烧瓶中的固体过滤
(5)氯化亚铁溶液容易被空气中的氧气氧化,反应的离子反应方程式为
(6)本次实验共消耗165 g无水氯化铁和225 g氯苯。为测定该反应的转化率,小华同学用2 mol/L的NaOH溶液滴定溶于水的氯化氢,并以甲基橙做指示剂,达到滴定终点时的现象为
您最近一年使用:0次
名校
解题方法
2 . 根据下列实验设计,回答问题:

(1)利用实验(I)探究锌与 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___________ 。
(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在: (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
①依据题意写出其中的离子方程式___________ ,
②用平衡移动原理解释D颜色变浅的原因:___________ ;
③加水稀释,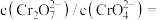
___________ (答“变大”、“变小”或“不变”)
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应: 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:
①由实验i、实验ii可得出的结论是___________ 。
②关于实验i中 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂: 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入 酸性
酸性 溶液,
溶液,___________ ,最后加入 草酸溶液。
草酸溶液。
③基于以上实验与分析,推测实验(III)设计___________ (填“能”或“不能”)达到实验目的。

(1)利用实验(I)探究锌与
 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在:
 (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,①依据题意写出其中的离子方程式
②用平衡移动原理解释D颜色变浅的原因:
③加水稀释,
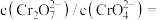
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应:
 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入 酸性 酸性 溶液,再加入1滴 溶液,再加入1滴 硫酸和9滴蒸馏水、最后加入 硫酸和9滴蒸馏水、最后加入 草酸溶液 草酸溶液 | 前 内溶液紫色无明显变化,后颜色逐渐变浅, 内溶液紫色无明显变化,后颜色逐渐变浅, 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入 酸性 酸性 溶液,再加入10滴 溶液,再加入10滴 硫酸,最后加入 硫酸,最后加入 草酸溶液 草酸溶液 |  内溶液紫色无明显变化,后颜色迅速变浅,约 内溶液紫色无明显变化,后颜色迅速变浅,约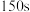 后几乎变为无色 后几乎变为无色 |
②关于实验i中
 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。提供的试剂:
 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。补全实验ⅲ的操作:向试管中先加入
 酸性
酸性 溶液,
溶液, 草酸溶液。
草酸溶液。③基于以上实验与分析,推测实验(III)设计
您最近一年使用:0次
3 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
将等体积的 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。
实验记录如下:
(1)基态 的电子排布式
的电子排布式___________ 。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或
(蓝色)或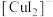 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去 的原理是
的原理是___________ 。
ii.查阅资料, (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:___________ ,___________ 。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,___________ (填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________ 。
(4)上述实验结果, 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为___________ ,b试剂为___________ 。
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。将等体积的
 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。实验记录如下:
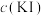 | 实验现象 | |
| 实验Ⅰ | 0.01 | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1 | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4 |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 的电子排布式
的电子排布式(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
 (蓝色)或
(蓝色)或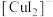 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去
 的原理是
的原理是ii.查阅资料,
 (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为
您最近一年使用:0次
2023-11-03更新
|
274次组卷
|
2卷引用:山东省青岛市第十九中学2023-2024学年高二上学期化学期末试卷
名校
4 . 某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含Cr元素的常见粒子: (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、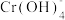 (亮绿色)。
(亮绿色)。
ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
(1)已知 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是_____ 。
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______ 。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______ 色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
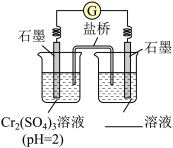
右侧烧杯的溶液中,氧化剂是_____ 。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____ 。
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_____ 。
(5)由上述实验, 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):
酸性条件下,
_____ H2O2;碱性条件下, 
_____ H2O2。
资料:
i.含Cr元素的常见粒子:
 (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、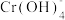 (亮绿色)。
(亮绿色)。ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
| 装置 | 步骤 | 操作 | 现象 |
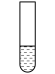 2mL0.0125mol•L-1K2Cr2O7溶液 | I | 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 | 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴2mol•L-1NaOH溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:(2)I中,溶液由橙色变为绿色的总反应的离子方程式是
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。

右侧烧杯的溶液中,氧化剂是
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为
(5)由上述实验,
 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):酸性条件下,


您最近一年使用:0次
2023-01-07更新
|
408次组卷
|
4卷引用:北京市西城区2022-2023学年高二上学期1月期末考试化学试题
5 . 甲基丙烯酸甲酯[ ]是有机玻璃的单体,其一种实验室制备方法如下:
]是有机玻璃的单体,其一种实验室制备方法如下:
Ⅰ.向 烧瓶中依次加入:
烧瓶中依次加入: 甲基丙烯酸、
甲基丙烯酸、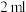 浓硫酸,冷却至室温,再加入
浓硫酸,冷却至室温,再加入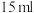 甲醇和几粒碎瓷片;
甲醇和几粒碎瓷片;
Ⅱ.按图示连接装置加热烧瓶中混合液,通过分水器分离出水,当分水器中水位不再增加时停止加热;冷却。
Ⅲ.纯化产品
粗产品依次用水洗、试剂Y溶液洗、水洗,在油层中加入无水硫酸镁,再经蒸馏得到较纯净的甲基丙烯酸甲酯17.6 g。
已知:
回答下列问题:
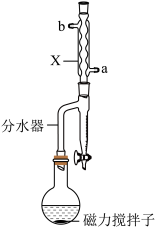
(1)图中仪器X的名称为___________ 。
(2)制备甲基丙烯酸甲酯的化学方程式为___________ 。
(3)每隔一段时间,打开油水分离器,将下层水放出来。从分水器中及时分离出水的目的是___________ 。
(4)纯化过程中,试剂Y是___________ ,其作用有___________ 。
(5)蒸馏提纯产品时温度应控制在___________ ℃。
(6)本实验中甲基丙烯酸甲酯的产率为___________ (保留三位有效数字)。
 ]是有机玻璃的单体,其一种实验室制备方法如下:
]是有机玻璃的单体,其一种实验室制备方法如下:Ⅰ.向
 烧瓶中依次加入:
烧瓶中依次加入: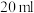 甲基丙烯酸、
甲基丙烯酸、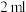 浓硫酸,冷却至室温,再加入
浓硫酸,冷却至室温,再加入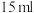 甲醇和几粒碎瓷片;
甲醇和几粒碎瓷片;Ⅱ.按图示连接装置加热烧瓶中混合液,通过分水器分离出水,当分水器中水位不再增加时停止加热;冷却。
Ⅲ.纯化产品
粗产品依次用水洗、试剂Y溶液洗、水洗,在油层中加入无水硫酸镁,再经蒸馏得到较纯净的甲基丙烯酸甲酯17.6 g。
已知:
| 药品 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度( ) ) | 相对分子质量 |
| 甲醇 | -98 | 64.5 | 与水混溶,易溶于有机溶剂 | 0.79 | 32 |
| 甲基丙烯酸 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 | 86 |
| 甲基丙烯酸甲酯 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 | 100 |

(1)图中仪器X的名称为
(2)制备甲基丙烯酸甲酯的化学方程式为
(3)每隔一段时间,打开油水分离器,将下层水放出来。从分水器中及时分离出水的目的是
(4)纯化过程中,试剂Y是
(5)蒸馏提纯产品时温度应控制在
(6)本实验中甲基丙烯酸甲酯的产率为
您最近一年使用:0次
6 . 我国向世界郑重承诺力争在2030年前实现碳达峰,在2060年前实现碳中和。在实现碳达峰和碳中和的过程中化学发挥着重要的作用。
Ⅰ.以 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应:
的反应: 为温室气体减排提供了一个新途径,该反应转化过程及各分子化学键完全断裂时的能量变化如图所示:
为温室气体减排提供了一个新途径,该反应转化过程及各分子化学键完全断裂时的能量变化如图所示:

(1)根据数据计算, ,
,
_______ kJ/mol
(2)将一氧化碳与氧气的反应设计成燃料电池,工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中 可以在固体介质NASICON中自由移动。
可以在固体介质NASICON中自由移动。

工作时,负极电极反应式_______ 。
Ⅱ.科学家开发高效多功能催化剂,高选择性利用 和
和 制备
制备 ,实现废旧物资循环利用。反应原理是
,实现废旧物资循环利用。反应原理是 。
。
(3)在恒温恒容条件下充入 和
和 发生上述反应。
发生上述反应。
①下列情况表明该反应已达到平衡状态的是_______ (填标号)。
A.混合气体的密度不随时间变化 B.混合气体的总压强不随时间变化
C.混合气体的平均摩尔质量不随时间变化 D. 和
和 的浓度之比不随时间变化
的浓度之比不随时间变化
②其他条件相同,只改变下列一个条件,能提高 生成速率的是
生成速率的是_______ (填标号)。
A.降低温度 B.再充入 C.充入
C.充入 D.及时移走部分
D.及时移走部分
(4)在恒容密闭容器中充入一定量 和
和 发生上述反应,测得一定时间内
发生上述反应,测得一定时间内 的转化率与催化剂Cat1、Cat2以及温度的关系如图,催化效率较高的是
的转化率与催化剂Cat1、Cat2以及温度的关系如图,催化效率较高的是_______ (填“Cat1”或“Cat2”),理由是_______ 。

(5)在某温度下,向一容积为2L的恒容密闭容器中充入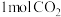 和
和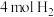 ,发生上述反应,测得气体总压强变化如图。
,发生上述反应,测得气体总压强变化如图。

0~10min内,
_______  ;0~5min内
;0~5min内
_______ (填“大于”“小于”或“等于”)5~10min内 。
。
Ⅰ.以
 为催化剂的光热化学循环分解
为催化剂的光热化学循环分解 的反应:
的反应: 为温室气体减排提供了一个新途径,该反应转化过程及各分子化学键完全断裂时的能量变化如图所示:
为温室气体减排提供了一个新途径,该反应转化过程及各分子化学键完全断裂时的能量变化如图所示:
(1)根据数据计算,
 ,
,
(2)将一氧化碳与氧气的反应设计成燃料电池,工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中
 可以在固体介质NASICON中自由移动。
可以在固体介质NASICON中自由移动。
工作时,负极电极反应式
Ⅱ.科学家开发高效多功能催化剂,高选择性利用
 和
和 制备
制备 ,实现废旧物资循环利用。反应原理是
,实现废旧物资循环利用。反应原理是 。
。(3)在恒温恒容条件下充入
 和
和 发生上述反应。
发生上述反应。①下列情况表明该反应已达到平衡状态的是
A.混合气体的密度不随时间变化 B.混合气体的总压强不随时间变化
C.混合气体的平均摩尔质量不随时间变化 D.
 和
和 的浓度之比不随时间变化
的浓度之比不随时间变化②其他条件相同,只改变下列一个条件,能提高
 生成速率的是
生成速率的是A.降低温度 B.再充入
 C.充入
C.充入 D.及时移走部分
D.及时移走部分
(4)在恒容密闭容器中充入一定量
 和
和 发生上述反应,测得一定时间内
发生上述反应,测得一定时间内 的转化率与催化剂Cat1、Cat2以及温度的关系如图,催化效率较高的是
的转化率与催化剂Cat1、Cat2以及温度的关系如图,催化效率较高的是
(5)在某温度下,向一容积为2L的恒容密闭容器中充入
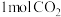 和
和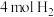 ,发生上述反应,测得气体总压强变化如图。
,发生上述反应,测得气体总压强变化如图。
0~10min内,

 ;0~5min内
;0~5min内
 。
。
您最近一年使用:0次
7 . ClO2为疫情防控的消杀提供了强有力的支撑,是国际公认的最新一代广谱、高效、安全、环保的杀菌剂,具有杀菌效果好,见效快,残留少,不产生抗药性等优点。如图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。

已知:①ClO2是一种易溶于水的气体,难溶于有机溶剂。
②实验室制备ClO2的原理是2NaClO2+Cl2=2ClO2+2NaCl。
(1)A为氯气的制备装置,其中a管的作用是_____ ,装置G的作用是_____ 。
(2)若圆底烧瓶中盛有高锰酸钾,分液漏斗中盛有浓盐酸,写出生成氯气的离子方程式:______ 。氯气的电子式为______ 。
(3)B装置中所盛试剂是饱和食盐水,抑制了Cl2与H2O的反应,B装置中也可以用水替代饱和食盐水,实验室常采用饱和食盐水而不采用水除去氯气中氯化氢,试用平衡移动原理解释原因:______ 。(用离子方程式结合文字表述)
(4)装置D中盛放NaClO2的仪器名称为_____ 。当有18.1gNaClO2与Cl2完全反应时,电子转移数目为_____ 。
(5)E中盛放的试剂用于除去ClO2中未反应的Cl2,可选用的试剂是______ (填标号)。
a.饱和食盐水 b.CCl4液体 c.水 d.浓硫酸

已知:①ClO2是一种易溶于水的气体,难溶于有机溶剂。
②实验室制备ClO2的原理是2NaClO2+Cl2=2ClO2+2NaCl。
(1)A为氯气的制备装置,其中a管的作用是
(2)若圆底烧瓶中盛有高锰酸钾,分液漏斗中盛有浓盐酸,写出生成氯气的离子方程式:
(3)B装置中所盛试剂是饱和食盐水,抑制了Cl2与H2O的反应,B装置中也可以用水替代饱和食盐水,实验室常采用饱和食盐水而不采用水除去氯气中氯化氢,试用平衡移动原理解释原因:
(4)装置D中盛放NaClO2的仪器名称为
(5)E中盛放的试剂用于除去ClO2中未反应的Cl2,可选用的试剂是
a.饱和食盐水 b.CCl4液体 c.水 d.浓硫酸
您最近一年使用:0次
名校
解题方法
8 . 高纯硅被誉为“信息革命的催化剂”。某小组模拟工业上用 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
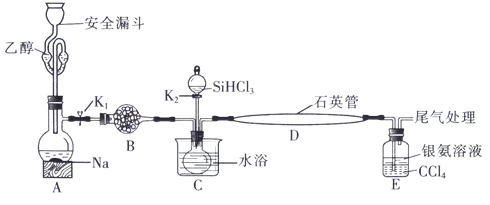
已知:① 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为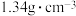 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
② ;
;
③银氨溶液中存在: 。
。
回答下列问题:
(1)装置B中试剂宜选择___________ (填字母,单选)。
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加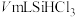 ;
;
④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为___________ (填序号)。
(3)E中CCl4的作用是防倒吸和___________ 。“防倒吸”原理是___________ 。用化学平衡原理解释银氨溶液中有白色沉淀生成:___________ 。
(4)石英管中发生反应的化学方程式为___________ 。
(5)本实验制得高纯硅ag,则SiHCl3的利用率为___________ (只列计算式)。实验结束后,有同学认为根据高纯硅与消耗钠或乙醇的量也可以计算SiHCl3的利用率,这种观点___________ (填“是”或“否”)正确。
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为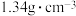 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
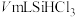 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
您最近一年使用:0次
2021-07-04更新
|
523次组卷
|
2卷引用:湖北省2020-2021学年高二下学期7月统一调研测试化学试题
名校
9 . 某硫酸厂产生的烧渣(主要含 、
、 及少量
及少量 )可用于制备
)可用于制备 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:
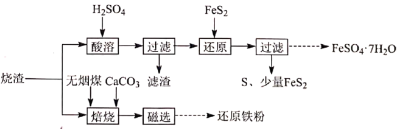
(1)“酸溶”前需粉碎烧渣,其目的是_________ 、________ 。
(2)“滤渣”的主要成分是_________ (填化学式)。
(3)“还原”时, 被氧化为
被氧化为 的离子方程式是
的离子方程式是_________ 。
(4)“焙烧”时,烧渣、无烟煤、 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
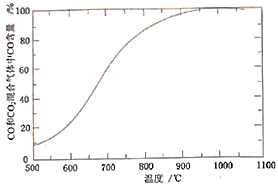
添加 的目的是:①脱除
的目的是:①脱除 等;②
等;②_________ 。
(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是_______ 。

 、
、 及少量
及少量 )可用于制备
)可用于制备 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:
(1)“酸溶”前需粉碎烧渣,其目的是
(2)“滤渣”的主要成分是
(3)“还原”时,
 被氧化为
被氧化为 的离子方程式是
的离子方程式是(4)“焙烧”时,烧渣、无烟煤、
 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
添加
 的目的是:①脱除
的目的是:①脱除 等;②
等;②(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是

您最近一年使用:0次
2020-03-14更新
|
269次组卷
|
2卷引用:江苏省扬州市2020届高三上学期期末检测化学试题
名校
解题方法
10 . SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
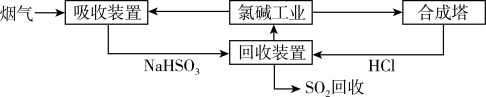
①“吸收装置”中发生反应的离子方程式是___________ 。
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是___________ 。
③上述流程中循环利用的物质是___________ 。
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是___________ (反应a)。为验证该反应,同学们将SO2通入0.05 mol·L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。
关于红褐色液体,以下是同学们的分析推测与实验。
②利用胶体的___________ (填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体。
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是___________ (用离子方程式及必要的文字说明)。
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用___________ (填“酸式”或“碱式”)滴定管量取试样20.00 mL,用0.10 mol·L-1 NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为___________ mol·L-1。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:

①“吸收装置”中发生反应的离子方程式是
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是
③上述流程中循环利用的物质是
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是
关于红褐色液体,以下是同学们的分析推测与实验。
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2  Fe(SO2) Fe(SO2)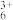 (反应b) (反应b) | ⅰ。制备Fe(OH)3胶体并检验 ⅱ。分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用
您最近一年使用:0次



