1 . 在一小烧杯里混合10ml 0.01mol/L FeC13溶液和10ml 0.01mol/L KSCN溶液,溶液立即变为红色。
(1)写出反应的化学方程式:____________ 。
(2)再向溶液中滴入1mol/LFeC13溶液,现象_______________ ,平衡向_______ 反应方向移动,KSCN浓度会________________ 。
(3)在烧杯中加入KC1固体,颜色___________________ ,平衡_______ 移动。
(1)写出反应的化学方程式:
(2)再向溶液中滴入1mol/LFeC13溶液,现象
(3)在烧杯中加入KC1固体,颜色
您最近一年使用:0次
2 . 水煤气变换 。721 ℃时,在 1 L刚性容器中将
。721 ℃时,在 1 L刚性容器中将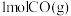 和
和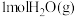 混合,采用适当催化剂进行反应,测得
混合,采用适当催化剂进行反应,测得 随时间变化的曲线如a所示。下列叙述错误的是
随时间变化的曲线如a所示。下列叙述错误的是

 。721 ℃时,在 1 L刚性容器中将
。721 ℃时,在 1 L刚性容器中将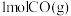 和
和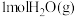 混合,采用适当催化剂进行反应,测得
混合,采用适当催化剂进行反应,测得 随时间变化的曲线如a所示。下列叙述错误的是
随时间变化的曲线如a所示。下列叙述错误的是 
A.曲线a也可代表 的变化 的变化 |
B.平衡后再充入一定量 ,平衡右移且 ,平衡右移且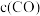 比原平衡大 比原平衡大 |
C. 内,用 内,用 来表示的反应速率 来表示的反应速率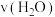 为 为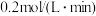 |
D.721℃时,该反应的平衡常数为 |
您最近一年使用:0次
3 . 血红蛋白(Hb)与肌红蛋白(Mb)是由肽链和血红素辅基组成的可结合氧的蛋白,广泛存在于人体组织中。回答下列问题:
(1)血红蛋白能结合O2形成动脉血,存在如下反应:
①Hb(aq)+H+(aq) HbH+(aq) ΔH1
HbH+(aq) ΔH1
②HbH+(aq)+O2(g) HbO2(aq)+H+(aq) ΔH2
HbO2(aq)+H+(aq) ΔH2
③Hb(aq)+O2(g) HbO2(aq) ΔH3
HbO2(aq) ΔH3
ΔH3=___ (用ΔH1、ΔH2表示),反应②可自发进行,则其△H___ 0(填“>”或“<”)。
血液中还同时存在反应:④CO2+H2O H++HCO
H++HCO ,旅客常因为青藏高原的氧分压较低,体内CO2不能及时排出体外而产生高原反应,从化学平衡角度解释产生高原反应的原因
,旅客常因为青藏高原的氧分压较低,体内CO2不能及时排出体外而产生高原反应,从化学平衡角度解释产生高原反应的原因___ 。
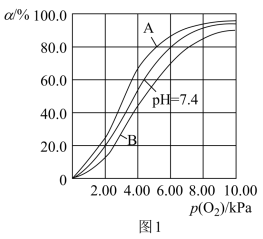
科研人员仅对于反应②进行模拟研究发现,37℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时HbH+与氧气的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为___ (填“A”或“B”)。
(2)肌肉中肌红蛋白Mb也可结合O2形成MbO2的反应为Mb(aq)+O2(g) MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=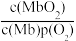 ,正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)。其它条件不变,随着氧分压p(O2)增大,
,正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)。其它条件不变,随着氧分压p(O2)增大, 的值
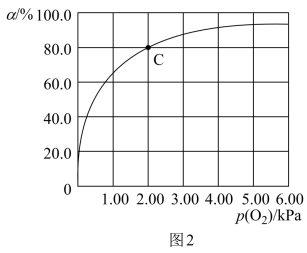
的值___ (填“增大”、“减小”或“不变”);在氧分压p(O2)=2.00 kPa的平衡体系中,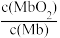 =4.0。若吸入的空气中p(O2)=21 kPa,计算此时Mb与氧气的最大结合度α(转化率)约为
=4.0。若吸入的空气中p(O2)=21 kPa,计算此时Mb与氧气的最大结合度α(转化率)约为___ (保留两位有效数字);图2中C点时, =
=___ 。
(1)血红蛋白能结合O2形成动脉血,存在如下反应:
①Hb(aq)+H+(aq)
 HbH+(aq) ΔH1
HbH+(aq) ΔH1②HbH+(aq)+O2(g)
 HbO2(aq)+H+(aq) ΔH2
HbO2(aq)+H+(aq) ΔH2③Hb(aq)+O2(g)
 HbO2(aq) ΔH3
HbO2(aq) ΔH3ΔH3=
血液中还同时存在反应:④CO2+H2O
 H++HCO
H++HCO ,旅客常因为青藏高原的氧分压较低,体内CO2不能及时排出体外而产生高原反应,从化学平衡角度解释产生高原反应的原因
,旅客常因为青藏高原的氧分压较低,体内CO2不能及时排出体外而产生高原反应,从化学平衡角度解释产生高原反应的原因科研人员仅对于反应②进行模拟研究发现,37℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时HbH+与氧气的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为

(2)肌肉中肌红蛋白Mb也可结合O2形成MbO2的反应为Mb(aq)+O2(g)
 MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=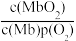 ,正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)。其它条件不变,随着氧分压p(O2)增大,
,正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)。其它条件不变,随着氧分压p(O2)增大, 的值
的值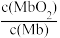 =4.0。若吸入的空气中p(O2)=21 kPa,计算此时Mb与氧气的最大结合度α(转化率)约为
=4.0。若吸入的空气中p(O2)=21 kPa,计算此时Mb与氧气的最大结合度α(转化率)约为 =
=
您最近一年使用:0次
名校
4 . 用如图所示的装置提纯难挥发的TaS2晶体,发生的反应为TaS2(s)+2I2(g)⇌TaI4(g)+S2(g) ΔH>0,将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中,下列说法不正确 的是


| A.温度:T1<T2 |
| B.在温度T1端得到纯净TaS2晶体 |
| C.提纯过程中I2的量在不断减少 |
| D.该反应的平衡常数与TaI4和S2的浓度乘积成反比 |
您最近一年使用:0次
2021-01-20更新
|
414次组卷
|
3卷引用:广东省“百越名校联盟”2021届高三12月普通高中学业质量检测化学试题
名校
5 . 利用太阳能光解水,制备的H2用于还原CO2可以在一定条件下合成CH3OH(不考虑副反应),CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0,可实现资源的再利用。回答下列问题:
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3 a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为_______ 。
(2)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
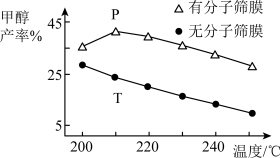
①甲醇平衡产率随温度升高而降低的原因为_______ 。
②P点甲醇产率高于T点的原因为_______ 。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为_______ °C。
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3 a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
(2)恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。

①甲醇平衡产率随温度升高而降低的原因为
②P点甲醇产率高于T点的原因为
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为
您最近一年使用:0次
2021-01-19更新
|
210次组卷
|
4卷引用:安徽省池州市第一中学2020-2021学年高二12月月考化学试题
安徽省池州市第一中学2020-2021学年高二12月月考化学试题选择性必修1 专题2 素养检测四川省大竹中学2021-2022学年高二上学期期中达标测化学试题(基础卷)(已下线)第七章 化学反应速率与化学平衡 第45讲 实际工业生产中图像问题分类突破
名校
解题方法
6 . 对于已达平衡的下列反应
2HI(g)⇌H2(g)+I2(g) ①
2NO2⇌N2O4 ②
2NH3(g)⇌N2(g)+3H2(g) ③
(1)保持容器容积不变,再通入一定量的反应物,反应①反应物的转化率_______ 反应②的转化率_______ (填增大、减小、不变,下同)。
(2)保持压强不变,通入一定量的N2O4,反应②生成物的百分含量_______
(3)保持容器容积不变,通入一定量氖气,则达到平衡时反应②NO2转化率_______
(4)保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时反应③NH3百分含量_____ 。
2HI(g)⇌H2(g)+I2(g) ①
2NO2⇌N2O4 ②
2NH3(g)⇌N2(g)+3H2(g) ③
(1)保持容器容积不变,再通入一定量的反应物,反应①反应物的转化率
(2)保持压强不变,通入一定量的N2O4,反应②生成物的百分含量
(3)保持容器容积不变,通入一定量氖气,则达到平衡时反应②NO2转化率
(4)保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时反应③NH3百分含量
您最近一年使用:0次
名校
解题方法
7 . 下列实验不能 达到预期实验目的是
| 实验内容 | 实验目的 | |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | 证明SO2具有氧化性 |
| B | 将氯化铁晶体溶解于少量浓盐酸中,再加水稀释 | 配制氯化铁溶液 |
| C | 向5mL0.1mol·L-1的K2Cr2O7溶液两支试管中分别滴加浓H2SO4和5mol·L-1的NaOH溶液,观察并记录两支试管溶液颜色的变化 | 探究浓度对化学平衡的影响 |
| D | 其他条件相同,测定等浓度的CH3COONa和NaClO溶液的pH | 比较Ka(CH3COOH)和Ka(HClO)的大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
20-21高二上·全国·假期作业
8 . (1)合成氨工艺的一个重要工序是铜洗,其目的是用铜液(醋酸二氨合铜,氨水)吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应的化学方程式如下:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac,如果要提高上述反应的反应速率,可以采取的措施是___________ (填字母)。
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-⇌O2NC6H4COO-+C2H5OH,两种反应物的初始浓度均为0.050mol·L-1,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
列式计算该反应在120~180s与180~240s区间的平均反应速率___________ 、___________ ;比较两者大小可得出的结论是___________ 。
(3)反应AX3(g)+X2(g)⇌AX5(g)在容积为10L的密闭容器中进行,起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
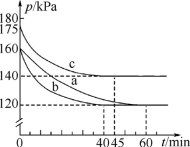
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=___________ 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b___________ ,c___________ 。
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-⇌O2NC6H4COO-+C2H5OH,两种反应物的初始浓度均为0.050mol·L-1,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
列式计算该反应在120~180s与180~240s区间的平均反应速率
(3)反应AX3(g)+X2(g)⇌AX5(g)在容积为10L的密闭容器中进行,起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为
您最近一年使用:0次
名校
解题方法
9 . (1)在密闭容器中,一定量混合气体发生下列反应:aM(g)+bN(g)⇌cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则N的转化率_______ (填变大,变小或不变)
(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是_______
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)向相同容积的甲、乙两容器中都分别充入1 mol SO2和0.5 mol O2,若甲容器保持温度、容积不变,乙容器保持温度、压强不变,分别达到平衡,下列说法正确的是_______
A.平衡时,容器内的压强:甲>乙
B.反应达到平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙
D.平衡时,容器内SO3的体积百分数:甲>乙
(4)下列说法正确的是_______
(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)向相同容积的甲、乙两容器中都分别充入1 mol SO2和0.5 mol O2,若甲容器保持温度、容积不变,乙容器保持温度、压强不变,分别达到平衡,下列说法正确的是
A.平衡时,容器内的压强:甲>乙
B.反应达到平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙
D.平衡时,容器内SO3的体积百分数:甲>乙
(4)下列说法正确的是
| A | B | C | D |
 |  |  |  |
| 绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)⇌2C(g),如图为其正反应速率随时间变化的示意图,则该反应为放热反应 | 催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。如图显示的是催化反应与无催化反应过程中的能量关系 | 将BaO2放入密闭真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图所示 | 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)⇌N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).则c点与a点相比,c(NO2)增大,c(N2O4)减小 |
您最近一年使用:0次
10 . 在水溶液中,CrO 呈黄色,Cr2O
呈黄色,Cr2O 呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O
呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+,下列说法正确的是( )
+2H+,下列说法正确的是( )
 呈黄色,Cr2O
呈黄色,Cr2O 呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O
呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O +H2O
+H2O 2CrO
2CrO +2H+,下列说法正确的是( )
+2H+,下列说法正确的是( )| A.向该溶液中滴加适量的NaHSO4固体,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大 |
| B.该反应是氧化还原反应 |
| C.向该溶液中加入过量浓NaOH溶液后,溶液呈橙色 |
| D.向体系中加入少量水,平衡逆向移动 |
您最近一年使用:0次
2021-01-06更新
|
426次组卷
|
5卷引用:安徽涡阳县育萃中学2020-2021学年高二上学期第三次月考化学试题
安徽涡阳县育萃中学2020-2021学年高二上学期第三次月考化学试题(已下线)2020年天津卷化学高考真题变式题1-12安徽省滁州市定远县育才学校2020-2021学年高二下学期开学考试化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)



