名校
解题方法
1 . 为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________ 。
(2)棉花中浸润的溶液为________________________ 。
(3)A中发生反应的化学方程式为_______________________________________ 。
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是_______________________________ 。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2 > Fe3+ >SO2的是____________________ (填“甲”“乙”“丙”)。
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。查阅资料:Fe2+(aq) +  (aq)
(aq) FeSO3(s)(墨绿色)。
FeSO3(s)(墨绿色)。
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:

①溶液E为__________________ 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因_____________

实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是
(2)棉花中浸润的溶液为
(3)A中发生反应的化学方程式为
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2 > Fe3+ >SO2的是
| 过程ⅣB溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有 |
| 乙 | 既有Fe3+又有Fe2+ | 有 |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
 (aq)
(aq) FeSO3(s)(墨绿色)。
FeSO3(s)(墨绿色)。提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:

①溶液E为
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因
您最近一年使用:0次
2020-12-02更新
|
280次组卷
|
3卷引用:甘肃省白银市会宁县第四中学2021届高三上学期第三次月考化学试题
2 . 铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理。
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3 + 6OH- - 6e- = N2 + 6H2O反应的电极为 (填“阴”、“阳”)极;
②-OH(自由羟基)电氧化
在电流作用下,利用产生的强氧化性中间产物OH脱氮,-OH中O元素的化合价 ;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化NH4+的离子方程式 。
(2)探究适宜的实验条件
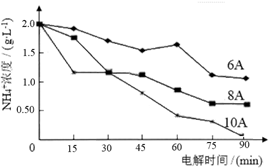
下图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择 A。
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有·OH;
假设二:只有HClO;
假设三: 。
(4)请你设计实验探究脱氮过程中是否有·OH产生,完成下表内容。
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因 。
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3 + 6OH- - 6e- = N2 + 6H2O反应的电极为 (填“阴”、“阳”)极;
②-OH(自由羟基)电氧化
在电流作用下,利用产生的强氧化性中间产物OH脱氮,-OH中O元素的化合价 ;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化NH4+的离子方程式 。
(2)探究适宜的实验条件
下图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择 A。

(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有·OH;
假设二:只有HClO;
假设三: 。
(4)请你设计实验探究脱氮过程中是否有·OH产生,完成下表内容。
| 实验方案 | 预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中·OH |
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因 。
您最近一年使用:0次
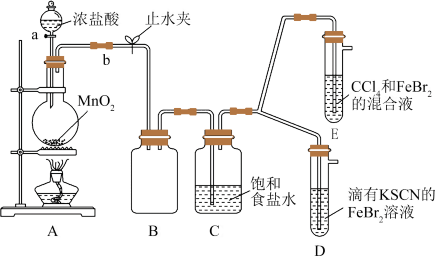
3 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,涉及如下实验:
完成下列填空:
(1)装置A中发生反应的化学方程式是___ ,整套实验装置存在的一处明显不足是___ 。
(2)用改进后的装置进行实验,观察到:D中溶液变红;E中水层溶液变黄,振荡后,CCl4层无明显变化。则Cl2、Br2、Fe3+的氧化性由强到弱的顺序为___ 。
因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D中:红色慢慢褪去,E中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下:(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
(3)用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因___ 。请设计简单实验证明上述解释:___ 。
(4)欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因___ 。
(5)将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为___ 。

完成下列填空:
(1)装置A中发生反应的化学方程式是
(2)用改进后的装置进行实验,观察到:D中溶液变红;E中水层溶液变黄,振荡后,CCl4层无明显变化。则Cl2、Br2、Fe3+的氧化性由强到弱的顺序为
因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D中:红色慢慢褪去,E中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下:(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
(3)用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因
(4)欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因
(5)将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为
您最近一年使用:0次
名校
4 . 对于一定条件下的氧化还原反应:2Fe3++2I- 2Fe2++I2,下列说法
2Fe2++I2,下列说法不正确 的是
 2Fe2++I2,下列说法
2Fe2++I2,下列说法| A.该反应达到平衡后,改变溶液的酸碱性不会影响平衡状态 |
| B.该反应达到平衡后,加入CCl4充分振荡可使平衡向右移动 |
| C.该反应达到平衡后,体系中Fe3+和I2的氧化性强弱相当 |
| D.将该反应设计成原电池,当电流计示数刚好变为“0”时,达到该反应进行的限度 |
您最近一年使用:0次
2020-09-09更新
|
183次组卷
|
5卷引用:北京市2021届高三上学期入学定位考试化学试题
北京市2021届高三上学期入学定位考试化学试题河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题北京市第四十三中学2021届高三上学期12月月考化学试题重庆南开中学2021-2022学年(2022届)高三上学期7月考试化学试题(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)
名校
解题方法
5 . Ⅰ.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为________ 。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:
_______CuSO4+_______PH3+_______H2O=_______Cu3P↓+_______H3PO4+_______H2SO4_______
(3)工业制备PH3的流程如图所示。

①白磷和烧碱溶液反应的化学方程式为:_________________ 。
②若起始时有1 mol P4参加反应,则整个工业流程中共生成________ mol PH3。
II.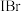 、
、 、
、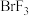 等称之为卤素互化物,
等称之为卤素互化物, 、
、 、
、 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(1)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是__________ 。
(2)溴化碘(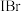 )具有强氧化性,能与
)具有强氧化性,能与 溶液发生反应,发生反应的离子方程式为
溶液发生反应,发生反应的离子方程式为_______ ;
(3)已知某些离子的还原性强弱顺序为 。现将几滴
。现将几滴 溶液滴入到含少量
溶液滴入到含少量 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_________ ;
(1)AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:
_______CuSO4+_______PH3+_______H2O=_______Cu3P↓+_______H3PO4+_______H2SO4
(3)工业制备PH3的流程如图所示。

①白磷和烧碱溶液反应的化学方程式为:
②若起始时有1 mol P4参加反应,则整个工业流程中共生成
II.
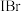 、
、 、
、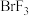 等称之为卤素互化物,
等称之为卤素互化物, 、
、 、
、 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。(1)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是
(2)溴化碘(
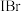 )具有强氧化性,能与
)具有强氧化性,能与 溶液发生反应,发生反应的离子方程式为
溶液发生反应,发生反应的离子方程式为(3)已知某些离子的还原性强弱顺序为
 。现将几滴
。现将几滴 溶液滴入到含少量
溶液滴入到含少量 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
您最近一年使用:0次
名校
6 . 相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:
资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3- Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21
(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为___________ ,B的作用为___________ 。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________ 。
(3)D中用NaOH溶液进行尾气处理,存在的问题是___________ 、___________ 。
(实验2)通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。
(4)取实验2中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是___________ 。
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是___________ 。
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:___________ [Fe(C2O4)3]3-
___________ FeC2O4↓+___________ ↑+___________
(实验3)又设计以下装置直接比较Fe2+和C2O 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
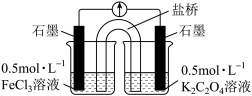
(7)描述达到预期目的可能产生的现象:___________ 。
 )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-
 Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是
(3)D中用NaOH溶液进行尾气处理,存在的问题是
(实验2)通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。操作 | 现象 |
| 在避光处,向10mL 0.5 mol·L-1FeCl3溶液中缓慢加入0.5 mol·L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到亮绿色溶液和亮绿色晶体 |
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:

(实验3)又设计以下装置直接比较Fe2+和C2O
 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
(7)描述达到预期目的可能产生的现象:
您最近一年使用:0次
2020-12-11更新
|
1229次组卷
|
4卷引用:黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题
黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题黑龙江省哈尔滨市第九中学2021届高三上学期第四次验收化学试卷(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题
解题方法
7 . 文献表明:相同条件下,草酸根(C2O42-)的还原性强于Fe2+。为检验这一结论, 完成如下实验。
资料:i.草酸(H2C2O4)为二元弱酸。
ii.三水三草酸合铁酸钾K3 Fe(C2O4)3·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:
[Fe(C2O4)3]3- Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21
iii. FeC2O4·2H2O为黄色固体,微溶于水,可溶于强酸。
[实验1]通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。
(l) C2O42-中碳元素的化合价是____ 。
(2)取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是____ 。
(3)经检验,翠绿色晶体为K3 Fe(C2O4)3·3H2O设计实验,确认实验1中没有发生氧化还原反应的操作和现象是____ 。实验l中未发生氧化还原反应的原因是____ 。
(4)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:
_____ [Fe(C2O4)3]3-+_____ H2O
____ FeC2O4·2H2O↓+_____ +________ 。
[实验2]通过比较H2O2与Fe2+、C2O42-反应的难易,判断二者还原性的强弱。
(5)证明Fe2+被氧化的实验现象是____ 。
(6)以上现象能否说明C2O42-没有被氧化。请判断并说明理由:________
(7)用FeC13溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2O42-的还原性强弱。画出装置图并描述预期现象:____ 。
资料:i.草酸(H2C2O4)为二元弱酸。
ii.三水三草酸合铁酸钾K3 Fe(C2O4)3·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:
[Fe(C2O4)3]3-
 Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21iii. FeC2O4·2H2O为黄色固体,微溶于水,可溶于强酸。
[实验1]通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。
| 操作 | 现象 |
| 在避光处,向10 mL 0.5 mol·L-1 FeCl3溶液中缓慢加入0.5 mol·L-1 K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到翠绿色溶液和翠绿色晶体 |
(2)取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是
(3)经检验,翠绿色晶体为K3 Fe(C2O4)3·3H2O设计实验,确认实验1中没有发生氧化还原反应的操作和现象是
(4)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:
[实验2]通过比较H2O2与Fe2+、C2O42-反应的难易,判断二者还原性的强弱。
| 步骤 | 操作 | 现象 |
| I | 向l mL 0.5 mol·L-1 FeSO4溶液中加入1 mL 0.5 mol·L-1 K2C2O4溶液,过滤 | 立即产生黄色沉淀 |
| II | 洗涤Ⅰ中的黄色沉淀,向其中加入过量的6%H2O2溶液,振荡,静置 | 剧烈放热,产生大量的红褐色沉淀和无色气体 |
| III | 待充分反应后,向其中加入稀硫酸,调节pH约为4 | 得到翠绿色溶液 |
(6)以上现象能否说明C2O42-没有被氧化。请判断并说明理由:
(7)用FeC13溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2O42-的还原性强弱。画出装置图并描述预期现象:
您最近一年使用:0次
名校
8 . 某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__ 。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
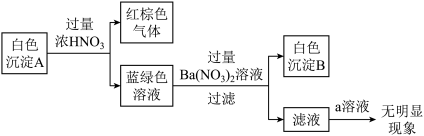
请回答:
①根据白色沉淀B是__ (填化学式),判断沉淀A中一定存在CuSCN。
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__ 。
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__ (填化学式)。
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_ Cu2++_ SCN-=_ CuSCN↓+_ (SCN)2
⑤结合上述过程以及Fe(SCN)3 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__ 。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__ 或__ 。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
①根据白色沉淀B是
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
⑤结合上述过程以及Fe(SCN)3
 Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是
您最近一年使用:0次
2020-04-27更新
|
321次组卷
|
5卷引用:2020届高三化学二轮冲刺新题专练——卤素互化物、拟卤素
名校
解题方法
9 . 某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
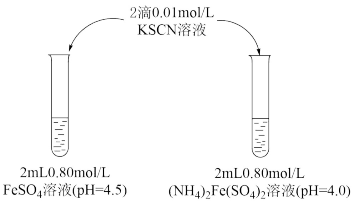
(1)溶液的稳定性:FeSO4_______ (NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________ 。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________ ,原因是__________________ 。
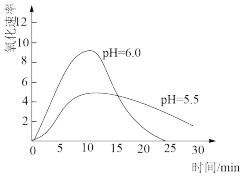
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________ 。
(6)综合以上实验,增强Fe2+稳定性的措施有_________________ 。
实验Ⅰ

| 物质 | 0 min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
| 操作 | 现象 |
| 取 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O
 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。由实验III,乙同学可得出的结论是
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是

(6)综合以上实验,增强Fe2+稳定性的措施有
您最近一年使用:0次
解题方法
10 . 硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
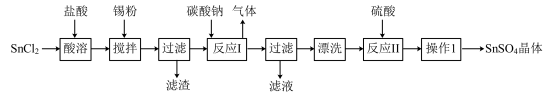
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)锡元素在周期表中位于第五周期,与碳元素位于同一主族,则锡元素的原子的核电荷数为_______ 。
(2)操作Ⅰ是_________ 、冷却结晶________ 、洗涤、干燥。。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因___________________________ 。
(4)加入Sn粉的作用有两个:①调节溶液pH,②__________________________ 。
(5)酸性条件下,SnSO4还可以作双氧水去除剂,发生反应的离子方程式是___________ 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.19g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是___________________ 。

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)锡元素在周期表中位于第五周期,与碳元素位于同一主族,则锡元素的原子的核电荷数为
(2)操作Ⅰ是
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因
(4)加入Sn粉的作用有两个:①调节溶液pH,②
(5)酸性条件下,SnSO4还可以作双氧水去除剂,发生反应的离子方程式是
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.19g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 ml。锡粉中锡的质量分数是
您最近一年使用:0次



