解题方法
1 . 下列有关物质性质与用途对应关系不正确 的是( )
| A.NaHCO3受热易分解,可用于制胃酸中和剂 |
| B.CaO能与SO2反应,可作为工业废气处理时的脱硫剂 |
| C.硅的导电性介于导体和绝缘体之间,可用于制造计算机硅芯片的材料 |
| D.饱和氯水既有酸性又有漂白性,加入适量NaHCO3固体,其漂白性增强 |
您最近一年使用:0次
名校
解题方法
2 . 钒及其化合物在工业上有许多用途。从废钒(主要成分V2O3、V2O5、Fe2O3、FeO、SiO2)中提取五氧化二钒的一种工艺流程如图。

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中V2O3转化为VO2+,反应的离子方程式为_______ ,若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为_____________ 。
(2)萃取前用“铁粉”对浸出液进行处理,主要目的是_________ ,为检验处理后的浸出液中是否含有Fe3+,可选用的化学试剂是______ (填试剂名称)。
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R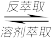 VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用____
a.NaCl b.NaOH c.H2SO4
(4)反萃取后的水层中加KClO3,使VO2+变为VO ,ClO
,ClO 变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为
变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为_________ mol。
(5)已知NH4VO3难溶于水,Ksp=3.0×10﹣8,向10mL 0.2mol•L﹣1 NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为_______________ (溶液中某离子浓度≤1×10﹣5mol•L﹣1时,认为该离子沉淀完全)。

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中V2O3转化为VO2+,反应的离子方程式为
(2)萃取前用“铁粉”对浸出液进行处理,主要目的是
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R
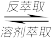 VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用a.NaCl b.NaOH c.H2SO4
(4)反萃取后的水层中加KClO3,使VO2+变为VO
 ,ClO
,ClO 变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为
变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为(5)已知NH4VO3难溶于水,Ksp=3.0×10﹣8,向10mL 0.2mol•L﹣1 NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为
您最近一年使用:0次
3 . 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷还能让心脏有规律地跳动、维持肾脏正常机能和传达神经刺激的重要物质。许多磷的化合物是工业上的重要原料。请完成下列填空:
P(s,红磷)+ O2(g)=
O2(g)= P4O10(s)+738.5 kJ
P4O10(s)+738.5 kJ
P4(s,白磷)+ 5O2(g)=P4O10(s)+2983.2 kJ
(1)则白磷转化为红磷的热化学方程式_____________________ 。
(2)红磷在KOH溶液的悬浊液中和KOCl作用,可以生成K6P6O12的钾盐和KCl等产物。请写出该反应的化学方程式,并标出电子转移方向和数目。____
(3)制备MgNH4PO4时通常在镁盐(如氯化镁)溶液中加Na2HPO4 、氨水和铵盐溶液(如氯化铵),反应式为MgCl2+Na2HPO4+NH3=2NaCl+MgNH4PO4↓。在此反应中,如果不加铵盐,在碱性溶液中,Mg2+将会被氨水沉淀,其离子方程式为____________________ ;加入铵盐之后,可防止产生Mg(OH)2沉淀。请用电离平衡原理解释原因:_________
(4)H3PO3与碘水反应,碘水的棕黄色褪去,生成磷酸,向上述反应后的溶液中加入过量的AgNO3溶液,生成黄色沉淀。则H3PO3与碘水反应的化学方程式为___________ ;黄色沉淀是_________ ,可用作于_____________________ (写出任意一种用途即可)。
P(s,红磷)+
 O2(g)=
O2(g)= P4O10(s)+738.5 kJ
P4O10(s)+738.5 kJ P4(s,白磷)+ 5O2(g)=P4O10(s)+2983.2 kJ
(1)则白磷转化为红磷的热化学方程式
(2)红磷在KOH溶液的悬浊液中和KOCl作用,可以生成K6P6O12的钾盐和KCl等产物。请写出该反应的化学方程式,并标出电子转移方向和数目。
(3)制备MgNH4PO4时通常在镁盐(如氯化镁)溶液中加Na2HPO4 、氨水和铵盐溶液(如氯化铵),反应式为MgCl2+Na2HPO4+NH3=2NaCl+MgNH4PO4↓。在此反应中,如果不加铵盐,在碱性溶液中,Mg2+将会被氨水沉淀,其离子方程式为
(4)H3PO3与碘水反应,碘水的棕黄色褪去,生成磷酸,向上述反应后的溶液中加入过量的AgNO3溶液,生成黄色沉淀。则H3PO3与碘水反应的化学方程式为
您最近一年使用:0次
4 . 元素周期表中第VIIA族元素的单质及其化合物的用途广泛。完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有_________ 种不同能量的电子,写出其最外层电子的轨道表示式____________________________ 。
(2)不能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是______ (填序号)。
a.IBr中溴为-1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)已知:AlF3的熔点为1040℃,AlCl3在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_____________________________________
(4)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:__________________________________
(5)卤素单质及其化合物在许多性质上都存在递变规律,请从物质结构角度说明下列递变规律的原因。
①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是__________________________ 。
②还原性按Cl-、Br-、I-的顺序依次增大,原因是___________________________ 。
(1)与氯元素同族的短周期元素的原子核外有
(2)不能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.IBr中溴为-1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)已知:AlF3的熔点为1040℃,AlCl3在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
(4)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(5)卤素单质及其化合物在许多性质上都存在递变规律,请从物质结构角度说明下列递变规律的原因。
①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是
②还原性按Cl-、Br-、I-的顺序依次增大,原因是
您最近一年使用:0次
名校
5 . 碳酸二甲酯【CO(OCH3)2】是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成:CO2+2CH3OH→CO(OCH3)2+H2O。某研究小组在某温度下,在0.1L恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。下列说法不正确的是


| A.在该温度下,最佳反应时间是10h |
| B.4~10h内碳酸二甲酯的平均反应速率是7.5×10-4mol·L-1·h-1 |
| C.向反应体系中添加催化剂,一定能提高反应的TON |
| D.该合成方法可以利用廉价的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面具有重要意义 |
您最近一年使用:0次
2019-02-05更新
|
567次组卷
|
4卷引用:【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题
【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第3节 化学反应的快慢和限度 第1课时 化学反应的快慢
解题方法
6 . 化学反应原理在工业生产中有广泛的应用。
(1)工业合成氨气的氢气主要来自天然气与水的反应, 但这种原料气中含有CO杂质,工业生产中通过下列反应来实现原料气中CO的除去。
CO(g)+H2O(g) CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取
CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取_____ 措施可提高CO的转化率。在容积为2L的容器中发生上述反应,其中c(CO2)与反应时间(t)的关系如图甲所示,在t0时刻将容器体积扩大至4L,在图甲中画出t0时刻后。c(CO2)与反应时间(t)的变化曲线_____ 。
(2)氨气的重要用途是合成尿素. 当加料比n(NH3)/n(CO2)=4时,CO2的转化率变化如图乙所示,a点v(CO2)逆______ 点v(CO2)正(填“大于”、“小于”或“等于”)。NH3的平衡转化率是______ 。
(3)某科研小组利用CO和H2在密闭容器中反应合成甲醇的实验,容器的开始体积是VL,实验中向容器中加入CO nmol, H22nmol,在一定的压强和催化剂的作用下反应:CO (g)+ 2H2(g) CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
①上述合成甲醇的反应是______ (填 “吸热”或“放热”)反应,图象中的压强p1、p2、p3的大小关系是_______ 。
②由图象分析压强p1温度是100℃时合成甲醇反应的平衡常数K=_______ 。
③在压强是p1温度是100℃的条件下,开始若向容器中加入CO 2nmol,H24nmol,反应达到平衡时CO的转化率_____ (填“变大”、“变小”或“不变”),平衡时CO的物质的量_____ (填“大于”、“小于”或“等于”)nmol
(1)工业合成氨气的氢气主要来自天然气与水的反应, 但这种原料气中含有CO杂质,工业生产中通过下列反应来实现原料气中CO的除去。
CO(g)+H2O(g)
 CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取
CO(g)+ H2(g) △H<0。一定条件下反应达到平衡后采取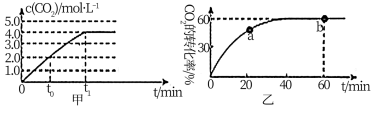
(2)氨气的重要用途是合成尿素. 当加料比n(NH3)/n(CO2)=4时,CO2的转化率变化如图乙所示,a点v(CO2)逆
(3)某科研小组利用CO和H2在密闭容器中反应合成甲醇的实验,容器的开始体积是VL,实验中向容器中加入CO nmol, H22nmol,在一定的压强和催化剂的作用下反应:CO (g)+ 2H2(g)
 CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。
CH3OH(g)。右图为反应达到平衡时CO的转化率与温度、压强的关系。回答下列问题。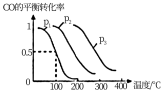
①上述合成甲醇的反应是
②由图象分析压强p1温度是100℃时合成甲醇反应的平衡常数K=
③在压强是p1温度是100℃的条件下,开始若向容器中加入CO 2nmol,H24nmol,反应达到平衡时CO的转化率
您最近一年使用:0次
7 . 铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I.还原沉淀法是处理含CrO42-和Cr2O72-工业废水的一种常用方法,其工艺流程如下:
其中,第I步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系中,pH=0时溶液呈______ 色。
(2)以石墨为电极,电解Na2CrO4制备Na2CrO7的装置如图所示,a极的名称是_______ ;第I步中b极直接相连一极的反应式为_______________ 。
(3)第II步的离子方程式为______________ ;向第II步反应后的溶液中加入一定量烧碱,若溶液中c(Fe3+)=2.0×10-12mol/L,则溶液中c(Cr3+)=_______ mol/L。
(已知:Ksp[Fe(OH)3]=4.0×10-38mol/L,Ksp[Cr(OH)3]=6.0×10-31mol/L)
II.探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛然反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:a CrO3+bC2H5OH+cH2SO4=d Cr2(SO4)3+eCH3COOH+fR
b:c:f=_________ 。
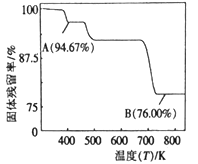
(5)CrO3的热稳定性差,加热时逐步分解,其固体残解率随温度的变化如图所示。B点时生成固体的化学式为______ 。( )。
)。
I.还原沉淀法是处理含CrO42-和Cr2O72-工业废水的一种常用方法,其工艺流程如下:

其中,第I步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)若平衡体系中,pH=0时溶液呈
(2)以石墨为电极,电解Na2CrO4制备Na2CrO7的装置如图所示,a极的名称是

(3)第II步的离子方程式为
(已知:Ksp[Fe(OH)3]=4.0×10-38mol/L,Ksp[Cr(OH)3]=6.0×10-31mol/L)
II.探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛然反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:a CrO3+bC2H5OH+cH2SO4=d Cr2(SO4)3+eCH3COOH+fR
b:c:f=
(5)CrO3的热稳定性差,加热时逐步分解,其固体残解率随温度的变化如图所示。B点时生成固体的化学式为
 )。
)。
您最近一年使用:0次
8 . 磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式:_______________________ 。
②n越大,直链聚磷酸铵的水溶性越_______________ (填“大”或“小”)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。

______________________________________
(3)由工业白磷 (含少量砷、铁、镁等) 制备高纯白磷 ( 熔点44℃,沸点280℃),主要生产流程如下:
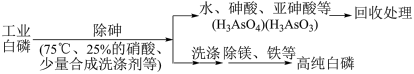
①除砷过程在75 ℃下进行,其合理的原因是__________ (填字母)。
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是_________________________________ 。
③除砷过程中,合成洗涤剂起到________________ 作用。
④硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式:_______________ 。
氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越______ (填“多”或“少”)。
⑤某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是_______ 。

(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式:
②n越大,直链聚磷酸铵的水溶性越
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。

(3)由工业白磷 (含少量砷、铁、镁等) 制备高纯白磷 ( 熔点44℃,沸点280℃),主要生产流程如下:
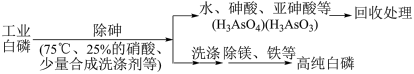
①除砷过程在75 ℃下进行,其合理的原因是
a.使白磷熔化,提高反应活性
b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解
d.适当提高温度,增大反应速率
②生产过程在高纯氮气保护下进行,其目的是
③除砷过程中,合成洗涤剂起到
④硝酸氧化除砷时被还原为NO,写出砷转化为砷酸的化学方程式:
氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越
⑤某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是

您最近一年使用:0次
10-11高一下·山东济宁·期末
9 . (1)在密闭容器里,通入x mol SO2和y mol O2,发生化学反应:2SO2 (g) + O2 (g) 2SO3(g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2SO3(g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
①降低温度____________________ ;
②当容器容积不变,充入更多的O2____________________ ;
③当容器容积不变,通入氖气____________________ 。
(2)来自石油的基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
④可以用来鉴别苯蒸气和乙烯的试剂是____________________ (填序号)。
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液
⑤苯分子具有平面正六边形结构,所有原子共一个平面,则苯分子中在一条直线上的原子最多有____________________ 个。
⑥在一定条件下,乙烯能与水发生加成反应生成有机物A,写出A与Na反应的化学方程式________________________________________ 。
 2SO3(g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2SO3(g) ;当其它条件不变时,改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)①降低温度
②当容器容积不变,充入更多的O2
③当容器容积不变,通入氖气
(2)来自石油的基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
④可以用来鉴别苯蒸气和乙烯的试剂是
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液
⑤苯分子具有平面正六边形结构,所有原子共一个平面,则苯分子中在一条直线上的原子最多有
⑥在一定条件下,乙烯能与水发生加成反应生成有机物A,写出A与Na反应的化学方程式
您最近一年使用:0次



