元素周期表中第VIIA族元素的单质及其化合物的用途广泛。完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有_________ 种不同能量的电子,写出其最外层电子的轨道表示式____________________________ 。
(2)不能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是______ (填序号)。
a.IBr中溴为-1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)已知:AlF3的熔点为1040℃,AlCl3在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_____________________________________
(4)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:__________________________________
(5)卤素单质及其化合物在许多性质上都存在递变规律,请从物质结构角度说明下列递变规律的原因。
①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是__________________________ 。
②还原性按Cl-、Br-、I-的顺序依次增大,原因是___________________________ 。
(1)与氯元素同族的短周期元素的原子核外有
(2)不能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.IBr中溴为-1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)已知:AlF3的熔点为1040℃,AlCl3在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:
(4)HClO有很好的杀菌消毒效果。为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:
(5)卤素单质及其化合物在许多性质上都存在递变规律,请从物质结构角度说明下列递变规律的原因。
①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是
②还原性按Cl-、Br-、I-的顺序依次增大,原因是
更新时间:2019-10-24 10:48:46
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铂和钯同属于铂族元素,其价格均高于黄金,在工业上有广泛的应用。电解精炼铜阳极泥中除含有较多的铂、钯和银以外,还有少量的镍、铜等元素。一种综合提取阳极泥中贵重金属的工艺流程如下:
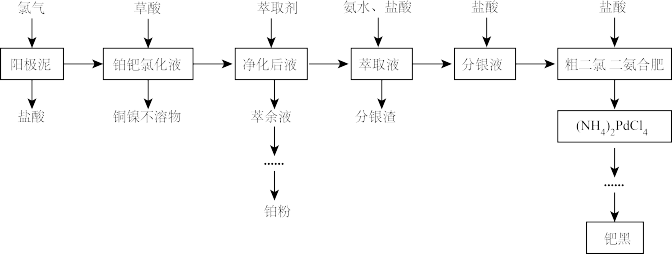
请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是_______ 。
(2)阳极泥中的单质钯反应后转化为 请写出该反应的离子方程式
请写出该反应的离子方程式_______ 。
(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
表2反应温度对铜镍去除率的影响
则草酸的过量系数应为_______ 。实际工业中采用的温度为80—85℃。试分析其原因_______ 。
(4)已知 配离子存在解离平衡:
配离子存在解离平衡: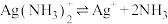 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理_______ 。
(5)分银液中加盐酸把 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为_______ 。
(6)海绵钯具有优良的吸氢功能,其密度为 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=_______  ,氢气的浓度r=
,氢气的浓度r=_______ (吸附容量R是指1g钯吸附氢气的体积;氢气的浓度r为 吸附氢气的物质的量)。
吸附氢气的物质的量)。

请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是
(2)阳极泥中的单质钯反应后转化为
 请写出该反应的离子方程式
请写出该反应的离子方程式(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
| 过量系数 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 1.0 | 16.93 | 1.47 | 68.44 | 46.15 |
| 1.5 | 4.67 | 0.61 | 91.30 | 77.66 |
| 2.0 | 0.091 | 0.031 | 99.83 | 98.86 |
| 2.5 | 0.25 | 0.042 | 99.53 | 98.46 |
| 3.0 | 0.28 | 0.040 | 99.48 | 98.53 |
| 4.0 | 0.26 | 0.035 | 99.52 | 98.72 |
| 温度 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 70 | 0.65 | 0.130 | 98.799 | 95.24 |
| 75 | 0.26 | 0.091 | 9.52 | 96.67 |
| 80 | 0.18 | 0.043 | 99.66 | 98.42 |
| 85 | 0.15 | 0.045 | 99.72 | 98.35 |
| 90 | 0.14 | 0.042 | 99.74 | 98.46 |
| 95 | 0.14 | 0.040 | 99.74 | 98.53 |
(4)已知
 配离子存在解离平衡:
配离子存在解离平衡: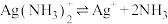 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理(5)分银液中加盐酸把
 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为(6)海绵钯具有优良的吸氢功能,其密度为
 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R= ,氢气的浓度r=
,氢气的浓度r= 吸附氢气的物质的量)。
吸附氢气的物质的量)。
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3发生反应的化学方程式为_________ 。
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有____ (填化学式)。
(3)用平衡移动原理解释酸化过程中可以得到Na2Cr2O7溶液________________ ,写出还原过程中的化学反应方程式_______________ ,此工艺流程中可以循环利用的物质___________ 。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定。(已知Cr2O 被还原为Cr3+)
被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为___________ 。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为__________ 。[已知M(K2Cr2O7)=294 g·mol-1]

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2
 2CuO+TeO2。
2CuO+TeO2。(1)煅烧时,Cr2O3发生反应的化学方程式为
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有
(3)用平衡移动原理解释酸化过程中可以得到Na2Cr2O7溶液
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定。(已知Cr2O
 被还原为Cr3+)
被还原为Cr3+)①氧化还原滴定过程中的离子方程式为
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)已知:①CO燃烧热的△H1=-283.0kJ·mol-l,②N2(g)+O2(g)⇌2NO(g) ∆H2=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g); ∆H=_______ 。
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示。

①该反应第一次达到平衡时的平衡常数为_______ 。
②第12min时改变的条件是_______ 。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_______ 移动(填“正向”、“逆向”或“不”)。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),∆H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是_______ 。

②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为_______ 。
(1)已知:①CO燃烧热的△H1=-283.0kJ·mol-l,②N2(g)+O2(g)⇌2NO(g) ∆H2=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g); ∆H=
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示。

①该反应第一次达到平衡时的平衡常数为
②第12min时改变的条件是
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),∆H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是

②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
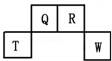
(1)W在周期表中的位置是______ ,Q、R、T三种元素原子半径由大到小顺序为______ (用元素符号表示),Q的最高价氧化物的电子式为______ ,R的气态氢化物与其最高价氧化物对应水化物反应,生成的化合物属于______ (填“离子化合物”或“共价化合物”)
(2)元素的原子得电子能力:Q______ W(填“强于”或“弱于”).
(3)原子序数比R多1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为______ .

(1)W在周期表中的位置是
(2)元素的原子得电子能力:Q
(3)原子序数比R多1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.卤素单质及其化合物在社会生产、生活中有重要的应用。
(1)①卤素原子的最外层电子数相同,碘离子的电子式为___________ 。
②同温同压下,HBr气体和HI气体的体积比为1:2,则这两种气体的质量之比为___________ 。标准状况下, 氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为
氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为___________ 。
③漂白粉在使用过程中,吸收 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(2)卤素单质及化合物在许多性质上都存在着递变规律,下列有关说法中,正确的是___________。
Ⅱ.某同学设计了如图所示装置,进行实验。实验操作步骤如下:

①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④___________,取下试管c震荡,静置。
请回答:
(3)步骤②中反应的离子方程式为:___________ 。设计步骤③的实验目的是___________ 。
(4)步骤④横线上的操作是___________ 。
(5)从试管c中获得纯净的碘单质,需进行的操作步骤为___________ 。
(6)本实验的目的是:___________ 。
(1)①卤素原子的最外层电子数相同,碘离子的电子式为
②同温同压下,HBr气体和HI气体的体积比为1:2,则这两种气体的质量之比为
 氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为
氯气被足量石灰乳完全吸收,所制得的漂白粉中,有效成分的质量为③漂白粉在使用过程中,吸收
 发生反应的化学方程式为
发生反应的化学方程式为(2)卤素单质及化合物在许多性质上都存在着递变规律,下列有关说法中,正确的是___________。
| A.卤化氢的热稳定性按HCl、HBr、HI的顺序依次增强 |
| B.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深 |
| C.卤化钠的还原性按NaCl、NaBr,NaI的顺序依次增强 |
D.卤素单质与氢气化合按 、 、 、 、 的顺序由难变易 的顺序由难变易 |
Ⅱ.某同学设计了如图所示装置,进行实验。实验操作步骤如下:

①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④___________,取下试管c震荡,静置。
请回答:
(3)步骤②中反应的离子方程式为:
(4)步骤④横线上的操作是
(5)从试管c中获得纯净的碘单质,需进行的操作步骤为
(6)本实验的目的是:
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,先已将整个元素周期表填满。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
(1)写出Cl-的离子结构示意图___ 。
(2)元素Ga在元素周期表中的位置为___ (写明周期和族)。
(3)Sn的最高正价为__ ,As的气态氢化物为__ (填化学式)。
(4)根据元素周期律推断:
①阴影部分元素氢化物热稳定性最高的是___ (填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4___ H2SeO4(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(5)硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是__ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
| B | C | N | O | F |
| Al | Si | P | S | Cl |
| Ga | Ge | As | Se | Br |
| In | Sn | Sb | Te | I |
| Ti | Pb | Bi | Po | At |
(2)元素Ga在元素周期表中的位置为
(3)Sn的最高正价为
(4)根据元素周期律推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
 ”、“
”、“ ”或“
”或“ ”)。
”)。(5)硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】技术人员制工程蓝图时,是用K3Fe(C2O4)3·3H2O(三草酸合铁酸钾)作感光剂,再以K3Fe(CN)6(六氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)K3Fe(CN)6是检验Fe2+的特征试剂,写出Fe2+的价电子排布图______ 。
(2)在组成上述两种钾盐的元素中第一电离能最大的元素为______ 。
(3)H2C2O4分子中碳原子的杂化类型是______ ;与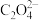 互为等电子体分子的化学式为
互为等电子体分子的化学式为______ 。
(4)六氰合铁酸钾常温下很稳定,经灼烧可完全分解,产生剧毒的氰化钾和氰:2K3Fe(CN)6 6KCN+2FeC2+2N2↑+(CN)2↑,反应物K3Fe(CN)6中含有的σ键和π键数目比为
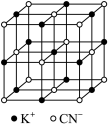
6KCN+2FeC2+2N2↑+(CN)2↑,反应物K3Fe(CN)6中含有的σ键和π键数目比为______ 。若KCN的晶胞结构如图所示,则KCN晶体中距离K+最近的K+的数目为______ 。
(1)K3Fe(CN)6是检验Fe2+的特征试剂,写出Fe2+的价电子排布图
(2)在组成上述两种钾盐的元素中第一电离能最大的元素为
(3)H2C2O4分子中碳原子的杂化类型是
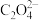 互为等电子体分子的化学式为
互为等电子体分子的化学式为(4)六氰合铁酸钾常温下很稳定,经灼烧可完全分解,产生剧毒的氰化钾和氰:2K3Fe(CN)6
 6KCN+2FeC2+2N2↑+(CN)2↑,反应物K3Fe(CN)6中含有的σ键和π键数目比为
6KCN+2FeC2+2N2↑+(CN)2↑,反应物K3Fe(CN)6中含有的σ键和π键数目比为
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】现有属于前四周期的 A、B、C、D、E、F、G六种元素,原子序数依次增大。A 元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A、B、C三种元素的电负性由小到大的顺序为___________ (用元素符号表示)。
(2)C元素的电子排布图为___________ ;E3+的离子符号为___________ 。
(3)F元素位于元素周期表的___________ 区,其基态原子的电子排布式为___________
(4) D元素的第一电离能___________ (填“<”“>”或“=”)Al元素的第一电离能,其原因是___________ 。
(5)G元素可能的性质___________ 。
A.其单质可作为半导体材料 B.其电负性大于磷
C.其原子半径大于锗 D.其第一电离能小于硒
 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。(1)A、B、C三种元素的电负性由小到大的顺序为
(2)C元素的电子排布图为
(3)F元素位于元素周期表的
(4) D元素的第一电离能
(5)G元素可能的性质
A.其单质可作为半导体材料 B.其电负性大于磷
C.其原子半径大于锗 D.其第一电离能小于硒
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】锂是相对质量最小的金属,锂及其化合物在有机合成、电池等领域应用广泛。回答下列问题:
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中阴离子的空间构型为___________ ,氢元素的化合价为___________ 。
(2)叔丁基锂[(CH3)3CLi]在有机合成中,可以提供碳负离子(CH3)3C-,叔丁基负离子中碳的杂化方式为___________ ,(CH3)3CLi中元素电负性由大到小的顺序为___________ 。
(3)锂钴复合氧化物是目前常用锂离子电池的正极材料,其理想结构如图所示。
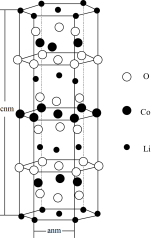
①基态Co3+的价电子排布图为___________ 。
②该理想结构可分割为___________ 个晶胞。
③锂钴复合氧化物的化学式为___________ ,已知该理想结构的晶胞边长为分别为anm和cnm,该晶体的密度为___________ g/cm3(用含a、c以及NA的计算式表达,NA为阿伏加德罗常数的值)。
(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中阴离子的空间构型为
(2)叔丁基锂[(CH3)3CLi]在有机合成中,可以提供碳负离子(CH3)3C-,叔丁基负离子中碳的杂化方式为
(3)锂钴复合氧化物是目前常用锂离子电池的正极材料,其理想结构如图所示。

①基态Co3+的价电子排布图为
②该理想结构可分割为
③锂钴复合氧化物的化学式为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】CO2的资源化利用是解决温室效应的重要途径。科学家致力于CO2与H2反应制CH3OH的研究。
(1)CO2分子中碳原子的杂化轨道类型为____ ;干冰是很好的制冷剂,干冰升华时,CO2需要克服的作用力是____ 。
(2)CH3OH所含有的三种元素电负性从大到小的顺序为____ (用元素符号表示)。
(3)CH3OH的沸点比CO2高,主要原因是____ 。
(4)CH3OH被氧化为HCHO,HCHO继续被氧化可生成HCOOH。HCHO分子的空间结构为____ ,HCOOH分子内σ键与π键个数之比为____ 。
(1)CO2分子中碳原子的杂化轨道类型为
(2)CH3OH所含有的三种元素电负性从大到小的顺序为
(3)CH3OH的沸点比CO2高,主要原因是
(4)CH3OH被氧化为HCHO,HCHO继续被氧化可生成HCOOH。HCHO分子的空间结构为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】Pb为第ⅣA元素。常见的化合价为+2和+4,其单质和化合物都有着广泛的用途。
已知Pb2+可以和EDTA|乙二胺四乙酸(HOOCCH2)2NCH2-CH2N(CH2COOH)2|形成无色的1:1的稳定络合物。
请回答下列问题:
(1)基态Pb原子价电子排布式为___
(2)碳、硅与铅同主族。碳纳米管可以制成透明导电的薄膜,其结构类似于石墨晶体,则多层碳纳米管的层与层之间靠___ 结合在一起。四卤化硅(SiX4)均是无机化工品,其沸点按F、Cl、Br、I依次升高的原因是____
(3)在EDTA中,碳原子的杂化方式有____ 、___ 。组成EDTA的四种元素中第一电离能最大的是____
(4)Pb(NO3)2中阴离子的立体构型是____ ,写出一个与该阴离子立体构型相同的分子的化学式___
(5)Sn与Pb同为第ⅣA元素。请用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角___ 120°(填“>” “<即或“=”)。
(6)Pb与Ti、O构成的晶体可用于制造复合电子陶瓷,该晶体的晶胞如图所示,其中Pb、Ti、O分别位于顶点、体心和面心,该晶体的化学式为___ ,若晶胞参数为a nm,则Pb与O间的最短距离为___ nm,与Pb紧邻的O个数为___

已知Pb2+可以和EDTA|乙二胺四乙酸(HOOCCH2)2NCH2-CH2N(CH2COOH)2|形成无色的1:1的稳定络合物。
请回答下列问题:
(1)基态Pb原子价电子排布式为
(2)碳、硅与铅同主族。碳纳米管可以制成透明导电的薄膜,其结构类似于石墨晶体,则多层碳纳米管的层与层之间靠
(3)在EDTA中,碳原子的杂化方式有
(4)Pb(NO3)2中阴离子的立体构型是
(5)Sn与Pb同为第ⅣA元素。请用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角
(6)Pb与Ti、O构成的晶体可用于制造复合电子陶瓷,该晶体的晶胞如图所示,其中Pb、Ti、O分别位于顶点、体心和面心,该晶体的化学式为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是________ ,基态D原子价电子的轨道表达式为________________ 。
(2)DA2分子的VSEPR模型是____________ 。
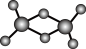
(3)实验测得C与氯元素形成的化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于________ (填晶体类型)晶体,其中C原子的杂化轨道类型为________ 杂化。
②[C(OH)4]-中存在的化学键有____________________________________________ 。
(4)单质A有两种同素异形体,其中沸点高的是__________ (填分子式),原因是______________________________________________________________
(5)D与E所形成化合物晶体的晶胞如图所示 。

①在该晶胞中,E的配位数为________ 。
②原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2);c为(1/2,1/2,0)。则d的坐标参数为________ 。
(1)B、C中第一电离能较大的是
(2)DA2分子的VSEPR模型是

(3)实验测得C与氯元素形成的化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于
②[C(OH)4]-中存在的化学键有
(4)单质A有两种同素异形体,其中沸点高的是
(5)D与E所形成化合物晶体的晶胞如图所示 。

①在该晶胞中,E的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2);c为(1/2,1/2,0)。则d的坐标参数为
您最近半年使用:0次



