血红蛋白(Hb)与肌红蛋白(Mb)是由肽链和血红素辅基组成的可结合氧的蛋白,广泛存在于人体组织中。回答下列问题:
(1)血红蛋白能结合O2形成动脉血,存在如下反应:
①Hb(aq)+H+(aq) HbH+(aq) ΔH1
HbH+(aq) ΔH1
②HbH+(aq)+O2(g) HbO2(aq)+H+(aq) ΔH2
HbO2(aq)+H+(aq) ΔH2
③Hb(aq)+O2(g) HbO2(aq) ΔH3
HbO2(aq) ΔH3
ΔH3=___ (用ΔH1、ΔH2表示),反应②可自发进行,则其△H___ 0(填“>”或“<”)。
血液中还同时存在反应:④CO2+H2O H++HCO
H++HCO ,旅客常因为青藏高原的氧分压较低,体内CO2不能及时排出体外而产生高原反应,从化学平衡角度解释产生高原反应的原因
,旅客常因为青藏高原的氧分压较低,体内CO2不能及时排出体外而产生高原反应,从化学平衡角度解释产生高原反应的原因___ 。
科研人员仅对于反应②进行模拟研究发现,37℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时HbH+与氧气的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为___ (填“A”或“B”)。
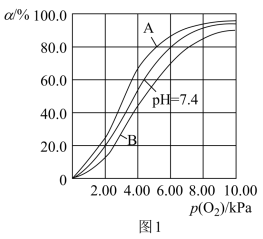
(2)肌肉中肌红蛋白Mb也可结合O2形成MbO2的反应为Mb(aq)+O2(g) MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=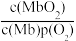 ,正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)。其它条件不变,随着氧分压p(O2)增大,
,正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)。其它条件不变,随着氧分压p(O2)增大, 的值
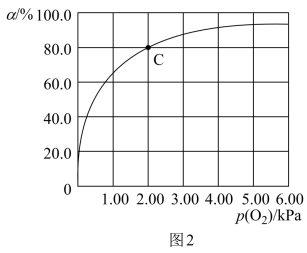
的值___ (填“增大”、“减小”或“不变”);在氧分压p(O2)=2.00 kPa的平衡体系中,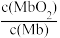 =4.0。若吸入的空气中p(O2)=21 kPa,计算此时Mb与氧气的最大结合度α(转化率)约为
=4.0。若吸入的空气中p(O2)=21 kPa,计算此时Mb与氧气的最大结合度α(转化率)约为___ (保留两位有效数字);图2中C点时, =
=___ 。
(1)血红蛋白能结合O2形成动脉血,存在如下反应:
①Hb(aq)+H+(aq)
 HbH+(aq) ΔH1
HbH+(aq) ΔH1②HbH+(aq)+O2(g)
 HbO2(aq)+H+(aq) ΔH2
HbO2(aq)+H+(aq) ΔH2③Hb(aq)+O2(g)
 HbO2(aq) ΔH3
HbO2(aq) ΔH3ΔH3=
血液中还同时存在反应:④CO2+H2O
 H++HCO
H++HCO ,旅客常因为青藏高原的氧分压较低,体内CO2不能及时排出体外而产生高原反应,从化学平衡角度解释产生高原反应的原因
,旅客常因为青藏高原的氧分压较低,体内CO2不能及时排出体外而产生高原反应,从化学平衡角度解释产生高原反应的原因科研人员仅对于反应②进行模拟研究发现,37℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时HbH+与氧气的结合度α(转化率)的关系如图1所示,当pH=7.6时对应的曲线应为

(2)肌肉中肌红蛋白Mb也可结合O2形成MbO2的反应为Mb(aq)+O2(g)
 MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=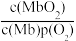 ,正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)。其它条件不变,随着氧分压p(O2)增大,
,正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)。其它条件不变,随着氧分压p(O2)增大, 的值
的值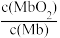 =4.0。若吸入的空气中p(O2)=21 kPa,计算此时Mb与氧气的最大结合度α(转化率)约为
=4.0。若吸入的空气中p(O2)=21 kPa,计算此时Mb与氧气的最大结合度α(转化率)约为 =
=
20-21高三上·山东济南·阶段练习 查看更多[2]
更新时间:2021-01-21 12:38:21
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、 )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:
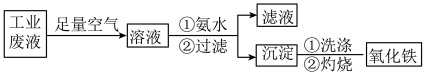
已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式:_________ ,指出使用空气比使用氯气好的原因是__________ 。
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________ 。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=____________ 。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________ (填化学式,下同),用________ 试剂可将其除去。
 )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:
已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式:
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】按要求填空
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1___ △H2(填“>”、“<”或“=”,下同)。
(2)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1___ △H2。
①P4(白磷,s)+5O2(g)=2P2O5(s)△H1
②4P(红磷,s)+5O2(g)=2P2O5(s)△H2
(3)磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示:

(图中的ΔH表示生成1mol产物的数据)。PCl5分解成PCl3和Cl2的热化学方程式是___ 。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700℃的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g),ΔH=-akJ/mol
Si3N4(s)+6CO(g),ΔH=-akJ/mol
,则该反应每转移1mole-,可放出的热量为___ kJ。
(5)某温度时在2L容器中发生可逆反应A(s)+3B(g) 2C(g),下列叙述能说明上述反应达到平衡状态的是
2C(g),下列叙述能说明上述反应达到平衡状态的是___ 。
(6)某小组利用H2C2O4溶液与用硫酸酸化的KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
①该反应的离子方程式为___ 。
②实验A测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=___ 。
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1
(2)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1
①P4(白磷,s)+5O2(g)=2P2O5(s)△H1
②4P(红磷,s)+5O2(g)=2P2O5(s)△H2
(3)磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示:

(图中的ΔH表示生成1mol产物的数据)。PCl5分解成PCl3和Cl2的热化学方程式是
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700℃的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g),ΔH=-akJ/mol
Si3N4(s)+6CO(g),ΔH=-akJ/mol,则该反应每转移1mole-,可放出的热量为
(5)某温度时在2L容器中发生可逆反应A(s)+3B(g)
 2C(g),下列叙述能说明上述反应达到平衡状态的是
2C(g),下列叙述能说明上述反应达到平衡状态的是| A.混合气体的平均摩尔质量不随时间的变化而变化 |
| B.相同时间内消耗2nmol的A的同时生成4nmol的C |
| C.容器内压强不随时间的变化而变化 |
| D.容器内密度不再发生变化 |
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 蒸馏水体积/ml | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| A | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 25 |
| B | 0.50 | a | 0.010 | 4.0 | c | 25 |
| C | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 50 |
②实验A测得反应所用的时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。
(1)甲醇是一种可再生能源,由 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
则:反应Ⅲ的
___________  。
。
(2)对于反应Ⅰ,不同温度对 的转化率及催化剂的催化效率影响如图所示,下列有关说法不正确的是___________。
的转化率及催化剂的催化效率影响如图所示,下列有关说法不正确的是___________。

(3)对于反应Ⅰ,一定条件下在 的密闭容器,起始物
的密闭容器,起始物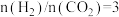 时发生反应测得
时发生反应测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。

①从 到
到 ,
,
___________  。
。
②该条件下 的平衡转化率为
的平衡转化率为___________ ,该反应的化学平衡常数为___________ 。
(4)一种新型的“锂-呼吸 电池”,结构如图所示,电极a为
电池”,结构如图所示,电极a为___________ 极,该极的电极反应为___________ 。

(1)甲醇是一种可再生能源,由
 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

则:反应Ⅲ的

 。
。(2)对于反应Ⅰ,不同温度对
 的转化率及催化剂的催化效率影响如图所示,下列有关说法不正确的是___________。
的转化率及催化剂的催化效率影响如图所示,下列有关说法不正确的是___________。
A.其他条件不变,若不使用催化剂,则 时 时 的平衡转化率可能位于N点 的平衡转化率可能位于N点 |
| B.M点时对应平衡常数比N点时对应平衡常数大 |
C.温度低于 时,随温度升高甲醇的平衡产率增大 时,随温度升高甲醇的平衡产率增大 |
D.实际反应时既要考虑较高的催化效率,也要兼顾较高的 的平衡转化率 的平衡转化率 |
 的密闭容器,起始物
的密闭容器,起始物 时发生反应测得
时发生反应测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
①从
 到
到 ,
,
 。
。②该条件下
 的平衡转化率为
的平衡转化率为(4)一种新型的“锂-呼吸
 电池”,结构如图所示,电极a为
电池”,结构如图所示,电极a为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
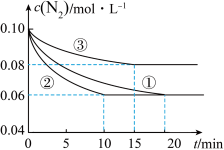
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________ ;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________ 、__________ (填字母编号)。
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol/L,则该反应的平衡常数K=__________ ;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将__________ (填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是__________ (填字母编号)。
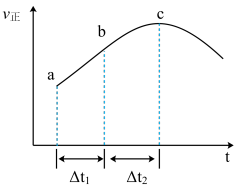
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______ b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=________________ 。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)
 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g)
 N2O4(g)。
N2O4(g)。①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol/L,则该反应的平衡常数K=
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a
 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氢氰酸(HCN)有剧毒,易挥发。金矿提金时,用NaCN溶液浸取金生成[Au(CN)2]-,再用锌置换出金,产生的含氰废水需处理后排放。
(1)①写出基态锌离子的电子排布式____ ,基态氮原子的轨道表示式____ 。
②NaCN可用于制备CuCN,CuCN浊液中加入Na2S溶液可发生反应:2CuCN(S)+S2-(aq) Cu2S(s)+2CN-(aq),该反应的平衡常数K=
Cu2S(s)+2CN-(aq),该反应的平衡常数K=____ 。[已知Ksp(CuCN)=3.5×10-20,Ksp(Cu2S)=1.0×10-48]。
(2)Cu2+可催化H2O2氧化废水中的CN-。其他条件相同时,总氰化物(CN-、HCN等)去除率随溶液初始pH变化如图所示。
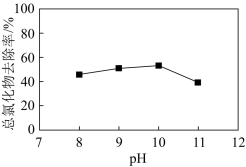
①在酸性条件下,H2O2也能氧化CN-,但实际处理废水时却不在酸性条件下进行的原因是____ 。
②当溶液初始pH>10时,总氰化物去除率下降的原因可能是____ 。
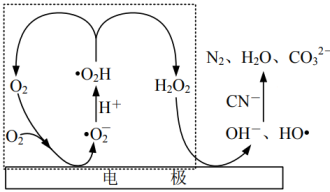
(3)通过电激发产生HO•和OH-处理废水中的CN-,可能的反应机理如图所示。虚线方框内历程可用方程式描述为____ 。
(1)①写出基态锌离子的电子排布式
②NaCN可用于制备CuCN,CuCN浊液中加入Na2S溶液可发生反应:2CuCN(S)+S2-(aq)
 Cu2S(s)+2CN-(aq),该反应的平衡常数K=
Cu2S(s)+2CN-(aq),该反应的平衡常数K=(2)Cu2+可催化H2O2氧化废水中的CN-。其他条件相同时,总氰化物(CN-、HCN等)去除率随溶液初始pH变化如图所示。

①在酸性条件下,H2O2也能氧化CN-,但实际处理废水时却不在酸性条件下进行的原因是
②当溶液初始pH>10时,总氰化物去除率下降的原因可能是
(3)通过电激发产生HO•和OH-处理废水中的CN-,可能的反应机理如图所示。虚线方框内历程可用方程式描述为

您最近一年使用:0次
【推荐3】降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
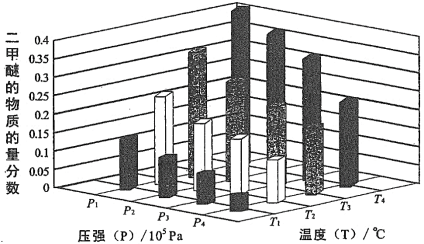
某温度下,将2.0 mol CO2(g) 和6.0 mol H2(g)充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质分数变化情况如图所示,则P1_______ P2(填“>”“<”或“=”,下同)。若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1________ K3,T1、P1时H2的平衡转化率为______________ 。
②在恒容密闭容器里按体积比为1∶3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______ (填序号)。
A.反应物的浓度增大 B.混合气体的密度减小
C.正反应速率小于逆反应速率 D.氢气的转化率减小
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量、产生的气体与加入盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:当加入HCl 的物质的量为1 mol时,溶液中所含溶质的化学式__________ ,a点溶液中各离子浓度由大到小的关系式为____________________________________ 。
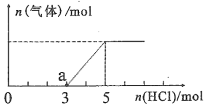
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp = 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4 mol·L-1,则生成沉淀加入CaCl2溶液的最小浓度为___________ mol·L-1。
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g) + 6H2(g)
 CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1
CH3OCH3(g) + 3H2O(g) △H= -122.4kJ·mol-1某温度下,将2.0 mol CO2(g) 和6.0 mol H2(g)充入容积为2 L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质分数变化情况如图所示,则P1

②在恒容密闭容器里按体积比为1∶3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是
A.反应物的浓度增大 B.混合气体的密度减小
C.正反应速率小于逆反应速率 D.氢气的转化率减小
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量、产生的气体与加入盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:当加入HCl 的物质的量为1 mol时,溶液中所含溶质的化学式

(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp = 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4 mol·L-1,则生成沉淀加入CaCl2溶液的最小浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】二氧化碳加氢制甲醇和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:
(1) 加氢选择合成甲醇的主要反应如下:
加氢选择合成甲醇的主要反应如下:
反应ⅰ: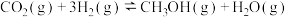

反应ⅱ: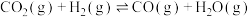
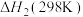
反应ⅲ:
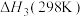
①在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,下表为298K时几种物质的标准摩尔生成焓( )。
)。
有利于反应ⅰ自发进行的条件是___________ (填“高温”或“低温”);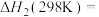
___________  。
。
②反应ⅱ的反应速率 ,其中
,其中 、
、 分别为正、逆反应速率常数。该反应的平衡常数
分别为正、逆反应速率常数。该反应的平衡常数 ,则m=
,则m=___________ ,升高温度时,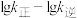
___________ (填“增大”、“减小”或“不变”)。
(2)甲烷重整工艺主要包括甲烷三重整制氢、甲烷二氧化碳重整制氢等。
甲烷三重整制氢的逆反应为 。将
。将 与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为
与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为 ,在
,在 条件下
条件下 与p的关系、在
与p的关系、在 条件下
条件下 与t的关系如图所示:
与t的关系如图所示:
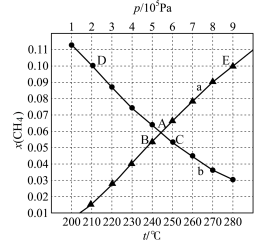
①当CO的平衡转化率为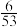 时,反应条件可能是
时,反应条件可能是___________ ;图中能表示相同状态下、相同平衡状态的点是___________ 。
②210℃时,甲烷三重整制氢反应的标准平衡常数
___________ 。(已知:分压=总压×该组分物质的量分数,对于反应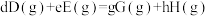 ,
, ,其中
,其中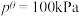 ,
,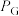 、
、 、
、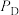 、
、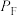 为各组分的平衡分压)
为各组分的平衡分压)
(1)
 加氢选择合成甲醇的主要反应如下:
加氢选择合成甲醇的主要反应如下:反应ⅰ:
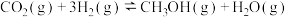

反应ⅱ:
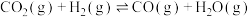
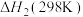
反应ⅲ:

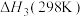
①在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,下表为298K时几种物质的标准摩尔生成焓(
 )。
)。| 物质 |  |  |  |  |  |  |
 | 0 | 0 | -110.5 | -393.5 | -241.8 | -201.2 |
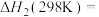
 。
。②反应ⅱ的反应速率
 ,其中
,其中 、
、 分别为正、逆反应速率常数。该反应的平衡常数
分别为正、逆反应速率常数。该反应的平衡常数 ,则m=
,则m=
(2)甲烷重整工艺主要包括甲烷三重整制氢、甲烷二氧化碳重整制氢等。
甲烷三重整制氢的逆反应为
 。将
。将 与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为
与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为 ,在
,在 条件下
条件下 与p的关系、在
与p的关系、在 条件下
条件下 与t的关系如图所示:
与t的关系如图所示:
①当CO的平衡转化率为
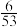 时,反应条件可能是
时,反应条件可能是②210℃时,甲烷三重整制氢反应的标准平衡常数

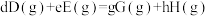 ,
, ,其中
,其中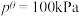 ,
,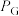 、
、 、
、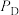 、
、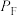 为各组分的平衡分压)
为各组分的平衡分压)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】天然气的主要成分为 ,一般还含有
,一般还含有 等烃类,是重要的燃料和化工原料。
等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:
 ,相关物质的燃烧热数据如下表所示:
,相关物质的燃烧热数据如下表所示:
①
___________  。
。
②提高该反应平衡转化率的方法有___________ 、___________ 。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下: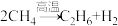 。反应在初期阶段的速率方程为:
。反应在初期阶段的速率方程为: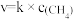 ,其中k为反应速率常数。
,其中k为反应速率常数。
①设反应开始时的反应速率为v1,甲烷的转化率为α时的反应速率为v2,则v2=___________ v1。
②对于处于初期阶段的该反应,下列说法正确的是___________ 。
A.增加甲烷浓度,v增大 B.增加 浓度,v增大
浓度,v增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
 ,一般还含有
,一般还含有 等烃类,是重要的燃料和化工原料。
等烃类,是重要的燃料和化工原料。(1)乙烷在一定条件可发生如下反应:

 ,相关物质的燃烧热数据如下表所示:
,相关物质的燃烧热数据如下表所示:| 物质 |  (g) (g) |  (g) (g) |  (g) (g) |
燃烧热 /( /( ) ) | -1560 | -1411 | -286 |
①

 。
。②提高该反应平衡转化率的方法有
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数

(2)高温下,甲烷生成乙烷的反应如下:
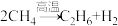 。反应在初期阶段的速率方程为:
。反应在初期阶段的速率方程为: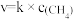 ,其中k为反应速率常数。
,其中k为反应速率常数。①设反应开始时的反应速率为v1,甲烷的转化率为α时的反应速率为v2,则v2=
②对于处于初期阶段的该反应,下列说法正确的是
A.增加甲烷浓度,v增大 B.增加
 浓度,v增大
浓度,v增大C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氮的氧化物、硫的氧化物是主要的大气污染物,对这些有害气体的治理及合理利用显得尤为重要。回答下列问题:
I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:
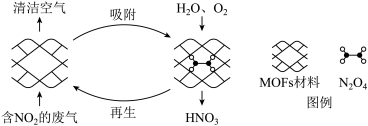
已知: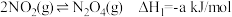

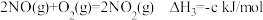
(1)请从温度和压强两个角度分析利于NO2吸附的条件_______ 。
(2)①当10 g材料吸附NO2到质量不再发生变化时,下列_______ 也能说明吸附反应已达到极限。
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=_______ 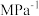 。
。
(3)由N2O4转化生成HNO3的热化学反应方程式_______ 。
Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。
(4)利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.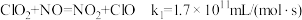
b.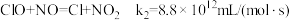
c.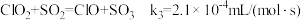
d.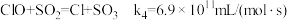
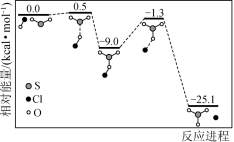
①反应d的历程如下图所示。该历程中最大活化能E正=_______ kJ/mol。
②保持其他条件不变,随着 的增加,SO2脱除效率的逐渐增加的原因是
的增加,SO2脱除效率的逐渐增加的原因是_______ 。
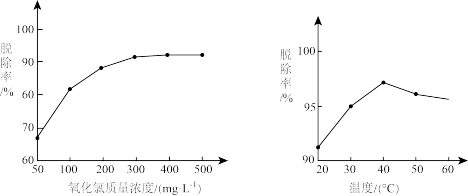
(5)利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是_______ 。
I.某MOFs多孔材料孔径大小和形状恰好将N2O4 “固定”,能高效选择性吸附NO2。
废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3。原理示意图如下:

已知:
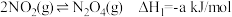

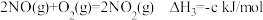
(1)请从温度和压强两个角度分析利于NO2吸附的条件
(2)①当10 g材料吸附NO2到质量不再发生变化时,下列
A.颜色不再发生变化 B.n(NO2):n(N2O4)=2:1
C.2v正(NO2)=v逆(N2O4) D.混合气体的平均分子质量不再发生变化
②当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0 MPa,混合气体平均相对分子质量为69,吸附反应的Kp=
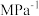 。
。(3)由N2O4转化生成HNO3的热化学反应方程式
Ⅱ.ClO2可对烟气中NO、SO2进行协同脱除。
(4)利用 ClO2气体脱硫脱硝的过程中涉及的部分反应及速率常数如下:
a.
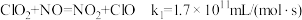
b.
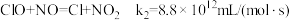
c.
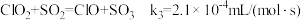
d.
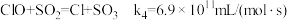
①反应d的历程如下图所示。该历程中最大活化能E正=

②保持其他条件不变,随着
 的增加,SO2脱除效率的逐渐增加的原因是
的增加,SO2脱除效率的逐渐增加的原因是(5)利用 ClO2溶液脱硫脱硝的过程中,ClO2质量浓度和溶液温度对NO脱除率的影响如下图所示,则最佳的质量浓度和溶液温度是

您最近一年使用:0次



