名校
1 . 某温度下,在2 L的密闭容器中,充入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)⇌4C(s)+2D(g),反应一段时间达到平衡,测得生成1.6 mol C,则下列说法正确的是
| A.增大压强,平衡向逆反应方向移动 |
B.达平衡后B的转化率为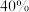 |
| C.增加A,平衡正向移动,化学平衡常数增大 |
| D.若升高温度,A的转化率增大,则该反应∆H<0 |
您最近一年使用:0次
2021-11-18更新
|
691次组卷
|
8卷引用:黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题
黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题黑龙江省肇东市第四中学2021-2022学年高三12月月考化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题天津市和平区2021~2022学年高三上学期期末考试化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)江西省赣州市2022-2023学年高三上学期期末考试化学试题天津市第一中学2023-2024学年高二上学期10月月考化学试题
解题方法
2 . 漂白粉和明矾是抗拒疫情的必需物资。请按要求,回答下列问题:
(1)实验室制取氯气的离子方程式:___ 。
(2)工业上制备漂白粉的化学方程式为___ 。
(3)漂白粉溶于水有杀菌消毒作用,其原理是(用化学方程式表示)___ 。
(4)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是___ 。如果用新制氯水漂白,为了增强漂白能力,可加入少量的物质是___ 。(填字母)
A.食醋 B.食盐 C.石灰石 D.纯碱
(1)实验室制取氯气的离子方程式:
(2)工业上制备漂白粉的化学方程式为
(3)漂白粉溶于水有杀菌消毒作用,其原理是(用化学方程式表示)
(4)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是
A.食醋 B.食盐 C.石灰石 D.纯碱
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
3 . 工业上常用还原沉淀法处理含铬废水(Cr2O 和CrO
和CrO ),其流程如下:
),其流程如下:
CrO (黄色)
(黄色)  Cr2O
Cr2O (橙色)
(橙色)  Cr3+(绿色)
Cr3+(绿色)  Cr(OH)3↓
Cr(OH)3↓
已知步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
下列有关说法不正确的是
 和CrO
和CrO ),其流程如下:
),其流程如下:CrO
 (黄色)
(黄色)  Cr2O
Cr2O (橙色)
(橙色)  Cr3+(绿色)
Cr3+(绿色)  Cr(OH)3↓
Cr(OH)3↓已知步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。下列有关说法不正确的是
A.步骤①中当v正(CrO )=2v逆(Cr2O )=2v逆(Cr2O )时,说明反应2CrO )时,说明反应2CrO +2H+ +2H+ Cr2O Cr2O +H2O达到平衡状态 +H2O达到平衡状态 |
| B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色 |
C.步骤②中,若要还原1 mol Cr2O ,需要12 mol(NH4)2Fe(SO4)2 ,需要12 mol(NH4)2Fe(SO4)2 |
| D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽[当溶液中c(Cr3+)≤10-5mol·L-1时,可视作该离子沉淀完全] |
您最近一年使用:0次
2021-10-20更新
|
297次组卷
|
3卷引用:黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题
黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题(已下线)专题八 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)河北省承德隆化存瑞中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
4 . 有“退热冰”之称的乙酰苯胺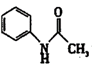 具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(
具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(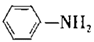 )和乙酸反应(该反应是放热反应)制得。
)和乙酸反应(该反应是放热反应)制得。
已知:
1.苯胺在空气中易被氧化。
2.可能用到的有关性质如下:
Ⅰ.制备乙酰苯胺的实验步骤如下:
步骤1:在制备装置加入9.2mL苯胺、17.4mL冰醋酸、0.1g锌粉及少量水。
步骤2:小火加热回流1h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),用滤液洗涤晶体2~3次。
请回答下列问题:
(1)写出制备乙酰苯胺的化学方程式___ 。
(2)将三种试剂混合时,最后加入的试剂是___ ,这样做的原因是:___ 。
(3)步骤2:小火加热回流1h,装置如图所示。请回答下列问题:
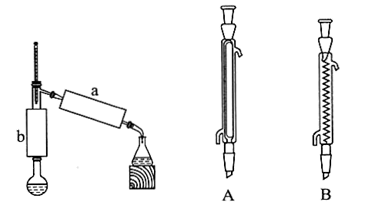
①b处使用的仪器为___ (填“A”或“B”),该仪器的名称是___ 。
②得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是___ 。
Ⅱ.实验小组通过控制反应温度,测得不同温度下产品的平衡产率如图所示:

(4)从图中可知,反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因可能是:___ 。
(5)①该实验最终得纯品10.8g,则乙酰苯胺的产率是___ 。(精确到小数点后1位)
②导致实际值低于理论值的原因可能是___ (填字母标号)。
A.没有等充分冷却就开始过滤
B.抽滤后没有把滤液合并在一起
C.乙酰苯胺中的乙酸未除干净
 具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(
具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺(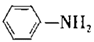 )和乙酸反应(该反应是放热反应)制得。
)和乙酸反应(该反应是放热反应)制得。已知:
1.苯胺在空气中易被氧化。
2.可能用到的有关性质如下:
| 名称 | 相对分子质量 | 性状 | 密度/g∙cm3 | 熔点/℃ | 沸点/℃ | 溶解度 | |
| g/100g水 | g/100g乙醇 | ||||||
| 苯胺 | 93 | 棕黄色油状液体 | 1.02 | -6.3 | 184 | 微溶 | ∞ |
| 冰醋酸 | 60 | 无色透明液体 | 1.05 | 16.6 | 117.9 | ∞ | ∞ |
| 乙酰苯胺 | 135 | 无色片状晶体 | 1.21 | 155~156 | 280~290 | 温度高,溶解度大 | 较水中大 |
步骤1:在制备装置加入9.2mL苯胺、17.4mL冰醋酸、0.1g锌粉及少量水。
步骤2:小火加热回流1h。
步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),用滤液洗涤晶体2~3次。
请回答下列问题:
(1)写出制备乙酰苯胺的化学方程式
(2)将三种试剂混合时,最后加入的试剂是
(3)步骤2:小火加热回流1h,装置如图所示。请回答下列问题:

①b处使用的仪器为
②得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是
Ⅱ.实验小组通过控制反应温度,测得不同温度下产品的平衡产率如图所示:

(4)从图中可知,反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因可能是:
(5)①该实验最终得纯品10.8g,则乙酰苯胺的产率是
②导致实际值低于理论值的原因可能是
A.没有等充分冷却就开始过滤
B.抽滤后没有把滤液合并在一起
C.乙酰苯胺中的乙酸未除干净
您最近一年使用:0次
12-13高二上·江苏盐城·期末
名校
5 . 25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)  Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
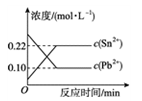
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| C.25 ℃时,该反应的平衡常数K=2.2 |
| D.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
您最近一年使用:0次
2017-11-07更新
|
480次组卷
|
47卷引用:黑龙江省大庆市实验中学2021-2022学年高三上学期开学考试化学试题
黑龙江省大庆市实验中学2021-2022学年高三上学期开学考试化学试题(已下线)2013届甘肃省永昌县第一中学高三上学期期中考试化学试卷(已下线)2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(已下线)2013-2014福建省厦门双十中学高三热身考试化学试卷(已下线)2015届福建省福州第八中学高三上学期第二次质量检查化学试卷2015届上海理工大学附中高三上学期月考化学试卷2016届河北省行唐启明中学高三上学期12月月考化学试卷2016届江西省宜春市奉新县第一中学高三上第五次月考化学试卷2016届河南省三门峡市陕州中学高三下尖子生专题训练(三)理综化学试卷2016届山西省平遥中学高三第二轮训练三化学试卷(已下线)2011-2012学年江苏省射阳中学高二上学期期末考试化学(选修)试卷(已下线)2011-2012学年天津一中高二上学期期中考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二第三学段考试化学试卷(已下线)2011-2012学年浙江省金华一中高二下学期期中考试化学试卷(已下线)2011-2012学年海南省海南中学高二上学期期末考试理科化学试卷(已下线)2011-2012学年天津市天津一中高二上学期期中考试化学试卷(已下线)2011-2012学年江西省南昌三中高二上学期期中考试化学试卷(已下线)2012-2013学年福建德化三中高二上学期第二次月考理科化学试卷(已下线)2013-2014学年湖北省部分重点中学高二上学期期末考试化学试卷(已下线)2013-2014吉林省吉林一中高一下学期期末考试化学试卷2014-2015学年甘肃省武威市六中高二上学期期中化学(理)试卷2015-2016湖南省衡阳四中高二12月学科联赛化学试卷2015-2016湖南省衡阳县四中高二12月学科联赛化学试卷2014-2015广东省揭阳市第一中学高二上学期期末考试化学理试卷2014-2015学年福建省晋江市平山中学高二下学期期中考试化学试卷2014-2015学年湖北省老河口市第二中学高二下学期期末化学试卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高二上期末化学卷2015-2016学年湖南省醴陵二中、四中高二上学期期末化学试卷2015-2016学年内蒙古包头九中高一下期末化学试题2016-2017学年河北冀州市中学高二上开学调研化学卷2016-2017学年河南省师大附中高二上期中化学试卷2016-2017学年河北省冀州中学高二上期中化学卷2016-2017学年辽宁省瓦房店市高级中学高二上10月月考化学试卷甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题天津市红桥区2017-2018学年高二上学期期中考试化学试题甘肃省民乐县第一中学2017-2018学年高二上学期期中考试化学试题江西省南昌市第二中学2017-2018学年高二上学期第三次月考化学试题四川省眉山市眉山中学2018-2019学年高二上学期10月月考理科综合化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二上学期期中考试化学试题2【全国百强校】吉林省延边市第二中学2018-2019学年高二下学期开学考试化学试题吉林省吉化第一高级中学校2019-2020学年高二9月月考化学试题河南省南阳市2018-2019学年高二上学期期中质量评估化学试题湖南省长沙市天心区雅礼中学2018-2019学年高二下学期期末考试化学试题吉林省汪清县第六中学2020-2021学年高二上学期期中考试化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题湖北省咸宁市通城二中2020-2021学年度高二上学期期中考试化学试题



