1 . CO与H2S按体积比1∶2在容积不变的密闭容器中发生如下反应并达到平衡: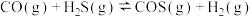 。下列说法正确的是
。下列说法正确的是
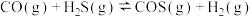 。下列说法正确的是
。下列说法正确的是| A.通入H2S后,正反应速率逐渐增大 |
| B.升高温度后,CO的浓度增大,表明该反应吸热 |
| C.CO和H2S体积比不变时说明反应达到平衡状态 |
| D.选用合适的催化剂,可提高CO的平衡转化率 |
您最近一年使用:0次
2 .  是一种重要的盐,其水溶液中存在平衡:
是一种重要的盐,其水溶液中存在平衡: 。下列说法
。下列说法不正确 的是
 是一种重要的盐,其水溶液中存在平衡:
是一种重要的盐,其水溶液中存在平衡: 。下列说法
。下列说法A. 溶液中加入淀粉溶液,溶液显蓝色 溶液中加入淀粉溶液,溶液显蓝色 |
B. 溶液呈棕褐色溶液,加入 溶液呈棕褐色溶液,加入 后,振荡,上层溶液显紫红色 后,振荡,上层溶液显紫红色 |
C. 溶液中滴加少量 溶液中滴加少量 溶液,溶液酸性增强 溶液,溶液酸性增强 |
D.利用 溶液可以除去硫粉中的少量碘单质 溶液可以除去硫粉中的少量碘单质 |
您最近一年使用:0次
名校
解题方法
3 . 丙烯是一种重要的化工原料,在催化剂作用下,可以由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):

反应Ⅱ(氧化脱氢):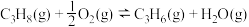

反应Ⅲ(氢气燃烧):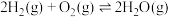
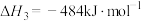
(1)
_____ kJ/mol。
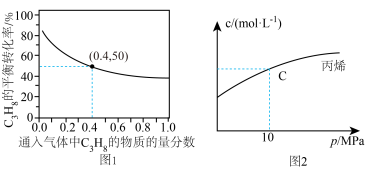
(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1
①结合图1,从平衡移动的角度分析,“通入Ar”的作用是_____ 。
②若要将 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
_____ 。
(3)恒温条件下,测得反应Ⅰ平衡时 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时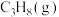 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线_____ 。(在图中C点平衡总压为10Mpa时,丙烷和丙烯的物质的浓度相等)。
(4)①关于反应Ⅲ,下列说法正确的是_____ 。
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高 的转化率
的转化率
②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是_____ 。
(5)研究表明, 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
下列说法不正确的是_____。
反应Ⅰ(直接脱氢):


反应Ⅱ(氧化脱氢):
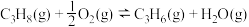

反应Ⅲ(氢气燃烧):
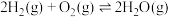
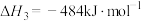
(1)

(2)对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入
 和Ar的混合气体。在温度为
和Ar的混合气体。在温度为 时,
时, 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图1
的物质的量分数的关系如图1①结合图1,从平衡移动的角度分析,“通入Ar”的作用是
②若要将
 的平衡转化率提高到60%,则
的平衡转化率提高到60%,则
(3)恒温条件下,测得反应Ⅰ平衡时
 的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时
的物质的量浓度与平衡总压的关系如图2.请在图上画出平衡时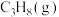 的物质的量浓度随平衡总压变化的曲线
的物质的量浓度随平衡总压变化的曲线(4)①关于反应Ⅲ,下列说法正确的是
A.该反应在任何温度下都能自发进行
B.升高温度,反应Ⅱ的平衡常数增大
C.通入的氧气越多,越有利于丙烷的氧化脱氢
D.将水液化分离出来,既可以加快反应速率,又能提高
 的转化率
的转化率②与直接脱氢反应相比,氧化脱氢制备丙烯的优点是
(5)研究表明,
 可催化氧化
可催化氧化 脱氢制丙烯。在p=0.1MPa,
脱氢制丙烯。在p=0.1MPa, ,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:
,催化剂X的催化下,气体按一定流速通过反应器,丙烷转化率和产物选择性(丙烯的选择性=丙烯的产率÷丙烷的转化率×100%)随温度变化如下表:| t℃ | 丙烷转化率 | 产物的选择性 | ||
 |  | CO | ||
| 400 | 4.06 | 93.12 | 2.20 | 4.68 |
| 500 | 12.32 | 91.23 | 3.16 | 5.61 |
| 600 | 35.22 | 85.44 | 7.73 | 6.83 |
| A.在较高温度下,催化剂X可提高产生丙烯反应的速率 |
B. 催化氧化 催化氧化 脱氢制丙烯的反应是放热反应 脱氢制丙烯的反应是放热反应 |
| C.相同条件下,使用不同的催化剂,丙烷的平衡转化率相同 |
| D.温度升高,催化剂X的活性下降,丙烯的产率降低 |
您最近一年使用:0次
2023-12-05更新
|
220次组卷
|
4卷引用:浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题
浙江省稽阳联谊学校2023-2024学年高三上学期联考化学试题浙江省宁波市2023-2024学年高二上学期九校联考化学试题(已下线)专题10 化学反应原理综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)河南省焦作市博爱县第一中学2023-2024学年高二上学期1月期末化学试题
4 . 某兴趣小组用淀粉水解液和浓 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展了实验(夹持仪器已省略):
,按如下流程开展了实验(夹持仪器已省略):
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式: (
( 作催化剂)。
作催化剂)。
请回答:
(1)图1装置中仪器乙的名称___________ 。若C烧杯中盛放足量氢氧化钠溶液,写出C中发生反应的离子方程式___________ (假设气体全部被吸收),除了氢氧化钠溶液,还可以选用___________ (至少写出两种溶液)。
(2)下列有关操作说法不正确 的是___________。
(3)步骤Ⅳ中离心分离后得到的滤液中加入氨水还会析出产品沉淀,请结合离子方程式和平衡移动原理加以解释___________ 。
(4)草酸晶体 含有结晶水,某同学通过如下实验测定其组成:
含有结晶水,某同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液:称取一定质量氢氧化钠固体,用适量水溶解后,选择合适的操作并排序(步骤可重复使用),配制溶液:___________
a→b→(___________)→(___________)→f→d→(___________)→(___________)→h
a.检查容量瓶玻璃塞处是否漏水b.将烧杯中的液体全部转移到容量瓶中
c.用蒸馏水洗涤烧杯和玻璃棒2-3次d.加蒸馏水至容量瓶接近标线
e.盖好瓶塞,反复上下颠倒容量瓶f.轻轻摇动容量瓶
g.离刻度线 时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中
,则该滴定法测得产品中 的值
的值___________ (填“偏大”“偏小”“无影响”)。
 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展了实验(夹持仪器已省略):
,按如下流程开展了实验(夹持仪器已省略):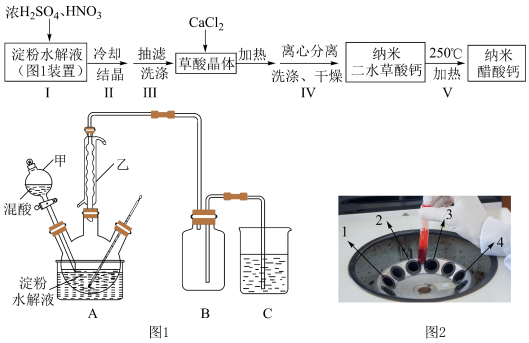
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式:
 (
( 作催化剂)。
作催化剂)。请回答:
(1)图1装置中仪器乙的名称
(2)下列有关操作说法
| A.步骤Ⅱ采取冷却结晶,以防止草酸晶体失水 |
| B.步骤Ⅲ洗涤可用乙醇水溶液,步骤IV洗涤可用蒸馏水洗涤 |
C.步骤Ⅴ采用 加热,为提高反应速率,也可采用更高温度加热 加热,为提高反应速率,也可采用更高温度加热 |
| D.步骤Ⅳ采用离心分离,装置如图2所示,操作时应将两支离心管放置于1、4处 |
(3)步骤Ⅳ中离心分离后得到的滤液中加入氨水还会析出产品沉淀,请结合离子方程式和平衡移动原理加以解释
(4)草酸晶体
 含有结晶水,某同学通过如下实验测定其组成:
含有结晶水,某同学通过如下实验测定其组成:①配制标准氢氧化钠溶液:称取一定质量氢氧化钠固体,用适量水溶解后,选择合适的操作并排序(步骤可重复使用),配制溶液:
a→b→(___________)→(___________)→f→d→(___________)→(___________)→h
a.检查容量瓶玻璃塞处是否漏水b.将烧杯中的液体全部转移到容量瓶中
c.用蒸馏水洗涤烧杯和玻璃棒2-3次d.加蒸馏水至容量瓶接近标线
e.盖好瓶塞,反复上下颠倒容量瓶f.轻轻摇动容量瓶
g.离刻度线
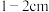 时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签
时,改用胶头滴管加水至凹液面与刻度线相切h.装瓶贴标签②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述
 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中
,则该滴定法测得产品中 的值
的值
您最近一年使用:0次
2023-10-09更新
|
214次组卷
|
4卷引用:浙江省强基联盟2023-2024学年高三上学期10月联考化学试题
浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题09 化学实验综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)T20-实验综合题
解题方法
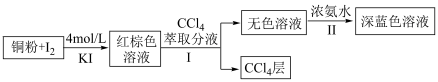
5 . 某小组设计实验探究铜被碘氧化的产物及铜元素的价态。 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色);
②铜元素被氧化可能存在的形式有 (蓝色)、
(蓝色)、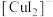 (无色);
(无色);
③ (无色),易被空气氧化。
(无色),易被空气氧化。
请回答:
(1)步骤Ⅰ中加入 萃取分液的目的是
萃取分液的目的是___________ 。
(2)用离子方程式表示步骤Ⅱ中发生的反应___________ 。
(3)已知 为白色不溶于水的固体,向
为白色不溶于水的固体,向 中加入浓
中加入浓 溶液,现象为
溶液,现象为___________ 。
(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因___________ 。
(已知: 稳定性远大于
稳定性远大于 (黄色),
(黄色), 稳定指的是不易发生解离反应
稳定指的是不易发生解离反应 )
)
(5) 层呈
层呈___________ 色。如何设计实验将 层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将
层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将 层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,
层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,___________ 。请补充完实验操作中涉及的离子方程式: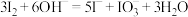 ,
,___________ 。
 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色);②铜元素被氧化可能存在的形式有
 (蓝色)、
(蓝色)、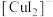 (无色);
(无色);③
 (无色),易被空气氧化。
(无色),易被空气氧化。请回答:
(1)步骤Ⅰ中加入
 萃取分液的目的是
萃取分液的目的是(2)用离子方程式表示步骤Ⅱ中发生的反应
(3)已知
 为白色不溶于水的固体,向
为白色不溶于水的固体,向 中加入浓
中加入浓 溶液,现象为
溶液,现象为(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因
(已知:
 稳定性远大于
稳定性远大于 (黄色),
(黄色), 稳定指的是不易发生解离反应
稳定指的是不易发生解离反应 )
)(5)
 层呈
层呈 层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将
层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将 层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,
层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,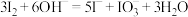 ,
,
您最近一年使用:0次
2023-10-09更新
|
232次组卷
|
4卷引用:浙江省强基联盟2023-2024学年高三上学期10月联考化学试题
浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题08 工艺流程综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
6 . 现在生活对水质要求越来越高,水质检测指标项目也进行了相应的增加,水质检测方法也得到了发展。
Ⅰ.水质化学需氧量(COD)是指在一定条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量。常用强氧化剂重铬酸钾工业上由铬铁矿(主要成分为 、
、 等)制备,制备流程如图所示:
等)制备,制备流程如图所示:

已知步骤①的主要反应为:

(1)下列说法不正确 的是__________。
(2)步骤④调 有利于
有利于 生成,请结合离子方程式用平衡移动原理解释
生成,请结合离子方程式用平衡移动原理解释____________________ 。
Ⅱ.水的硬度最初是指钙、镁离子沉淀肥皂的能力,水的总硬度指水中钙、镁离子的总浓度。测定水的总硬度一般采用配位滴定法,即在 的氨缓冲溶液中,以铬黑
的氨缓冲溶液中,以铬黑 作为指示剂,用EDTA(乙二胺四乙酸二钠,
作为指示剂,用EDTA(乙二胺四乙酸二钠, )标准溶液直接滴定水中的
)标准溶液直接滴定水中的 、
、 ,测定中涉及的反应有:
,测定中涉及的反应有:
① (蓝色)
(蓝色) (酒红色)
(酒红色)
② (金属离子
(金属离子 、
、 )
) (无色)
(无色)
③
(3)下列说法正确的是__________ 。
A.配合物 的稳定性大于
的稳定性大于
B.在滴定过程中眼睛要随时观察滴定管中液面的变化
C.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.实验时盛EDTA标准液的滴定管用蒸馏水洗涤后未用标准液润洗,测定结果将偏小
E.滴定前尖嘴内有气泡,滴定后无气泡,测定结果将偏大
(4)滴定终点的判断_________________________ 。
(5)取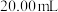 水样,用
水样,用 标准溶液滴定至终点,消耗EDTA溶液
标准溶液滴定至终点,消耗EDTA溶液 。则水的总硬度为
。则水的总硬度为_________  。
。
Ⅰ.水质化学需氧量(COD)是指在一定条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量。常用强氧化剂重铬酸钾工业上由铬铁矿(主要成分为
 、
、 等)制备,制备流程如图所示:
等)制备,制备流程如图所示:
已知步骤①的主要反应为:

(1)下列说法
A.步骤①反应中 和 和 为氧化产物 为氧化产物 |
| B.步骤①熔融、氧化可以在石英坩埚中进行 |
C.滤渣2中含有 和 和 |
D.步骤⑤利用了相同温度下 溶解度小的原理 溶解度小的原理 |
 有利于
有利于 生成,请结合离子方程式用平衡移动原理解释
生成,请结合离子方程式用平衡移动原理解释Ⅱ.水的硬度最初是指钙、镁离子沉淀肥皂的能力,水的总硬度指水中钙、镁离子的总浓度。测定水的总硬度一般采用配位滴定法,即在
 的氨缓冲溶液中,以铬黑
的氨缓冲溶液中,以铬黑 作为指示剂,用EDTA(乙二胺四乙酸二钠,
作为指示剂,用EDTA(乙二胺四乙酸二钠, )标准溶液直接滴定水中的
)标准溶液直接滴定水中的 、
、 ,测定中涉及的反应有:
,测定中涉及的反应有:①
 (蓝色)
(蓝色) (酒红色)
(酒红色)②
 (金属离子
(金属离子 、
、 )
) (无色)
(无色)③

(3)下列说法正确的是
A.配合物
 的稳定性大于
的稳定性大于
B.在滴定过程中眼睛要随时观察滴定管中液面的变化
C.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.实验时盛EDTA标准液的滴定管用蒸馏水洗涤后未用标准液润洗,测定结果将偏小
E.滴定前尖嘴内有气泡,滴定后无气泡,测定结果将偏大
(4)滴定终点的判断
(5)取
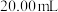 水样,用
水样,用 标准溶液滴定至终点,消耗EDTA溶液
标准溶液滴定至终点,消耗EDTA溶液 。则水的总硬度为
。则水的总硬度为 。
。
您最近一年使用:0次
名校
7 . 密闭容器中发生反应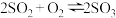
 ,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。下列说法错误的是
,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。下列说法错误的是

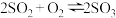
 ,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。下列说法错误的是
,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。下列说法错误的是
A. 时刻改变的条件为升温 时刻改变的条件为升温 |
B. 时刻改变的条件为使用催化剂 时刻改变的条件为使用催化剂 |
C. 的百分含量最高的时间段是 的百分含量最高的时间段是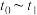 |
D.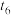 时刻从反应体系中分离出部分 时刻从反应体系中分离出部分 , , 、 、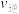 立刻减小,且 立刻减小,且 |
您最近一年使用:0次
2023-09-06更新
|
259次组卷
|
2卷引用:浙江省舟山中学2023-2024学年高二上学期10月月考化学试题
8 . 下列方案设计、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 检验铜和浓硫酸反应之后是否有酸剩余 | 取少量反应后的溶液于试管中,依次加入盐酸和BaCl2溶液 | 若出现白色沉淀,则硫酸剩余 |
| B | 探究淀粉在酸性条件下的水解程度 | 取少量淀粉溶液,加入适量稀硫酸加热5min后,再加NaOH中和硫酸,最后滴加碘水 | 溶液无明显现象,则淀粉完全水解 |
| C | 比较CH3COOH和HClO的酸性强弱 | 相同条件下分别用pH试纸测定0.1mol•L-1CH3COONa溶液、0.1mol•L-1NaClO溶液的pH | NaClO溶液pH>CH3COONa溶液的pH,证明CH3COOH的酸性比HClO的酸性强 |
| D | 探究浓度对化学平衡的影响 | 在4mL0.1mol•L-1K2Cr2O7溶液中加入数滴1mol•L-1NaOH溶液 | 若溶液由橙色变为黄色,则H+浓度减小,Cr2O +H2O +H2O 2CrO 2CrO +2H+平衡正移 +2H+平衡正移 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 氯化钠是高中化学中常见的试剂,下列说法不正确 的是
A.基态 原子的电子排布式 原子的电子排布式 |
B. 可用于制取 可用于制取 |
C.生铁置于 溶液中发生析氢腐蚀 溶液中发生析氢腐蚀 |
D. 可降低 可降低 在水中的溶解度 在水中的溶解度 |
您最近一年使用:0次
2023-05-27更新
|
64次组卷
|
2卷引用:浙江省部分校2022-2023学年高二下学期5月份联考化学试题
名校
10 . 下列说法正确的是
A.恒温恒容下, ,当混合气体的密度不再发生变化时,能表明该反应达到平衡状态 ,当混合气体的密度不再发生变化时,能表明该反应达到平衡状态 |
B.恒温恒容下, 达到平衡,移走部分N,平衡向正反应方向移动 达到平衡,移走部分N,平衡向正反应方向移动 |
C.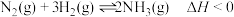 ,反应达至平衡后,升温,则反应速率 ,反应达至平衡后,升温,则反应速率 和 和 的平衡转化率均增大 的平衡转化率均增大 |
D.实验室制氢气,为了加快反应速率,可在稀硫酸中加少量 固体 固体 |
您最近一年使用:0次
2023-02-24更新
|
219次组卷
|
2卷引用:浙江省嘉兴高级中学2023-2024学年高二上学期第二次教学调研(12月)化学试题



