名校
1 . 一定温度下,在3个体积均为1.0L的恒容密闭容器中反应: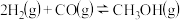 ,达到平衡,下列说法不正确的是。
,达到平衡,下列说法不正确的是。
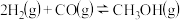 ,达到平衡,下列说法不正确的是。
,达到平衡,下列说法不正确的是。| 容器 | 温度/K | 物质的起始浓度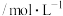 | 物质的平衡浓度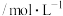 | ||
 | 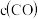 | 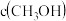 | 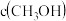 | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A.该反应的正反应为放热反应 |
| B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 |
C.达到平衡时,容器Ⅱ中 大于容器Ⅲ中 大于容器Ⅲ中 的两倍 的两倍 |
| D.达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
您最近一年使用:0次
2021-12-07更新
|
345次组卷
|
2卷引用:河北省邢台市四校联盟2021-2022学年高三12月联考化学试题
名校
2 . 一定温度下将CaCO3放入密闭真空容器中,反应CaCO3(s) CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
 CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是| A.平衡向左移动 | B.压强不变 |
| C.平衡常数不变 | D.固体总质量不变 |
您最近一年使用:0次
2020-04-28更新
|
297次组卷
|
4卷引用:广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题
广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】山东省日照市2018-2019学年高二上学期期末模块考试化学试题(已下线)2021年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷01
名校
解题方法
3 . 反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确 的是
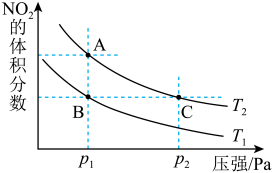
 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
| A.A点的反应速率小于C点的反应速率 |
| B.A、C两点气体的颜色:A浅,C深 |
| C.由状态B到状态A,可以用降温的方法 |
| D.A、C两点气体的平均相对分子质量:A<C |
您最近一年使用:0次
2020-04-02更新
|
1051次组卷
|
9卷引用:黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题
黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题河北省沧州市河间市第四中学2019-2020学年高二下学期期末模拟考试化学试卷黑吉两省十校2020-2021学年高二上学期期中联考(吉雅2校用)化学试题湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题山东省新泰市第一中学2022-2023学年高二上学期期中考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题
名校
4 . 一定温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:PCl5 (g)  PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是
 PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是| 容器编号 | 物质的起始浓度/(mol·L-1) | 物质的平衡浓度/(mol·L-1) | ||
 | 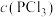 | 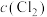 | 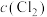 | |
| Ⅰ | 0.4 | 0 | 0 | 0.2 |
| Ⅱ | 0.6 | 0 | 0.2 | |
| Ⅲ | 0.8 | 0 | 0 | |
A.反应达到平衡时,容器I中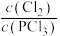 比容器Ⅱ中的小 比容器Ⅱ中的小 |
| B.反应达到平衡时,容器I与容器Ⅱ中的总压强之比为3︰4 |
C.反应达到平衡时,容器Ⅲ中 的体积分数小于 的体积分数小于 |
| D.反应达到平衡时,容器Ⅲ中0.4mol/L<c(PCl5)<0.8 mol/L |
您最近一年使用:0次
2020-09-29更新
|
725次组卷
|
6卷引用:广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题
5 . 如图,I是恒压密闭容器,II是恒容密闭容器。其它条件相同时,在I、II中分n别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)⇌aZ(g)。此时I中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
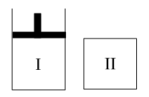

| A.若X、Y均为气态,则平衡时气体平均摩尔质量:II>I, |
| B.若X、Y不均为气态,则平衡时气体平均摩尔质量:I>II |
| C.若X为固态,Y为气态,则I、II中从起始到平衡所需时间相同 |
| D.平衡时I容器的体积小于VL |
您最近一年使用:0次
解题方法
6 . 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和催化剂的条件下,两容器中各自发生下列反应
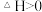 ;达到平衡时,VA=1.2aL,则下列说法不正确的是
;达到平衡时,VA=1.2aL,则下列说法不正确的是

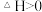 ;达到平衡时,VA=1.2aL,则下列说法不正确的是
;达到平衡时,VA=1.2aL,则下列说法不正确的是
| A.反应开始时,B容器中化学反应速率快 |
| B.A容器中X的转化率为40%,且比B容器中X的转化率大 |
| C.打开K一段时间达平衡时,A的体积为2.4aL(连通管中气体体积不计) |
| D.打开K达新平衡后,升高B容器温度,A容器体积会增大 |
您最近一年使用:0次
2021-02-07更新
|
315次组卷
|
5卷引用:浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题
浙江省宁波市九校2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00008(已下线)【浙江新东方】高中化学20210304-010(已下线)期中考试模拟试题(一)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)四川省成都金苹果锦城第一中学2023-2024学年高二上学期期中考试化学试题
名校
7 . 只知某反应向正反应方向移动,下列说法不正确 的是
①反应物转化率必定增加;②生成物的浓度必定增加;③反应物的浓度必定降低;④生成物的质量必定减少
①反应物转化率必定增加;②生成物的浓度必定增加;③反应物的浓度必定降低;④生成物的质量必定减少
| A.只有①② | B.只有①②③ | C.只有③④ | D.①②③④ |
您最近一年使用:0次
2020-11-23更新
|
569次组卷
|
6卷引用:第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)
(已下线)第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)浙江省平阳县万全综合高级中学2021-2022学年高二上学期第一次月考化学试题辽宁省庄河市高级中学2021-2022学年高二上学期10月月考化学试题浙江省东阳中学2020-2021学年高二上学期期中考试化学试题黑龙江省龙西北八校联合体2022-2023学年高二上学期第一次月考化学试题吉林省东北师范大学连山实验高中2023-2024学年高二上学期第一次月考化学试题
12-13高三上·黑龙江·阶段练习
名校
解题方法
8 . 如图所示,甲容器容积固定不变,乙容器有可移动的活塞。甲中充入2 mol SO2和l mol O2,乙中充入4 mol SO3和1 mol He,在恒定温度和相同的催化剂条件下,发生如下反应:2SO3 (g) ⇌ 2SO2 (g) + O2 (g)。下列有关说法正确的是


| A.若活塞固定在6处不动,达平衡时甲乙两容器中的压强:P乙=P甲 |
| B.若活塞固定在3处不动,达平衡时甲乙两容器中SO3的浓度:c (SO3) 乙>2c (SO3)甲 |
| C.若活塞固定在3处不动,达平衡时甲乙容两器中SO2的体积分数:ψ (SO2)乙>2ψ (SO2)甲 |
| D.若活塞固定在7处不动,达平衡时两容器中SO2的物质的量分数相等 |
您最近一年使用:0次
2020-09-16更新
|
579次组卷
|
7卷引用:浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题
浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题(已下线)2013届黑龙江省哈三中高三10月月考化学试卷(已下线)2012-2013学年黑龙江省哈三中高二上学期期中考试化学试卷2016届黑龙江省哈尔滨三中高三上学期第二次检测化学试卷黑龙江省哈尔滨市第三中学2019-2020学年高二10月月考化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一次阶段考试化学试题内蒙古赤峰市红山区2021-2022学年高二上学期期末联考化学试题
9 . 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ⇌2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列见表,下列说法错误的是
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3 mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大 |
| B.当混合气体平均相对分子质量为26时说明该反应已达平衡 |
| C.根据表中数据,计算25.0 ℃时分解的浓度平衡常数约为1.6×10-8 mol3/L3 |
| D.若保持温度和容器体积不变,平衡后再充入n(NH3)∶n(CO2)=2∶1,则再次达到平衡时c(NH3)不变 |
您最近一年使用:0次
2021-04-07更新
|
440次组卷
|
3卷引用:广西南宁市第三中学2020-2021学年高二下学期第一次月考化学(理)试题
名校
10 . 温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)  x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是

 x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
| A.x可能为4 |
| B.M为容器甲 |
| C.容器乙达平衡时B的转化率为25% |
| D.M的平衡常数大于N |
您最近一年使用:0次
2019-09-04更新
|
247次组卷
|
3卷引用:四川省绵阳市南山中学双语学校2020-2021学年高二下学期6月月考化学试题



