浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题
浙江
高二
期中
2020-04-06
380次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、化学反应原理、物质结构与性质
浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题
浙江
高二
期中
2020-04-06
380次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、化学反应原理、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
解题方法
1. 下列有关物质的用途,说法错误的是
| A.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
| B.漂白粉可用于生活用水的消毒 |
| C.二氧化碳可用作镁燃烧的灭火剂 |
| D.Ba2+浓度较高时危害健康,但BaS04可服入体内,作为造影剂用于X射线检查胃肠道疾病 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 下列化学用语正确的是
A.水分子的比例模型:  | B.二氧化硅的分子式:SiO2 |
| C.次氯酸的结构式:H-Cl-O | D.醋酸在水中的电离方程式:CH3COOH+H2O CH3COO-+H3O+ CH3COO-+H3O+ |
【知识点】 有关粒子结构的化学用语 化学用语综合判断
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
3. 下列图示与操作名称不对应 的是
A.蒸发结晶 | B.定容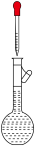 | C.吸收尾气Cl2 | D.蒸馏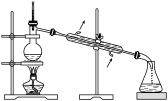 |
【知识点】 仪器使用与实验安全 一定物质的量浓度的溶液的配制 常用仪器及使用解读
您最近一年使用:0次
2020-04-02更新
|
176次组卷
|
4卷引用:浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题
单选题
|
适中(0.65)
4. 设NA为阿伏加 德罗常数的值,下列说法正确的是
| A.2.8g N2 中含有的共用电子对数为 0.1NA |
| B.常温常压下,124克P4中所含P-P键数目为6 NA |
| C.32克硫单质在足量氧气中燃烧转移电子数为6 NA |
| D.在标准状况下,22.4 L H2O 中含有氧原子数为 NA |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
5. 将11.2 g铁粉投入到盛有100 mL 、3 mol·L-1稀硫酸的烧杯中,4 min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是
| A.v(Fe)=0.5 mol/(L·min) | B.v(H2SO4)=1.5 mol/(L·min) |
| C.v(H2SO4)=0.5 mol/(L·min) | D.v(FeSO4)=1 mol/(L·min) |
【知识点】 化学反应的速率 影响化学反应速率的因素
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 结合元素周期表判断下列说法不正确 的是
| A.第117号元素为金属元素 |
| B.第84号及后面元素具有放射性 |
| C.第8号元素的一种氢化物具有强氧化性,无还原性 |
| D.第26号元素的某些化合物可用作净水剂 |
【知识点】 预测元素的性质解读 元素周期律的应用 “位构性”关系理解及应用解读
您最近一年使用:0次
单选题
|
较易(0.85)
7. 关于中和热的测定实验,下列说法正确的是
| A.在实验中,温度计只使用2次 |
| B.为了使反应进行的更完全,可以使酸或碱适当过量 |
| C.中和热为一定值,实验结果与所用酸(碱)的种类和用量均无关 |
| D.用铁丝代替玻璃棒搅拌,会使中和热测定值偏大 |
【知识点】 中和热概念解读 中和热的测定与误差分析解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
8. 已知在 1标准大气压、25℃ 下,1mol 气态 AB 分子生成气态 A 原子和 B 原子的过程中所吸收的能量称为AB间共价键的键能,已知水分子的能量变化关系图如下:

下列说法正确的是

下列说法正确的是
| A.△H1<0,且△H3 <△H4 |
| B.△H4是 O2的键能 |
| C.△H5 =△H1+△H2+△H3+△H4 |
| D.△H3+△H4 >△H5 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
9. 下列离子方程式正确的是
| A.溴化亚铁溶液中通少量的氯气:2Br-+ Cl2=== 2Cl-+ Br2 |
| B.氢氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I- = 2Fe2++I2+6H2O |
| C.碳酸氢钙与少量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| D.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
您最近一年使用:0次
单选题
|
较难(0.4)
解题方法
10. 由O2、NO2 和熔融NaNO3组成的燃料电池如图所示,在该电 池工作过程中石墨I电极产生一种气态氧化物Y。下列说法正确的是
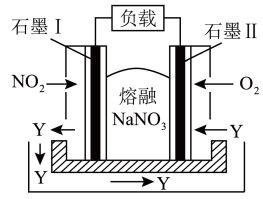

| A.电子由负载流向石墨I |
| B.Y可能为NO |
| C.石墨I上发生还原反应 |
| D.石墨II上的电极反应: O2 + 2N2O5 + 4e- = 4NO3- |
您最近一年使用:0次
单选题
|
较难(0.4)
解题方法
11. 某温度下,在一恒容容器中进行如下反应 A(g)+3B(g)  2C(g),下列情况一定能说明反应已达到平衡的是
2C(g),下列情况一定能说明反应已达到平衡的是
①单位时间内,有1molB反应,同时有2molC生成
②容器内压强不随时间而变化
③单位时间内,有2molC生成,同时有1molA生成
④用 A、B、C表示的该反应的化学反应速率之比为 1∶3∶2
⑤气体的平均摩尔质量不随时间而变化⑥气体的密度不随时间而变化
 2C(g),下列情况一定能说明反应已达到平衡的是
2C(g),下列情况一定能说明反应已达到平衡的是①单位时间内,有1molB反应,同时有2molC生成
②容器内压强不随时间而变化
③单位时间内,有2molC生成,同时有1molA生成
④用 A、B、C表示的该反应的化学反应速率之比为 1∶3∶2
⑤气体的平均摩尔质量不随时间而变化⑥气体的密度不随时间而变化
| A.①④⑥ | B.①②③ | C.①②⑥ | D.②③⑤ |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
解题方法
12. 四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:

①TiO2 (s) + 2Cl2 (g) =TiCl4 (g)+O2 (g) ΔH 1 = +175.4 kJ·mol-1
②C(s) + 1/2O2 (g) = CO (g) ΔH 2 =-110.45 kJ·mol-1
下列说法正确的是

①TiO2 (s) + 2Cl2 (g) =TiCl4 (g)+O2 (g) ΔH 1 = +175.4 kJ·mol-1
②C(s) + 1/2O2 (g) = CO (g) ΔH 2 =-110.45 kJ·mol-1
下列说法正确的是
| A.反应①中的能量变化如右图所示 |
| B.若反应①中使用催化剂加快反应速率,单位时间内吸收更多热量,则ΔH 1变小 |
| C.固体C的燃烧热是-110.45 kJ·mol-1 |
| D.反应TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) ΔH =-45.5 kJ·mol-1 |
您最近一年使用:0次
2020-04-02更新
|
398次组卷
|
2卷引用:浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题
单选题
|
困难(0.15)
名校
13. 某NaAlO2、Na2CO3的混合溶液中逐滴加入 1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。(已知:H2CO3的电离平衡常数K1=4.3×10-7,K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)则下列说法正确的是


| A.V1:V2=1:4 |
| B.M点时生成的CO2为0.05mol |
| C.原混合溶液中的CO32-与AlO2-的物质的量之比为1:3 |
| D.a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O |
您最近一年使用:0次
2020-04-02更新
|
1714次组卷
|
2卷引用:浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题
单选题
|
适中(0.65)
解题方法
14. 取体积均为1 L的四组X的溶液进行实验(X受热发生分解反应),在不同温度下测得X的物质的量(mol)随时间的变化如下表所示。下列说法不正确 的是
| 时间 温度 | 0 min | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min | |
| ① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
| ② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
| ③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
| ④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
| A.在0~10 min内,实验③④中X的转化率相同 |
| B.实验②中改变的条件可能是加入催化剂 |
| C.在10~20 min内,实验①中X的平均分解速率为0.01 mol• L-1•min-1 |
| D.对比实验①和④,能说明X的反应速率随温度升高而增大 |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
15. 下列说法不正确 的是
A.恒温恒容密闭容器中反应:H2NCOONH4(s)  2NH3(g)+CO2(g),混合气体的压强不再改变时说明反应已达平衡 2NH3(g)+CO2(g),混合气体的压强不再改变时说明反应已达平衡 |
B.汽车尾气催化净化时的反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) ΔH < 0 ,平衡常数为K1;若反应在绝热容器中进行,平衡常数为K2;则K1 < K2 N2(g)+2CO2(g) ΔH < 0 ,平衡常数为K1;若反应在绝热容器中进行,平衡常数为K2;则K1 < K2 |
C.某恒容密闭容器中反应:nA(g)+mB(g) pC(g)+qD(g) ΔH > 0已达平衡,则降温时c(B)/c(C)的值增大 pC(g)+qD(g) ΔH > 0已达平衡,则降温时c(B)/c(C)的值增大 |
D.2NO2(g)  N2O4(g)在常温下即可进行,说明正反应是放热反应 N2O4(g)在常温下即可进行,说明正反应是放热反应 |
您最近一年使用:0次
2020-04-02更新
|
681次组卷
|
2卷引用:浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题
单选题
|
适中(0.65)
解题方法
16. 下列化学方程式中,正确的是
| A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.3 kJ·mol-1 |
B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H =-2a kJ·mol-1 2NH3(g) △H =-2a kJ·mol-1 |
| C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式表示为:2H2O(l) =2H2(g)+O2(g) △H =-571.6 kJ·mol-1 |
| D.HCl和NaOH反应中和热△H =-57.3 kJ·mol-1,则CH3COOH和NaOH反应生成1mol水时放出的热量小于57.3KJ |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
解题方法
17. 反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确 的是
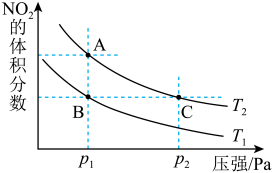
 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
| A.A点的反应速率小于C点的反应速率 |
| B.A、C两点气体的颜色:A浅,C深 |
| C.由状态B到状态A,可以用降温的方法 |
| D.A、C两点气体的平均相对分子质量:A<C |
您最近一年使用:0次
2020-04-02更新
|
1051次组卷
|
9卷引用:浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题
浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题河北省沧州市河间市第四中学2019-2020学年高二下学期期末模拟考试化学试卷黑吉两省十校2020-2021学年高二上学期期中联考(吉雅2校用)化学试题湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题山东省新泰市第一中学2022-2023学年高二上学期期中考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题
单选题
|
困难(0.15)
18. 某溶液X中可能含有下列离子中的若干种:NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-为了确定该溶液的组成,某同学取上述溶液X,进行了如下实验:
(1)向一定量溶液X加入少量氯水,然后滴加淀粉溶液,未显蓝色;
(2)另取100毫升溶液X再加入足量氯水,然后滴加足量BaCl2溶液,得到沉淀6.99g;
(3)将上述(2)的反应混合液过滤,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为2.24L。
根据上述实验,以下推测正确的是
(1)向一定量溶液X加入少量氯水,然后滴加淀粉溶液,未显蓝色;
(2)另取100毫升溶液X再加入足量氯水,然后滴加足量BaCl2溶液,得到沉淀6.99g;
(3)将上述(2)的反应混合液过滤,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为2.24L。
根据上述实验,以下推测正确的是
| A.原溶液可能存在Na +、Fe3+、SO42- |
| B.原溶液一定存在NH4+、I- |
| C.原溶液一定不含Ba2+、Fe3+、I- |
| D.另取X试液滴加足量盐酸酸化的BaCl2溶液,即可确定溶液所有的离子组成 |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
解题方法
19. A、B、C、D、E、F六种短周期元素的原子序数依次增大,元素A的某种核素无中子,B元素的最高正价与最低负价代数和为2,C元素和E元素同主族,且E元素的最高价含氧酸为二元强酸,D元素是同周期元素中离子半径最小的元素。请回答下列问题:
(1)A和B元素组成的化合物B2A4的电子式为_______________ 。
(2)D的最高价氧化物和F的最高价含氧酸反应的离子方程式________________________ 。
(3)C元素和E元素的最低价氢化物的沸点C__________ E(填大于或小于),理由_________ 。
(1)A和B元素组成的化合物B2A4的电子式为
(2)D的最高价氧化物和F的最高价含氧酸反应的离子方程式
(3)C元素和E元素的最低价氢化物的沸点C
您最近一年使用:0次
解答题-无机推断题
|
较难(0.4)
20. 某无机盐X(仅含三种元素,原子个数比为1:1:4,摩尔质量270g·mol-1),为探究其组成和性质,某学习小组进行了如下实验,X与水反应只生成A、B两种物质,其中气体单质 A 能使带火星的木条复燃。下列说法正确的是:

(1)X的组成元素为 O和_____________ (用元素符号表示)。
(2)X 的 化学式为____________ 。
(3)下列说法正确的是(NA为阿伏加 德罗常数)_________ 。
a.酸式盐B的焰色反应颜色可以直接观察
b.盐X中的两种非金属元素所组成的氧化物都能使酸性高锰酸钾溶液褪色
c.1摩尔的固体B中含2NA个离子
d.氮气和气体单质A点燃即可发生反应
(4)X氧化能力极强,可用于脱硫脱硝,写出在碱性条件下X氧化SO32-的离子方程式____________ 。

(1)X的组成元素为 O和
(2)X 的 化学式为
(3)下列说法正确的是(NA为阿伏加 德罗常数)
a.酸式盐B的焰色反应颜色可以直接观察
b.盐X中的两种非金属元素所组成的氧化物都能使酸性高锰酸钾溶液褪色
c.1摩尔的固体B中含2NA个离子
d.氮气和气体单质A点燃即可发生反应
(4)X氧化能力极强,可用于脱硫脱硝,写出在碱性条件下X氧化SO32-的离子方程式
【知识点】 无机综合推断 探究物质组成或测量物质的含量解读
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
解题方法
21. 某化学兴趣小组为了测定某铁碳合金中铁的质量分数,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
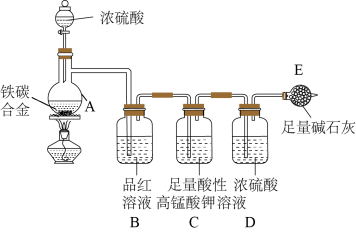
(1)按图示的连接装置,检查装置的气密性并称量E的质量。将10克铁碳合金样品放入A中,再加入适量的浓硫酸,仪器A的名称为_________________ 。未点燃酒精灯前,A、B均无明显现象 。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出A中浓硫酸参与反应的化学方程式__________________ (任写一个)。C装置的作用是 _____________ 。
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________ 。
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重1.1克。则铁碳合金中铁的质量分数为_________________ 。
(5)该装置存在一些缺陷,使得测定结果可能会产生误差,请指出该装置的缺陷__________ 、 __________________________

(1)按图示的连接装置,检查装置的气密性并称量E的质量。将10克铁碳合金样品放入A中,再加入适量的浓硫酸,仪器A的名称为
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出A中浓硫酸参与反应的化学方程式
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重1.1克。则铁碳合金中铁的质量分数为
(5)该装置存在一些缺陷,使得测定结果可能会产生误差,请指出该装置的缺陷
您最近一年使用:0次
三、填空题 添加题型下试题
22. 某镁铝合金MgxAly(其中x、y为整数)是贮氢材料,可在通入氩气的条件下,将一定化学计量比的Al、Mg单质在一定温度下熔炼制得.为测定该合金的成分,称取一定质量的样品放入600mL稀硫酸中,样品全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示.完成下列问题:

(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是_____________ 。
(2)NaOH溶液的物质的量浓度为____________ 。
(3)该镁铝合金(MgxAly)的化学式为_____________ 。
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1,得到的混合物在6.0mol·L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为__________________ 。
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应_____________________ 。
(6)如图甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是_________________ 。
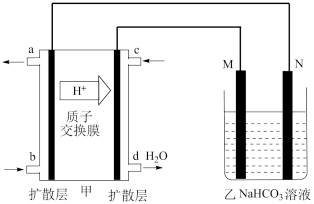

(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是
(2)NaOH溶液的物质的量浓度为
(3)该镁铝合金(MgxAly)的化学式为
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1,得到的混合物在6.0mol·L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应
(6)如图甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是

您最近一年使用:0次
四、解答题 添加题型下试题
解答题-原理综合题
|
困难(0.15)
解题方法
23. 运用化学反应原理研究碳、氮、硫的化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车尾气脱硝脱碳主要原理为2NO(g) + 2CO(g) N2(g) + 2CO2(g) ΔH <0。
N2(g) + 2CO2(g) ΔH <0。
①该反应在______ (填“低温”或“高温”)下可自发反应。
②一定条件下的密闭容器中,充入10 mol CO和8 mol NO, 发生上述反应,如图为平衡时NO的体积分数与温度、压强的关系。

Ⅰ.该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有______ (填字母序号)。
a.缩小容器的体积 b.改用高效催化剂
c.升高温度 d.增加CO的浓度
Ⅱ.压强为10 MPa、温度为T1下,若反应进行到30 min达到平衡状态,容器的体积为4L,该温度下平衡常数Kp=______ (压强以MPa为单位进行计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
③氨气易溶于水可电离出 NH4+和 OH-、易液化,液氨也与水一样发生微弱的双聚电离,但比水弱,能溶解一些金属等性质。下列说法中不正确的是_______
a.NH3可看作比水弱的电解质
b.NH3的双聚电离可表示为:2NH3 NH4++NH2-
NH4++NH2-
c.NH3易溶于水是由于与水形成氢键
d.NH3可与Na 反应: 2NH3+2Na=2NaNH2+H2↑
(2)冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。用活性炭处理工厂尾气中的氮氧化物。
①已知:Ⅰ. 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1=a kJ·mol-1
Ⅱ. 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=b kJ·mol-1
Ⅲ. C(s)+O2(g)=CO2(g) ΔH3=c kJ·mol-1
则反应C(s)+2NO(g) N2(g)+CO2(g)的ΔH =
N2(g)+CO2(g)的ΔH =_____ kJ·mol-1(用a、 b 、c表示)。
②在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g) N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图所示,下列说法正确的是
N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图所示,下列说法正确的是______ 。

a.其他条件不变,容器内压强不再改变时,反应达到平衡状态
b.温度为T2时,若反应体系处于状态D,则此时v正>v逆
c.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
d.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
③已知某温度时,反应C(s)+2NO(g) N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图中画出反应过程中c(NO)随时间t的变化曲线。
N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图中画出反应过程中c(NO)随时间t的变化曲线。

____________
④工业上实际处理废气时,常用活性炭作催化剂,用NH3还原NO,同时通入一定量的O2以提高处理效果。当n(NH3)=n(NO)时,写出体系中总反应的化学方程式:__________________ 。
(1)汽车尾气脱硝脱碳主要原理为2NO(g) + 2CO(g)
 N2(g) + 2CO2(g) ΔH <0。
N2(g) + 2CO2(g) ΔH <0。①该反应在
②一定条件下的密闭容器中,充入10 mol CO和8 mol NO, 发生上述反应,如图为平衡时NO的体积分数与温度、压强的关系。

Ⅰ.该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有
a.缩小容器的体积 b.改用高效催化剂
c.升高温度 d.增加CO的浓度
Ⅱ.压强为10 MPa、温度为T1下,若反应进行到30 min达到平衡状态,容器的体积为4L,该温度下平衡常数Kp=
③氨气易溶于水可电离出 NH4+和 OH-、易液化,液氨也与水一样发生微弱的双聚电离,但比水弱,能溶解一些金属等性质。下列说法中不正确的是
a.NH3可看作比水弱的电解质
b.NH3的双聚电离可表示为:2NH3
 NH4++NH2-
NH4++NH2-c.NH3易溶于水是由于与水形成氢键
d.NH3可与Na 反应: 2NH3+2Na=2NaNH2+H2↑
(2)冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。用活性炭处理工厂尾气中的氮氧化物。
①已知:Ⅰ. 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1=a kJ·mol-1
Ⅱ. 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=b kJ·mol-1
Ⅲ. C(s)+O2(g)=CO2(g) ΔH3=c kJ·mol-1
则反应C(s)+2NO(g)
 N2(g)+CO2(g)的ΔH =
N2(g)+CO2(g)的ΔH =②在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g)
 N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图所示,下列说法正确的是
N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图所示,下列说法正确的是
a.其他条件不变,容器内压强不再改变时,反应达到平衡状态
b.温度为T2时,若反应体系处于状态D,则此时v正>v逆
c.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
d.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
③已知某温度时,反应C(s)+2NO(g)
 N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图中画出反应过程中c(NO)随时间t的变化曲线。
N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图中画出反应过程中c(NO)随时间t的变化曲线。
④工业上实际处理废气时,常用活性炭作催化剂,用NH3还原NO,同时通入一定量的O2以提高处理效果。当n(NH3)=n(NO)时,写出体系中总反应的化学方程式:
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、化学反应原理、物质结构与性质
试卷题型(共 23题)
题型
数量
单选题
18
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 硫、氮氧化物对人体、环境的危害 酸雨 化学科学对人类文明发展的意义 | |
| 2 | 0.65 | 有关粒子结构的化学用语 化学用语综合判断 | |
| 3 | 0.65 | 仪器使用与实验安全 一定物质的量浓度的溶液的配制 常用仪器及使用 | |
| 4 | 0.65 | 阿伏加德罗常数的求算 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 | |
| 5 | 0.65 | 化学反应的速率 影响化学反应速率的因素 | |
| 6 | 0.65 | 预测元素的性质 元素周期律的应用 “位构性”关系理解及应用 | |
| 7 | 0.85 | 中和热概念 中和热的测定与误差分析 | |
| 8 | 0.65 | 化学反应热的计算 化学键与化学反应中的能量关系 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 9 | 0.65 | 离子反应的发生及书写 离子反应的发生条件 离子方程式的正误判断 | |
| 10 | 0.4 | 原电池原理理解 原电池电极反应式书写 燃料电池 新型电池 | |
| 11 | 0.4 | 化学平衡的有关计算 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 12 | 0.4 | 化学反应热的计算 反应焓变与热化学方程式的关系 盖斯定律与热化学方程式 | |
| 13 | 0.15 | 氢氧化钠、碳酸钠混合溶液与盐酸反应相关考查 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 14 | 0.65 | 化学反应速率计算 温度对化学反应速率的影响 外因对化学反应速率影响的综合分析 | |
| 15 | 0.4 | 化学平衡状态 化学平衡的移动及其影响因素 化学平衡常数 化学平衡状态的判断方法 | |
| 16 | 0.65 | 化学反应热的计算 热化学方程式书写及正误判断 表示燃烧热的热化学方程式书写 | |
| 17 | 0.4 | 化学平衡图像分析 压强对化学平衡移动的影响 产物的物质的量与温度、压强的图像关系分析 结合反应热图像与化学平衡的综合考查 | |
| 18 | 0.15 | 离子的检验 常见阳离子的检验 常见阴离子的检验 | |
| 二、解答题 | |||
| 19 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 | 无机推断题 |
| 20 | 0.4 | 无机综合推断 探究物质组成或测量物质的含量 | 无机推断题 |
| 21 | 0.65 | 碳与浓硫酸反应产物的检验 探究物质组成或测量物质的含量 | 实验探究题 |
| 23 | 0.15 | 盖斯定律及其有关计算 盖斯定律与热化学方程式 化学平衡常数的有关计算 化学反应条件的控制及其应用 | 原理综合题 |
| 三、填空题 | |||
| 22 | 0.65 | 铝三角转化 原电池 电解原理 探究物质组成或测量物质的含量 | |



