名校
1 . 向甲、乙两个容积均为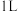 的恒容密闭容器中分别充入
的恒容密闭容器中分别充入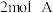 、
、 和
和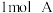 、
、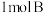 。相同条件下,发生反应
。相同条件下,发生反应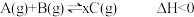 。测得两容器中
。测得两容器中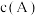 随时间t的变化关系如图所示。下列说法不正确的是
随时间t的变化关系如图所示。下列说法不正确的是
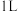 的恒容密闭容器中分别充入
的恒容密闭容器中分别充入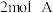 、
、 和
和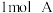 、
、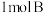 。相同条件下,发生反应
。相同条件下,发生反应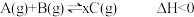 。测得两容器中
。测得两容器中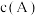 随时间t的变化关系如图所示。下列说法不正确的是
随时间t的变化关系如图所示。下列说法不正确的是
| A.x等于3 |
| B.向平衡后的乙容器中充入氦气,平衡不移动 |
C.向平衡后的乙容器中再加入 ,达到平衡后各物质的体积分数与甲容器中的相同 ,达到平衡后各物质的体积分数与甲容器中的相同 |
D.若向甲容器中再充入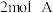 、 、 ,则达到化学平衡时甲容器中 ,则达到化学平衡时甲容器中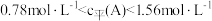 |
您最近一年使用:0次
名校
解题方法
2 . 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
 N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。
N2(g)+2CO2(g)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。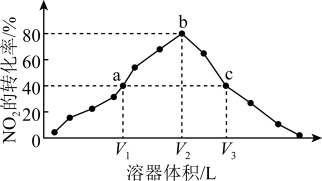
A.T℃时,该反应的化学平衡常数为Kc= mol·L-1 mol·L-1 |
| B.由图可知,c点V正>V逆 |
| C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡小 |
| D.容器内的压强:pa∶pb=6∶7 |
您最近一年使用:0次
2021-09-06更新
|
1443次组卷
|
16卷引用:重庆育才中学2022届高考适应性考试二化学试题
重庆育才中学2022届高考适应性考试二化学试题江西省抚州市临川一中、临川一中实验学校2022届高三第一次月考化学试题吉林省洮南市第一中学2021-2022学年高二上学期第一次月考化学试题河北省保定市定州市2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高三上学期期中考试化学试题四川省成都市树德中学2021-2022学年高二上学期11月阶段性测试(期中)化学试题 山西省长治市第二中学2021-2022学年高三上学期第三次练考化学试题安徽省六安市第一中学2022届高三上学期第三次月考化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期期中考试化学试题广东省梅州市蕉岭县蕉岭中学2022-2023学年高三上学期高二第二次质检化学试题(已下线)化学(重庆A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)易错点4化学反应速率、平衡图像分析错误(已下线)题型24 化学反应平衡常数、平衡转化率图像福建师范大学附属中学2023-2024学年高二上学期期中考试化学试题
3 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国提出争取2030年“碳达峰”,2060年“碳中和”。因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为热点。
(1)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
则:反应Ⅱ的ΔH2=___________ kJ·mol-1
(2)若反应II在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是___________ ;
a、v(CO)=v(H2O) b、总压强不变
c、平衡常数不变 d、容器内n(CO2)/n(H2O)的值保持不变
(3)①对于反应Ⅰ,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是___________ 。
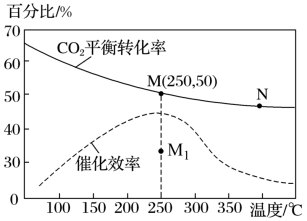
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的平衡产率增大
C.M点时平衡常数比N点时平衡常数大
D.若反应在较低的温度下进行,可以提高CO2的平衡转化率,符合勒沙特列原理
②若在2L密闭容器中充入3molH2和1molCO2只发生反应Ⅰ,250℃时反应的平衡常数K=___________ L2/mol2,若要进一步提高甲醇的体积分数,可采取的措施有___________ (写一条即可)。
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
I、2CO2+2e‑=C2O
II、C2O =CO2+CO
=CO2+CO
III、___________
IV、 +2Li+=Li2CO3
+2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为___________ 。
(1)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1则:反应Ⅱ的ΔH2=
(2)若反应II在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是
a、v(CO)=v(H2O) b、总压强不变
c、平衡常数不变 d、容器内n(CO2)/n(H2O)的值保持不变
(3)①对于反应Ⅰ,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的平衡产率增大
C.M点时平衡常数比N点时平衡常数大
D.若反应在较低的温度下进行,可以提高CO2的平衡转化率,符合勒沙特列原理
②若在2L密闭容器中充入3molH2和1molCO2只发生反应Ⅰ,250℃时反应的平衡常数K=
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
I、2CO2+2e‑=C2O

II、C2O
 =CO2+CO
=CO2+CO
III、
IV、
 +2Li+=Li2CO3
+2Li+=Li2CO3②研究表明,在电解质水溶液中,CO2气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
您最近一年使用:0次
名校
4 . 2021年6月17日,搭载神舟十二号载人飞般的长征二号F遥十二运载火箭,在酒泉卫星发射中
心发射。该运载火箭推进物分为偏二甲基肼( )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。
(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成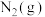 、
、 和
和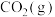 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式___________ 。
(2)对 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。
(3)飞船在发射前,运载火箭要加注燃料,火箭的周围常常会看到淡淡的黄色烟雾。这是由于燃料推进时,需要减压排出部分 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
。
①已知 和
和 的结构式分别是
的结构式分别是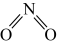 和
和 ,实验测得N-N的键能为167kJ/mol,
,实验测得N-N的键能为167kJ/mol, 中氮氧键(
中氮氧键( )的键能为466kJ/mol,
)的键能为466kJ/mol, 中氮氧键(
中氮氧键( )的键能为438.5kJ/mol;
)的键能为438.5kJ/mol; 转化为
转化为 的
的
___________ 。
②将一定量的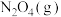 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是___________ 。
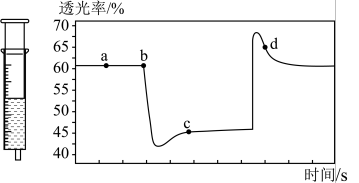
A.d点:
B.b点的操作是压缩注射器
C.c点与a点相比,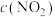 增大,
增大,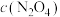 减小
减小
D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数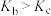
③反应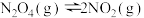 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: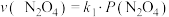 ,
,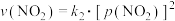 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是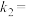
___________ 。(对于气相反应,用某组分B的平衡压强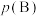 代替物质的量浓度
代替物质的量浓度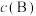 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)
④反应温度 时,
时,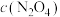 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段,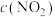 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
(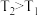 ),再次画出
),再次画出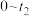 时段,
时段,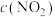 随t变化趋势的曲线。
随t变化趋势的曲线。_________
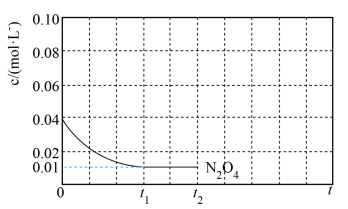
心发射。该运载火箭推进物分为偏二甲基肼(
 )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成
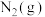 、
、 和
和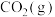 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式(2)对
 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。| A.偏二甲肼是比液氢更环保的燃料 | B. 既是氧化产物,又是还原产物 既是氧化产物,又是还原产物 |
| C.偏二甲基肼的燃烧热为2250kJ/mol | D.该反应是一个熵增的自发反应 |
 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
。①已知
 和
和 的结构式分别是
的结构式分别是 和
和 ,实验测得N-N的键能为167kJ/mol,
,实验测得N-N的键能为167kJ/mol, 中氮氧键(
中氮氧键( )的键能为466kJ/mol,
)的键能为466kJ/mol, 中氮氧键(
中氮氧键( )的键能为438.5kJ/mol;
)的键能为438.5kJ/mol; 转化为
转化为 的
的
②将一定量的
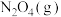 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
A.d点:

B.b点的操作是压缩注射器
C.c点与a点相比,
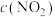 增大,
增大,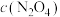 减小
减小D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数
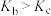
③反应
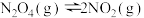 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: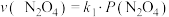 ,
,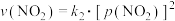 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是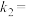
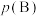 代替物质的量浓度
代替物质的量浓度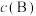 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)④反应温度
 时,
时,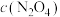 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段,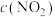 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
(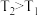 ),再次画出
),再次画出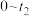 时段,
时段,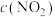 随t变化趋势的曲线。
随t变化趋势的曲线。
您最近一年使用:0次
名校
5 . 我国科学家在全球首次实现二氧化碳到淀粉的合成,其第一阶段是将二氧化碳催化加氢制得甲醇,反应方程式如下:
Ⅰ: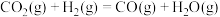
Ⅱ: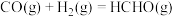
Ⅲ:
向容积为 的密闭装置中充入
的密闭装置中充入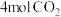 和
和 ,在t℃下反应,
,在t℃下反应, 后达平衡状态.测得容器内
后达平衡状态.测得容器内 ,
,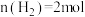 ,
,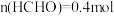 ,下列说法错误的是
,下列说法错误的是
Ⅰ:
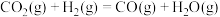
Ⅱ:
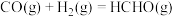
Ⅲ:

向容积为
 的密闭装置中充入
的密闭装置中充入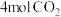 和
和 ,在t℃下反应,
,在t℃下反应, 后达平衡状态.测得容器内
后达平衡状态.测得容器内 ,
,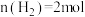 ,
,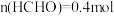 ,下列说法错误的是
,下列说法错误的是| A.可以通过监测容器内的总压来判断反应Ⅰ是否达到平衡 |
B.达平衡时,用 表示的反应Ⅰ的平均反应速率为 表示的反应Ⅰ的平均反应速率为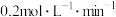 |
C.t℃下,反应Ⅱ的平衡常数为 |
D.向容器内再投入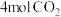 和 和 ,再次平衡后, ,再次平衡后,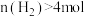 |
您最近一年使用:0次
2022-04-03更新
|
509次组卷
|
3卷引用:重庆市第一中学2021-2022学年高三上学期第三次月考化学试题
名校
6 . 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上用天然气为原料,分为两阶段制备甲醇:
(Ⅰ)制备合成气:CH4(g)+H2O(g) ⇌CO(g)+3H2(g) ΔH= +206.0kJ•mol-1
(Ⅱ)合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) ΔH= -90.67kJ•mol-1
(1)在刚性容器中制备合成气,下列说法中能说明此反应达到平衡状态的是_______ 。
A.体系的压强不再发生变化
B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变
D.体系的密度不再发生变化
E.反应速率v(CH4)=3v(H2)
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
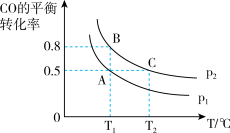
①比较A、B 两点压强大小PA_______ PB(填“>、<、=”)
②若达到化学平衡状态 A 时,容器的体积为 10L,如果反应开始时仍充入 10mol CO和20mol H2,则在平衡状态 B 时,容器的体积V(B)=_______ L;
(3)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成水蒸气和甲醇,CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)该反应在低温下可自发进行,则ΔH_______ 0(填“>、=、<”)
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示;a~d点中反应可能处于平衡状态的点是_______ ;CO2的转化率a 点比c点高的原因是_______ 。
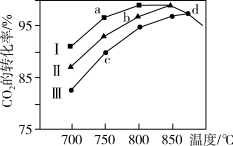
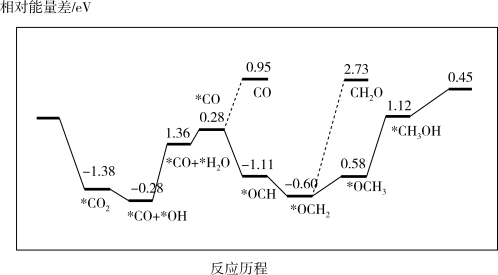
③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示;容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为_______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(Ⅰ)制备合成气:CH4(g)+H2O(g) ⇌CO(g)+3H2(g) ΔH= +206.0kJ•mol-1
(Ⅱ)合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) ΔH= -90.67kJ•mol-1
(1)在刚性容器中制备合成气,下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化
B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变
D.体系的密度不再发生变化
E.反应速率v(CH4)=3v(H2)
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。

①比较A、B 两点压强大小PA
②若达到化学平衡状态 A 时,容器的体积为 10L,如果反应开始时仍充入 10mol CO和20mol H2,则在平衡状态 B 时,容器的体积V(B)=
(3)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成水蒸气和甲醇,CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)该反应在低温下可自发进行,则ΔH
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示;a~d点中反应可能处于平衡状态的点是

③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示;容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3 D.*OCH3→*CH3OH

您最近一年使用:0次
7 . 已知N2(g)+3H2(g) 2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
 2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是
2NH3(g) △H<0。在温度、容积相同的甲、乙、丙三个密闭容器中,分别同时充入1molN2、3molH2,甲保持恒温、恒容;乙保持绝热、恒容;丙保持恒温、恒压,测得反应达到平衡时的有关数据如表所示,则下列说法错误的是| 容器 | 甲(恒温、恒容) | 乙(绝热、恒容) | 丙(恒温、恒压) |
| 反应物投入量 | 1molN2、3molH2 | 1molN2、3molH2 | 1molN2、3molH2 |
| NH3的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应物的转化率 | α1 | α2 | α3 |
| 化学平衡常数 | K1 | K2 | K3 |
| 混合气体的平均相对分子质量 | M1 | M2 | M3 |
| A.c2<c1<c3 | B.α2<α3<α1 |
| C.K2<K1=K3 | D.M2<M1<M3 |
您最近一年使用:0次
名校
8 . 一定温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:PCl5 (g)  PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是
 PCl3(g)+Cl2(g)。下列说法错误的是
PCl3(g)+Cl2(g)。下列说法错误的是| 容器编号 | 物质的起始浓度/(mol·L-1) | 物质的平衡浓度/(mol·L-1) | ||
 | 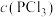 | 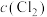 | 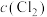 | |
| Ⅰ | 0.4 | 0 | 0 | 0.2 |
| Ⅱ | 0.6 | 0 | 0.2 | |
| Ⅲ | 0.8 | 0 | 0 | |
A.反应达到平衡时,容器I中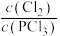 比容器Ⅱ中的小 比容器Ⅱ中的小 |
| B.反应达到平衡时,容器I与容器Ⅱ中的总压强之比为3︰4 |
C.反应达到平衡时,容器Ⅲ中 的体积分数小于 的体积分数小于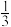 |
| D.反应达到平衡时,容器Ⅲ中0.4mol/L<c(PCl5)<0.8 mol/L |
您最近一年使用:0次
2020-09-29更新
|
716次组卷
|
6卷引用:广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题
9 . 科学家提出利用CO2与CH4制备“合成气”(CO、H2),发生反应 ,在200℃时,向5L带气压计的恒容密闭容器中通入
,在200℃时,向5L带气压计的恒容密闭容器中通入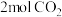 和
和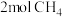 ,测得初始压强为
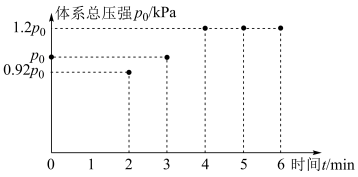
,测得初始压强为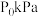 ,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。下列说法不正确的是
,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。下列说法不正确的是
 ,在200℃时,向5L带气压计的恒容密闭容器中通入
,在200℃时,向5L带气压计的恒容密闭容器中通入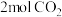 和
和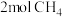 ,测得初始压强为
,测得初始压强为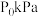 ,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。下列说法不正确的是
,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。下列说法不正确的是
| A.容器内总压强与初始相比增加了20%说明该反应已达平衡状态 |
B.图中0min到2min压强变化可知该反应 |
C.用平衡分压代替平衡浓度衣示的化学平衡常数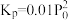 [气体分压(P分)气体总压(P总)×气体体积分数] [气体分压(P分)气体总压(P总)×气体体积分数] |
D.平衡后若继续往容器内通入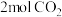 和 和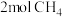 ,再次达到平衡后各组分的物质的量分数保持不变 ,再次达到平衡后各组分的物质的量分数保持不变 |
您最近一年使用:0次
2021-10-19更新
|
299次组卷
|
2卷引用:重庆市巴蜀中学校2021-2022学年高二上学期(10月)第一次月考化学试题
名校
解题方法
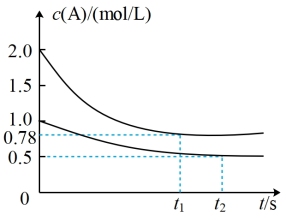
10 . 将4mol A气体和2mol B气体在恒压密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g) 2C(g) ∆H<0;4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L。下列说法中正确的是
2C(g) ∆H<0;4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L。下列说法中正确的是
 2C(g) ∆H<0;4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L。下列说法中正确的是
2C(g) ∆H<0;4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L。下列说法中正确的是| A.此时A的浓度为0.6mol/L |
| B.达平衡后若通入一定量氯气,A的转化率降低 |
| C.4s内用物质B表示的反应速率为0.175mol·L-1·s-1 |
| D.达平衡后若升高温度,C的浓度将增大 |
您最近一年使用:0次



