当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国提出争取2030年“碳达峰”,2060年“碳中和”。因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为热点。
(1)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
则:反应Ⅱ的ΔH2=___________ kJ·mol-1
(2)若反应II在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是___________ ;
a、v(CO)=v(H2O) b、总压强不变
c、平衡常数不变 d、容器内n(CO2)/n(H2O)的值保持不变
(3)①对于反应Ⅰ,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是___________ 。
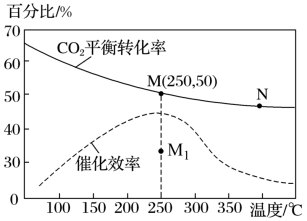
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的平衡产率增大
C.M点时平衡常数比N点时平衡常数大
D.若反应在较低的温度下进行,可以提高CO2的平衡转化率,符合勒沙特列原理
②若在2L密闭容器中充入3molH2和1molCO2只发生反应Ⅰ,250℃时反应的平衡常数K=___________ L2/mol2,若要进一步提高甲醇的体积分数,可采取的措施有___________ (写一条即可)。
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
I、2CO2+2e‑=C2O
II、C2O =CO2+CO
=CO2+CO
III、___________
IV、 +2Li+=Li2CO3
+2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为___________ 。
(1)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1则:反应Ⅱ的ΔH2=
(2)若反应II在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是
a、v(CO)=v(H2O) b、总压强不变
c、平衡常数不变 d、容器内n(CO2)/n(H2O)的值保持不变
(3)①对于反应Ⅰ,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的平衡产率增大
C.M点时平衡常数比N点时平衡常数大
D.若反应在较低的温度下进行,可以提高CO2的平衡转化率,符合勒沙特列原理
②若在2L密闭容器中充入3molH2和1molCO2只发生反应Ⅰ,250℃时反应的平衡常数K=
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
I、2CO2+2e‑=C2O

II、C2O
 =CO2+CO
=CO2+CO
III、
IV、
 +2Li+=Li2CO3
+2Li+=Li2CO3②研究表明,在电解质水溶液中,CO2气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
更新时间:2022-09-16 08:56:14
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义。利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为: ①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol-1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol-1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol-1

(1)反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H=___________ 。
(2)固定n(CO2)= n(CH4),改变反应温度,CO2和CH4的平衡转化率见下图。
①同温度下CO2的平衡转化率____________ (填“大于”或“小于”)于CH4的平衡转化率,其原因是 __________________________ 。
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是_________________ 。
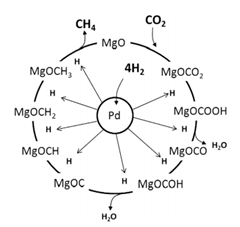
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为_____________________ ,反应过程中碳元素的化合价为-2价的中间体是__________ 。
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4 + Na2CO3 == CaCO3 + Na2SO4,则达到平衡后,溶液中c(CO32-)/c(SO42-) =__________ 。【用Ksp(CaSO4)和Ksp(CaCO3)表示】
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol-1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol-1

(1)反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H=
(2)固定n(CO2)= n(CH4),改变反应温度,CO2和CH4的平衡转化率见下图。
①同温度下CO2的平衡转化率
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为

(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4 + Na2CO3 == CaCO3 + Na2SO4,则达到平衡后,溶液中c(CO32-)/c(SO42-) =
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】工业废水中的六价铬[Cr(VI)]常采用还原沉淀法、离子交换法和微生物法等方法进行处理。
(1)室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4⇌H++HCrO ΔH1
ΔH1
HCrO ⇌H++CrO
⇌H++CrO ΔH2
ΔH2
2HCrO ⇌
⇌ +H2O ΔH3
+H2O ΔH3
室温下,反应2CrO +2H+⇌
+2H+⇌ +H2O的ΔH=
+H2O的ΔH=_______ (用含ΔH1、ΔH2或ΔH3的代数式表示)。
(2)还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力, 将
将 还原为Cr3+的离子方程式为
还原为Cr3+的离子方程式为_______ 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是_______ 。
(3)微生物法:
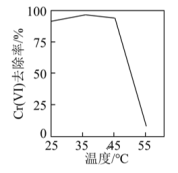
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是_______ 。
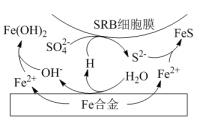
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+,_______ 。
(4)离子交换法:用强碱性离子交换树脂(ROH)与 和HCrO
和HCrO 等发生离子交换,交换过程中发生如下反应:
等发生离子交换,交换过程中发生如下反应:
ROH(s)+HCrO (aq)⇌ RHCrO4(s)+OH-(aq)
(aq)⇌ RHCrO4(s)+OH-(aq)
2ROH(s)+ (aq)⇌ R2CrO4(s)+2OH-(aq)
(aq)⇌ R2CrO4(s)+2OH-(aq)
其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是_______ 。
(1)室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4⇌H++HCrO
 ΔH1
ΔH1HCrO
 ⇌H++CrO
⇌H++CrO ΔH2
ΔH22HCrO
 ⇌
⇌ +H2O ΔH3
+H2O ΔH3室温下,反应2CrO
 +2H+⇌
+2H+⇌ +H2O的ΔH=
+H2O的ΔH=(2)还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力,
 将
将 还原为Cr3+的离子方程式为
还原为Cr3+的离子方程式为②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是

②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+,

(4)离子交换法:用强碱性离子交换树脂(ROH)与
 和HCrO
和HCrO 等发生离子交换,交换过程中发生如下反应:
等发生离子交换,交换过程中发生如下反应:ROH(s)+HCrO
 (aq)⇌ RHCrO4(s)+OH-(aq)
(aq)⇌ RHCrO4(s)+OH-(aq)2ROH(s)+
 (aq)⇌ R2CrO4(s)+2OH-(aq)
(aq)⇌ R2CrO4(s)+2OH-(aq)其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是
您最近一年使用:0次
【推荐3】氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为___________ 。
(2)已知反应 2N2O(g) 2N2(g)+O2(g) ΔH=-163 kJ·mol -1 ,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1 mol N2O(g)分子中化学键断裂时需要吸收的能量为
2N2(g)+O2(g) ΔH=-163 kJ·mol -1 ,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1 mol N2O(g)分子中化学键断裂时需要吸收的能量为_____ kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g) 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
①在0~20min 时段,反应速率 v(O2)为_____ mol·L -1 ·min -1。
②若N2O起始浓度c0为 0.150 mol·L -1 ,则反应至30 min时N2O的转化率α=______ 。比较不同起始浓度时N2O的分解速率:v(c0 =0.150 mol·L -1 )______ v(c0=0.100 mol·L -1)(填“>”“=”或“<”)。
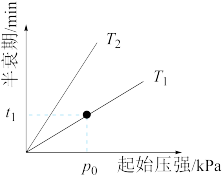
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则 T2_______ T1(填“>”“=”或“<”)。当温度为 T 1 、起始压强为p0,反应至 t 1 min 时,体系压强 p=______ (用p0表示)。
(4)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g) N2(g)+IO(g) (慢反应)
N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g) N2(g)+O2(g)+I(g) (快反应)
N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程 v=k·c(N2O)·[c(I2)]0.5(k 为速率常数)。下列表述正确的是__________ (填标号)。
a.N2O分解反应中,k(含碘)<k(无碘)
b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大
d.I2浓度与 N2O分解速率无关
(1)污水生物脱氮过程中,在微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为
(2)已知反应 2N2O(g)
 2N2(g)+O2(g) ΔH=-163 kJ·mol -1 ,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1 mol N2O(g)分子中化学键断裂时需要吸收的能量为
2N2(g)+O2(g) ΔH=-163 kJ·mol -1 ,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1 mol N2O(g)分子中化学键断裂时需要吸收的能量为(3)在一定温度下的恒容容器中,反应2N2O(g)
 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
②若N2O起始浓度c0为 0.150 mol·L -1 ,则反应至30 min时N2O的转化率α=
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则 T2

(4)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)
 2I(g) (快反应)
2I(g) (快反应)第二步 I(g)+N2O(g)
 N2(g)+IO(g) (慢反应)
N2(g)+IO(g) (慢反应)第三步 IO(g)+N2O(g)
 N2(g)+O2(g)+I(g) (快反应)
N2(g)+O2(g)+I(g) (快反应)实验表明,含碘时N2O分解速率方程 v=k·c(N2O)·[c(I2)]0.5(k 为速率常数)。下列表述正确的是
a.N2O分解反应中,k(含碘)<k(无碘)
b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大
d.I2浓度与 N2O分解速率无关
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
回答下列问题:
(1)①已知:CO(g)+2H2(g) CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为
CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为___________ 。
②一定条件下反应Ⅱ能自发进行原因是___________ 。
(2)向密闭容器中加入CO2(g)和H2(g)合成CH3OH(g)。已知反应Ⅰ的正反应速率可表示为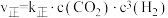 ,逆反应速率可表示为
,逆反应速率可表示为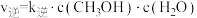 ,其中K正、K逆为速率常数。
,其中K正、K逆为速率常数。
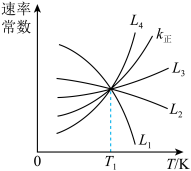
①如图中能够代表k逆的曲线为___________ 。(填“L1”、“L2”、“L3”或“L4”)。
②温度为T1时,反应Ⅰ的化学平衡常数K=___________ 。
③对于上述反应体系,下列说法正确的是___________ 。
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂,H2的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。
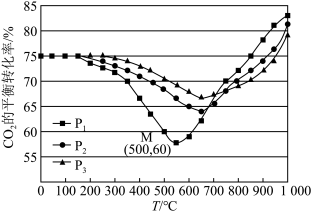
①压强P1、P2、P3由大到小的顺序是___________ ,在P1压强下,200℃~550℃时反应以___________ (填“Ⅰ”或“Ⅱ”)为主,原因是___________ 。
②压强为P2时,温度高于660℃之后,随着温度升高CO2平衡转化率增大的原因___________ 。
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ∙mol-1回答下列问题:
(1)①已知:CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为
CH3OH(g) ΔH2=-90.6kJ∙mol-1,则ΔH1为②一定条件下反应Ⅱ能自发进行原因是
(2)向密闭容器中加入CO2(g)和H2(g)合成CH3OH(g)。已知反应Ⅰ的正反应速率可表示为
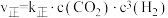 ,逆反应速率可表示为
,逆反应速率可表示为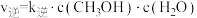 ,其中K正、K逆为速率常数。
,其中K正、K逆为速率常数。①如图中能够代表k逆的曲线为

②温度为T1时,反应Ⅰ的化学平衡常数K=
③对于上述反应体系,下列说法正确的是
A.增大CO2的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂,H2的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
(3)不同条件下,按照n(CO2):n(H2)=1:3投料,CO2的平衡转化率如下图所示。

①压强P1、P2、P3由大到小的顺序是
②压强为P2时,温度高于660℃之后,随着温度升高CO2平衡转化率增大的原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心发射。该运载火箭推进物分为偏二甲基肼( )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。
(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成 、
、 和
和 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式___________ 。
(2)对 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。
(3)飞船在发射前,运载火箭要加注燃料,火箭的周围常常会看到淡淡的黄色烟雾。这是由于燃料推进时,需要减压排出部分 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
。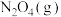 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是___________ 。
B.b点的操作是压缩注射器
C.c点与a点相比, 增大,
增大,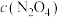 减小
减小
D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数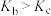
③反应 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: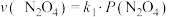 ,
,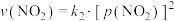 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是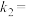
___________ 。(对于气相反应,用某组分B的平衡压强 代替物质的量浓度
代替物质的量浓度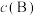 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)
④反应温度 时,
时,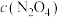 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段, 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
( ),再次画出
),再次画出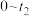 时段,
时段, 随t变化趋势的曲线。
随t变化趋势的曲线。_________
 )、四氧化二氮和液氢、液氧。
)、四氧化二氮和液氢、液氧。(1)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成
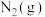 、
、 和
和 ,放出112.5kJ的热量,写出上述反应的热化学方程式
,放出112.5kJ的热量,写出上述反应的热化学方程式(2)对
 和
和 反应的说法正确的是___________。
反应的说法正确的是___________。| A.偏二甲肼是比液氢更环保的燃料 | B. 既是氧化产物,又是还原产物 既是氧化产物,又是还原产物 |
| C.偏二甲基肼的燃烧热为2250kJ/mol | D.该反应是一个熵增的自发反应 |
(3)飞船在发射前,运载火箭要加注燃料,火箭的周围常常会看到淡淡的黄色烟雾。这是由于燃料推进时,需要减压排出部分
 。无色的
。无色的 可分解为红棕色的
可分解为红棕色的 。
。①已知 和
和 的结构式分别是
的结构式分别是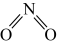 和
和 ,实验测得N-N的键能为167kJ/mol,
,实验测得N-N的键能为167kJ/mol, 中氮氧键(
中氮氧键( )的键能为466kJ/mol,
)的键能为466kJ/mol, 中氮氧键(
中氮氧键( )的键能为438.5kJ/mol;
)的键能为438.5kJ/mol; 转化为
转化为 的
的
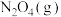 充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是
充入注射器中后封口,如图是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法确的是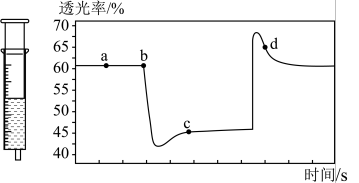

B.b点的操作是压缩注射器
C.c点与a点相比,
 增大,
增大, 减小
减小D.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数
③反应
 ,一定条件下
,一定条件下 与
与 的消耗速率与自身压强间存在:
的消耗速率与自身压强间存在: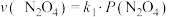 ,
,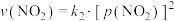 。其中
。其中 、
、 是与反应及温度有关的常数。一定温度下,
是与反应及温度有关的常数。一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是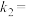
 代替物质的量浓度
代替物质的量浓度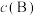 也可表示平衡常数,记作
也可表示平衡常数,记作 )
)④反应温度
 时,
时,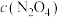 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出 时段,
时段, 随t变化曲线。保持其它条件不变,改变反应温度为
随t变化曲线。保持其它条件不变,改变反应温度为 (
( ),再次画出
),再次画出 时段,
时段, 随t变化趋势的曲线。
随t变化趋势的曲线。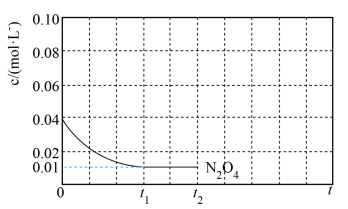
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知在水中存在以下平衡: ,
, 。
。
①常温下 溶液的
溶液的
_______ (填序号)。
A.大于7 B.小于7 C.等于7 D.无法确定
②某温度下,若向 的
的 溶液中逐滴滴加
溶液中逐滴滴加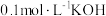 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是_______ 。
A.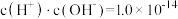 B.
B. 
C. D.
D. 
③已知常温下 的钙盐
的钙盐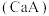 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: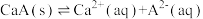
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有_______ 。
A.升高温度 B.降低温度 C.加入 晶体 D.加入
晶体 D.加入 固体
固体
(2)联氨(又称肼, ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
①联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离方程式为_______ 。
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的 溶液。肼-空气燃料电池放电时:负极的电极反应式是
溶液。肼-空气燃料电池放电时:负极的电极反应式是_______ 。
(3)工业废水中含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:

若平衡体系的 ,则溶液显
,则溶液显_______ 色。
②能说明第①步反应达平衡状态的是_______ 。
A. 和
和 的浓度相同 b. v(
的浓度相同 b. v( )和v(
)和v( )相等 c.溶液的颜色不变
)相等 c.溶液的颜色不变
③第③步生成的 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: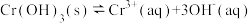 ,常温下,
,常温下, 的溶度积
的溶度积 ,要使
,要使 降至
降至 ,溶液的
,溶液的 应调至
应调至_______ 。
(1)已知在水中存在以下平衡:
 ,
, 。
。①常温下
 溶液的
溶液的
A.大于7 B.小于7 C.等于7 D.无法确定
②某温度下,若向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加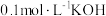 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是A.
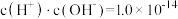 B.
B. 
C.
 D.
D. 
③已知常温下
 的钙盐
的钙盐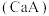 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: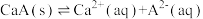
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有A.升高温度 B.降低温度 C.加入
 晶体 D.加入
晶体 D.加入 固体
固体(2)联氨(又称肼,
 ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:①联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离方程式为
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的
 溶液。肼-空气燃料电池放电时:负极的电极反应式是
溶液。肼-空气燃料电池放电时:负极的电极反应式是(3)工业废水中含有一定量的
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
若平衡体系的
 ,则溶液显
,则溶液显②能说明第①步反应达平衡状态的是
A.
 和
和 的浓度相同 b. v(
的浓度相同 b. v( )和v(
)和v( )相等 c.溶液的颜色不变
)相等 c.溶液的颜色不变③第③步生成的
 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: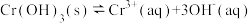 ,常温下,
,常温下, 的溶度积
的溶度积 ,要使
,要使 降至
降至 ,溶液的
,溶液的 应调至
应调至
您最近一年使用:0次
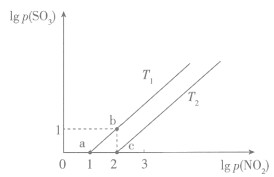
【推荐1】(1)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放显减少10%,二氧化碳(CO2)的排放量也要大幅减少。
①已知反应:NO2(g)+SO2(g)⇌SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___________ (填字母)。
A.体系压强保持不变
B.混合气体颜色保持不变
C.混合气体的平均相对分子质量不再变化
D.每消耗1molSO3的同时生成1 molNO2
②CO2可转化成有机物 CH3OH实现碳循环。在1L的密闭容器中,充入lmolCO2和 3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=___________
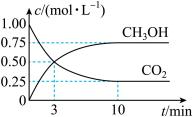
③工业上,CH3OH 也可由CO和H2合成。参考合成反应CO(g)+2H2(g)⇌CH3OH(g)的平衡常数。下列说法正确的是___________ 。(双选)
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中投入0.1molCO和 0.2molH2,达到平衡时,CO转化率为 50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)⇌NH2CO2NH4(s) ΔH1=−159.5 kJ·mol−1;
反应II:NH2CO2NH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol−1;
反应III:H2O(l)=H2O(g) ΔH3=+44.0 kJ·mol−1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为___________ 。
(3)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30g,容器内的压强(p)随时间(t)的变化如图1所示。【M(尿素)=60g/mol】
①T1℃时,该反应的平衡常数K的值为___________ 。
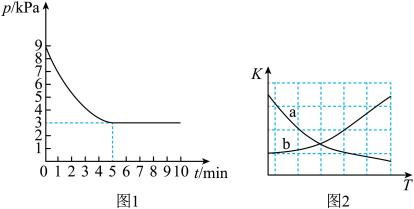
②图2中能正确反映平衡常数K随温度变化关系的曲线为___________ (填曲线标记字母)
①已知反应:NO2(g)+SO2(g)⇌SO3(g)+NO(g),一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.混合气体的平均相对分子质量不再变化
D.每消耗1molSO3的同时生成1 molNO2
②CO2可转化成有机物 CH3OH实现碳循环。在1L的密闭容器中,充入lmolCO2和 3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=

③工业上,CH3OH 也可由CO和H2合成。参考合成反应CO(g)+2H2(g)⇌CH3OH(g)的平衡常数。下列说法正确的是
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中投入0.1molCO和 0.2molH2,达到平衡时,CO转化率为 50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)⇌NH2CO2NH4(s) ΔH1=−159.5 kJ·mol−1;
反应II:NH2CO2NH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol−1;
反应III:H2O(l)=H2O(g) ΔH3=+44.0 kJ·mol−1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为
(3)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30g,容器内的压强(p)随时间(t)的变化如图1所示。【M(尿素)=60g/mol】
①T1℃时,该反应的平衡常数K的值为

②图2中能正确反映平衡常数K随温度变化关系的曲线为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】水煤气变换是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)已知:在630℃恒容下与足量发生反应
(i)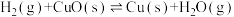
 ,达到平衡时H2的转化率为90%;同时在630℃恒容下
,达到平衡时H2的转化率为90%;同时在630℃恒容下 与足量
与足量 发生反应
发生反应
(ii)
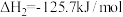 ,达到平衡时CO的转化率为96%。
,达到平衡时CO的转化率为96%。
①试计算反应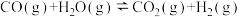 的
的
_______  。
。
②分析该反应在630℃时的平衡常数K_______ 1(填“大于”或“小于”)。
(2)对于反应 ,采用多孔氧化铁作催化剂,分别在450℃和420℃时在刚性密闭容器中将等物质的量的
,采用多孔氧化铁作催化剂,分别在450℃和420℃时在刚性密闭容器中将等物质的量的 和
和 混合,
混合, 的转化率随时间变化的结果如下图所示。
的转化率随时间变化的结果如下图所示。
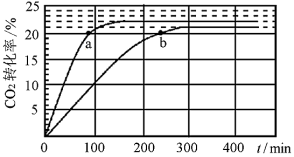
①450℃时反应CO2的平衡转化率
_______ %;平衡常数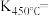
_______ (保留2位小数)。
②在450℃下:要提高CO2转化率,可采取的措施是_______ ;要缩短反应达到平衡的时间,可采取的措施有_______ (任写一个措施)。
③比较a、b处反应速率大小: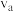
_______ 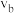 (填“大于”“小于”或“等于”)。反应速率
(填“大于”“小于”或“等于”)。反应速率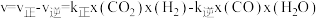 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数,平衡常数
分别为正、逆向反应速率常数,x为物质的量分数,平衡常数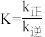 ,计算a处
,计算a处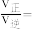
_______ (保留1位小数)。
(1)已知:在630℃恒容下与足量发生反应
(i)
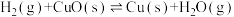
 ,达到平衡时H2的转化率为90%;同时在630℃恒容下
,达到平衡时H2的转化率为90%;同时在630℃恒容下 与足量
与足量 发生反应
发生反应(ii)

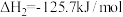 ,达到平衡时CO的转化率为96%。
,达到平衡时CO的转化率为96%。①试计算反应
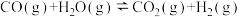 的
的
 。
。②分析该反应在630℃时的平衡常数K
(2)对于反应
 ,采用多孔氧化铁作催化剂,分别在450℃和420℃时在刚性密闭容器中将等物质的量的
,采用多孔氧化铁作催化剂,分别在450℃和420℃时在刚性密闭容器中将等物质的量的 和
和 混合,
混合, 的转化率随时间变化的结果如下图所示。
的转化率随时间变化的结果如下图所示。
①450℃时反应CO2的平衡转化率

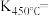
②在450℃下:要提高CO2转化率,可采取的措施是
③比较a、b处反应速率大小:
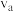
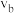 (填“大于”“小于”或“等于”)。反应速率
(填“大于”“小于”或“等于”)。反应速率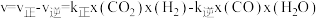 ,
, 、
、 分别为正、逆向反应速率常数,x为物质的量分数,平衡常数
分别为正、逆向反应速率常数,x为物质的量分数,平衡常数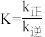 ,计算a处
,计算a处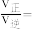
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】回答下列问题:
(1)以 和
和 为原料在一定条件下可制备
为原料在一定条件下可制备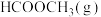 ,发生的主要反应如下:
,发生的主要反应如下:
Ⅰ.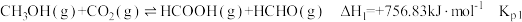
Ⅱ.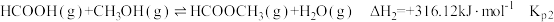
Ⅲ.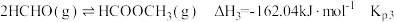
①反应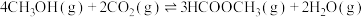 的
的
_______ ;该反应的压强平衡常数
_______ (用含 、
、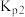 、
、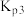 的代数式表示)。
的代数式表示)。
②已知压强平衡常数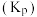 与温度
与温度 之间存在定量关系,且符合
之间存在定量关系,且符合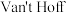 方程
方程 (其中R、C为常数,
(其中R、C为常数, 为反应热)。反应Ⅰ、Ⅱ、Ⅲ的
为反应热)。反应Ⅰ、Ⅱ、Ⅲ的 与
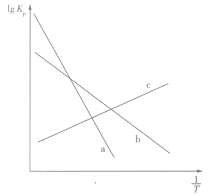
与 之间均为线性关系,如图所示。其中反应Ⅰ对应的曲线为
之间均为线性关系,如图所示。其中反应Ⅰ对应的曲线为_______ (填“a”“b”或“c”)。
(2)已知反应 ,实验测得不同温度
,实验测得不同温度 、
、 下的平衡态中
下的平衡态中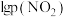 和
和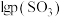 的关系如图所示,实验初始时体系中的
的关系如图所示,实验初始时体系中的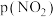 和
和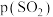 相等、
相等、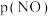 和
和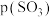 相等。则a、b两点体系压强之比
相等。则a、b两点体系压强之比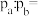
_______ ;温度为 时化学平衡常数
时化学平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)① 分别与
分别与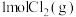 、
、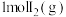 在容积相等的甲、乙两个恒容密闭容器中反应,
在容积相等的甲、乙两个恒容密闭容器中反应,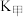 、
、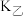 分别表示两个反应的平衡常数,则
分别表示两个反应的平衡常数,则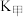
_______ (填“>”“<”或“=”)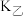 。
。
②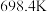 时,反应
时,反应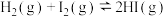 的
的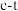 图像如图所示。
图像如图所示。
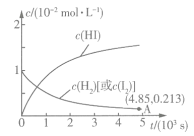
正反应速率 ,逆反应速率
,逆反应速率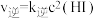 ,其中
,其中 、
、 为速率常数,若
为速率常数,若 、
、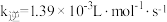 时,则A点时
时,则A点时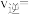
_______  (结果保留3位有效数字,后同),平衡常数
(结果保留3位有效数字,后同),平衡常数
_______ 。
(1)以
 和
和 为原料在一定条件下可制备
为原料在一定条件下可制备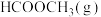 ,发生的主要反应如下:
,发生的主要反应如下:Ⅰ.
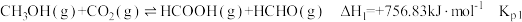
Ⅱ.
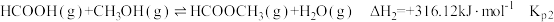
Ⅲ.
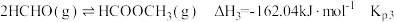
①反应
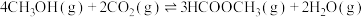 的
的

 、
、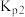 、
、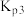 的代数式表示)。
的代数式表示)。②已知压强平衡常数
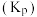 与温度
与温度 之间存在定量关系,且符合
之间存在定量关系,且符合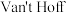 方程
方程 (其中R、C为常数,
(其中R、C为常数, 为反应热)。反应Ⅰ、Ⅱ、Ⅲ的
为反应热)。反应Ⅰ、Ⅱ、Ⅲ的 与
与 之间均为线性关系,如图所示。其中反应Ⅰ对应的曲线为
之间均为线性关系,如图所示。其中反应Ⅰ对应的曲线为
(2)已知反应
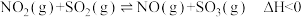 ,实验测得不同温度
,实验测得不同温度 、
、 下的平衡态中
下的平衡态中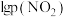 和
和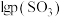 的关系如图所示,实验初始时体系中的
的关系如图所示,实验初始时体系中的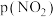 和
和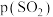 相等、
相等、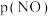 和
和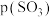 相等。则a、b两点体系压强之比
相等。则a、b两点体系压强之比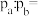
 时化学平衡常数
时化学平衡常数

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)①
 分别与
分别与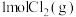 、
、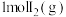 在容积相等的甲、乙两个恒容密闭容器中反应,
在容积相等的甲、乙两个恒容密闭容器中反应,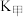 、
、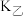 分别表示两个反应的平衡常数,则
分别表示两个反应的平衡常数,则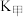
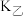 。
。②
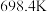 时,反应
时,反应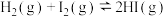 的
的 图像如图所示。
图像如图所示。
正反应速率
 ,逆反应速率
,逆反应速率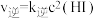 ,其中
,其中 、
、 为速率常数,若
为速率常数,若 、
、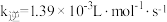 时,则A点时
时,则A点时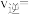
 (结果保留3位有效数字,后同),平衡常数
(结果保留3位有效数字,后同),平衡常数
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1) 时,
时,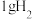 燃烧生成
燃烧生成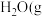 )放热
)放热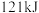 ,
, 蒸发吸热
蒸发吸热 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ、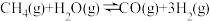
Ⅱ、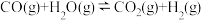
①下列操作中,能提高 平衡转化率的是
平衡转化率的是___________ (填标号)。
A.增加 用量B.恒温恒压下通入惰性气体C.移除
用量B.恒温恒压下通入惰性气体C.移除 D.加入催化剂
D.加入催化剂
②恒温恒压条件下,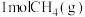 和
和 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
___________ (写出含有a、b的计算式;对于反应 ,
,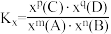 ,x为物质的量分数)。
,x为物质的量分数)。
(3)氢氧燃料电池中氢气在___________ (填“正”或“负”)极发生反应。
(4)在允许 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,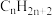 放电的电极反应式为
放电的电极反应式为___________ 。
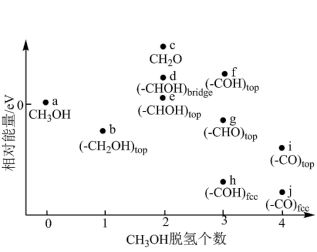
(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→___________ (用 等代号表示)。
等代号表示)。
(1)
 时,
时,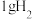 燃烧生成
燃烧生成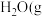 )放热
)放热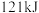 ,
, 蒸发吸热
蒸发吸热 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ、
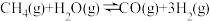
Ⅱ、
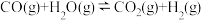
①下列操作中,能提高
 平衡转化率的是
平衡转化率的是A.增加
 用量B.恒温恒压下通入惰性气体C.移除
用量B.恒温恒压下通入惰性气体C.移除 D.加入催化剂
D.加入催化剂②恒温恒压条件下,
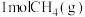 和
和 反应达平衡时,
反应达平衡时, 的转化率为a,
的转化率为a, 的物质的量为
的物质的量为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
 ,
,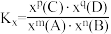 ,x为物质的量分数)。
,x为物质的量分数)。(3)氢氧燃料电池中氢气在
(4)在允许
 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中, 放电的电极反应式为
放电的电极反应式为(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→
 等代号表示)。
等代号表示)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】化学小组用双液原电池原理研究酸碱性对物质氧化性、还原性强弱的影响。通过改溶液酸碱性,观察电压表读数的变化,读数越大,则对应物质的氧化性(或还原性)越强。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
② 的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为
的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 ;在中性和弱碱性溶液中,被还原为
;在中性和弱碱性溶液中,被还原为 ;在强碱性溶液中,被还原为
;在强碱性溶液中,被还原为 。
。

(1)连接电压表,形成闭合回路,测得初始电压为 。实验装置要置于水浴内的原因:
。实验装置要置于水浴内的原因:_____ 。
实验操作和读数记录如下:
(2)同学甲根据实验③推导出酸性增强, 的氧化性增强,实验②可以得出:
的氧化性增强,实验②可以得出:_______ 。
(3)同学乙认为实验①中,加入酸后,还原剂转化成了_______ (填化学式)。
(4)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入_______ ,测得电压为 ,以此作为实验①②的初始电压。
,以此作为实验①②的初始电压。
(5)同学丁认为,实验③加入5mL 溶液后,右边烧杯内的电极反应为:
溶液后,右边烧杯内的电极反应为:_______ 。实验④加入5mLNaOH溶液后,右边烧杯内的电极反应为:_______ 。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
②
 的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为
的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 ;在中性和弱碱性溶液中,被还原为
;在中性和弱碱性溶液中,被还原为 ;在强碱性溶液中,被还原为
;在强碱性溶液中,被还原为 。
。
(1)连接电压表,形成闭合回路,测得初始电压为
 。实验装置要置于水浴内的原因:
。实验装置要置于水浴内的原因:实验操作和读数记录如下:
左烧杯( / / ) ) | 右烧杯( ,调pH=4) ,调pH=4) | 电压表读数变化 | |
| ① | 逐滴加入5mL0.05mol/L | 由 逐渐降低 逐渐降低 | |
| ② | 逐滴加入5mL0.1mol/LNaOH | 由 逐渐升高 逐渐升高 | |
| ③ | 逐滴加入5mL0.05mol/L | 由 逐渐升高 逐渐升高 | |
| ④ | 加入少量0.1mol/LNaOH | 由 略微下降 略微下降 | |
| 继续逐滴加入NaOH至5mL | 再迅速下降 |
(2)同学甲根据实验③推导出酸性增强,
 的氧化性增强,实验②可以得出:
的氧化性增强,实验②可以得出:(3)同学乙认为实验①中,加入酸后,还原剂转化成了
(4)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入
 ,以此作为实验①②的初始电压。
,以此作为实验①②的初始电压。(5)同学丁认为,实验③加入5mL
 溶液后,右边烧杯内的电极反应为:
溶液后,右边烧杯内的电极反应为:
您最近一年使用:0次
【推荐3】天然气开采产生的废气普遍含有硫化氢,需要回收处理并加以利用。
回答下列问题:
(1)已知下列反应的热化学方程式:
①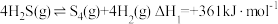 ;
;
②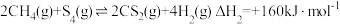
则反应③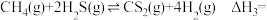
___________ 。
(2)下列叙述不能说明反应③达到平衡状态的有___________(填标号)。
(3)在恒压条件下,按投料比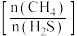 分别为
分别为 进行反应③,该反应中
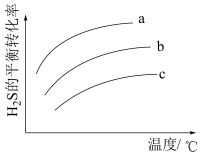
进行反应③,该反应中 的平衡转化率随温度变化如图所示,则曲线a对应的投料比为
的平衡转化率随温度变化如图所示,则曲线a对应的投料比为___________ ; 的平衡转化率随温度降低而减小的原因是
的平衡转化率随温度降低而减小的原因是_________________________________ 。
(4)在恒温( )、恒压(
)、恒压( )反应条件下,将
)反应条件下,将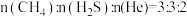 的混合气进行反应③,达到平衡时,
的混合气进行反应③,达到平衡时, 的分压与
的分压与 的分压相同。则该反应的
的分压相同。则该反应的
___________ 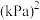 (
( 是以分压表示的平衡常数,分压=总压×物质的量分数)
是以分压表示的平衡常数,分压=总压×物质的量分数)
(5)天然气开采产生的硫化氢也可通过如图所示的电化学装置进行处理。
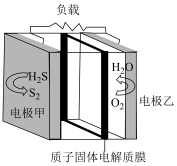
①电极甲为电池的________ (填“负极”或“正极”),该电极的电极反应式为______________________ 。
②电池工作时, 的移动方向是
的移动方向是______________________ 。(填“从左到右”或“从右到左”)
回答下列问题:
(1)已知下列反应的热化学方程式:
①
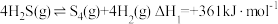 ;
;②
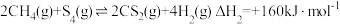
则反应③
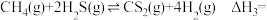
(2)下列叙述不能说明反应③达到平衡状态的有___________(填标号)。
A.形成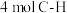 的同时断裂 的同时断裂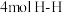 |
| B.恒温恒容条件下,体系压强不再变化 |
| C.恒温恒容条件下,气体的密度不再变化 |
| D.混合气体的平均摩尔质量不再变化 |
(3)在恒压条件下,按投料比
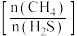 分别为
分别为 进行反应③,该反应中
进行反应③,该反应中 的平衡转化率随温度变化如图所示,则曲线a对应的投料比为
的平衡转化率随温度变化如图所示,则曲线a对应的投料比为 的平衡转化率随温度降低而减小的原因是
的平衡转化率随温度降低而减小的原因是
(4)在恒温(
 )、恒压(
)、恒压( )反应条件下,将
)反应条件下,将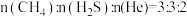 的混合气进行反应③,达到平衡时,
的混合气进行反应③,达到平衡时, 的分压与
的分压与 的分压相同。则该反应的
的分压相同。则该反应的
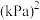 (
( 是以分压表示的平衡常数,分压=总压×物质的量分数)
是以分压表示的平衡常数,分压=总压×物质的量分数)(5)天然气开采产生的硫化氢也可通过如图所示的电化学装置进行处理。

①电极甲为电池的
②电池工作时,
 的移动方向是
的移动方向是
您最近一年使用:0次



