名校
解题方法
1 . 乙醇与水催化反应可以制得氢气。
(1)已知: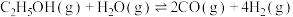
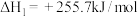 ,回答下列问题:
,回答下列问题:
①升温,平衡_______ 移动(填“向左”、“向右”、“不”);
②与原平衡相比较,增大压强,新平衡时
_______ (填“增大”、“减小”、“不变”,下同);
③恒温、恒容条件下。加入水蒸气,转化率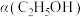
_______ ;
④恒温、恒压条件下,加入稀有气体,体积分数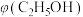
_______ 。
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I: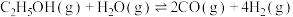
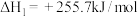
反应II:

反应III:

则
_______  。
。
(3)压强为100kPa, 的平衡产率与温度、起始时
的平衡产率与温度、起始时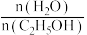 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
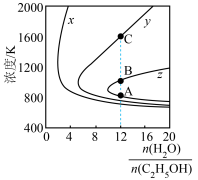
 的平衡产率:B点
的平衡产率:B点_______ C点(填“>”或“<”)。
(4)恒容条件下,将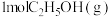 和
和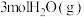 投入密闭容器中发生上述三个反应,平衡时
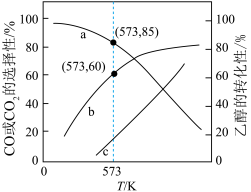
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性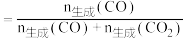 】
】
①表示乙醇转化率的曲线是_______ (填“a”、“b”或“c”)。
②573K时,反应II的压强平衡常数
_______ 。(已知:分压=总压 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
(1)已知:
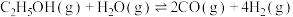
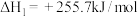 ,回答下列问题:
,回答下列问题:①升温,平衡
②与原平衡相比较,增大压强,新平衡时

③恒温、恒容条件下。加入水蒸气,转化率
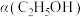
④恒温、恒压条件下,加入稀有气体,体积分数
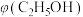
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反应I:
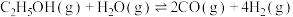
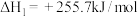
反应II:


反应III:


则

 。
。(3)压强为100kPa,
 的平衡产率与温度、起始时
的平衡产率与温度、起始时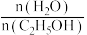 的关系如图所示,x、y、z三条曲线上的点都代表
的关系如图所示,x、y、z三条曲线上的点都代表 在不同条件下的平衡产率,且每条曲线上
在不同条件下的平衡产率,且每条曲线上 的平衡产率相同,如: A、B两点的
的平衡产率相同,如: A、B两点的 平衡产率相等,B、C两点的
平衡产率相等,B、C两点的 平衡产率不相等。
平衡产率不相等。
 的平衡产率:B点
的平衡产率:B点(4)恒容条件下,将
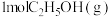 和
和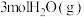 投入密闭容器中发生上述三个反应,平衡时
投入密闭容器中发生上述三个反应,平衡时 的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
的选择性、平衡时CO的选择性、平衡时乙醇的转化率随温度的变化曲线如图所示。
【已知:CO的选择性
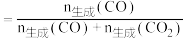 】
】①表示乙醇转化率的曲线是
②573K时,反应II的压强平衡常数

 该组分物质的量分数,计算结果保留整数。)
该组分物质的量分数,计算结果保留整数。)
您最近半年使用:0次
2023-11-14更新
|
355次组卷
|
2卷引用:重庆市第十一中学校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
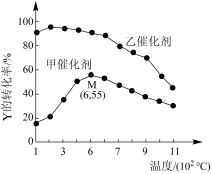
2 . 为研究反应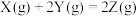 ,向一固定体积的容器中加入足量1molX和2molY发生反应。一定条件下,在甲、乙两种催化剂作用下,反应相同时间,测得Y的转化率与温度的关系如下图所示。下列说法错误的是
,向一固定体积的容器中加入足量1molX和2molY发生反应。一定条件下,在甲、乙两种催化剂作用下,反应相同时间,测得Y的转化率与温度的关系如下图所示。下列说法错误的是
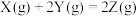 ,向一固定体积的容器中加入足量1molX和2molY发生反应。一定条件下,在甲、乙两种催化剂作用下,反应相同时间,测得Y的转化率与温度的关系如下图所示。下列说法错误的是
,向一固定体积的容器中加入足量1molX和2molY发生反应。一定条件下,在甲、乙两种催化剂作用下,反应相同时间,测得Y的转化率与温度的关系如下图所示。下列说法错误的是
| A.反应达到平衡后,恒温时,再加入少量Z,达到新平衡时Y的体积分数减小 |
| B.在相同温度下,与催化剂甲相比,乙使反应活化能更低 |
| C.M点可能是该反应的平衡点 |
| D.反应达到平衡后,恒温时,再加入少量Y,Z的体积分数减小 |
您最近半年使用:0次
名校
3 . 在温度、容积相同的3个密闭容器中,按不同方式投入反应,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 2NH3(g)
2NH3(g) 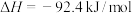 )
)
下列说法正确的是
 2NH3(g)
2NH3(g) 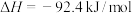 )
)| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | p1 | p2 | p3 |
| 反应物转化率 |  |  | 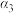 |
A. | B.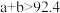 | C.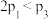 | D.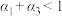 |
您最近半年使用:0次
名校
解题方法
4 . 甲烷在化学工业中应用广泛。回答下列问题:
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=_______ kJ·mol-1,升高温度,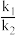
_______ (填“增大”或“减小”)。
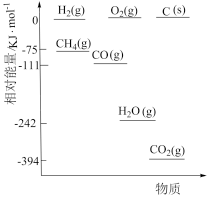
②起始物 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)_______ vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=_______ Pa,反应I以物质的量分数表示的平衡常数KxI=_______ 。

(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
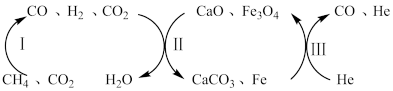
其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将_____ (填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)_______ (填“增大”、“减小”或“不变”),p(CO)_____ (填“增大”、“减小”或“不变”)。
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=
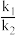

②起始物
 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。

其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将
您最近半年使用:0次
2023-03-19更新
|
934次组卷
|
3卷引用:山东省烟台市、德州市、滨州市2023届高三一模考试化学试题
山东省烟台市、德州市、滨州市2023届高三一模考试化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(原理综合题)山东省日照实验高级中学2023-2024学年高二上学期第一次阶段考试化学试题
名校
解题方法
5 . 利用丙烷(C3H8)在无氧条件下制备丙烯(C3H6)的反应方程式为:C3H8(g) C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
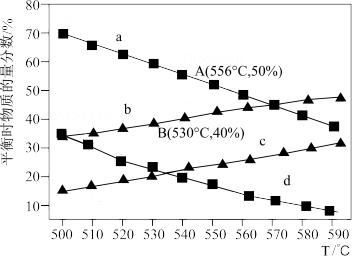
 C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
| A.c曲线表示的是0.01MPa压强下丙烯随温度变化的物质的量分数 |
| B.A点对应的该反应平衡常数Kp=1.25MPa(Kp为以分压表示的平衡常数) |
| C.B点丙烷的平衡转化率为33.3% |
| D.实际生产过程中需通入一定量水蒸气,其目的是稀释原料气,增大丙烯的平衡产率 |
您最近半年使用:0次
2022-09-04更新
|
1468次组卷
|
5卷引用:重庆市南开中学校2022-2023学年高三上学期第一次质量检测联考化学试题
重庆市南开中学校2022-2023学年高三上学期第一次质量检测联考化学试题(已下线)2022年北京高考真题变式题1-14黑龙江省牡丹江市第一高级中学2022-2023学年高二10月月考化学试题重庆市南开中学2022-2023学年高三上学期第一次质检化学试题(已下线)2022年北京高考真题化学试题变式题(选择题11-14)
解题方法
6 . 丙烯是一种重要的化工原料,可以在催化剂作用下由丙烷脱氢制备。反应原理为:
热解反应:
副反应:
请回答:
(1)已知相关键能的数据如下表所示,则:
①热解反应的
_______  。
。
②裂解气中存在浓度不低的 ,从结构角度解释度原因
,从结构角度解释度原因_______ 。
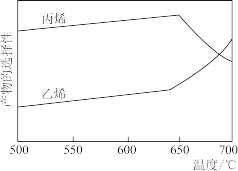
③裂解反应的选择性随温度变化如图所示,则丙烷裂解应控制温度在_______ 。
(2)恒定不同压强( 、
、 ),热解气中丙烷及丙烯的平衡物质的量分数随温度变化如图所示。
),热解气中丙烷及丙烯的平衡物质的量分数随温度变化如图所示。
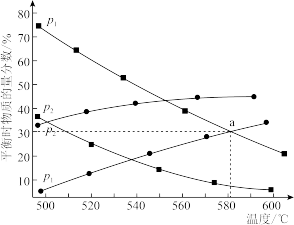
①压强:
_______  (填“>”或“<”)。
(填“>”或“<”)。
②若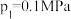 ,则
,则 点对应温度下,热解反应的平衡常数
点对应温度下,热解反应的平衡常数
_______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)向容器中通入一定量 进行丙烷氧化脱氢,可提高产物丙烯的选择性。
进行丙烷氧化脱氢,可提高产物丙烯的选择性。
①通 的好处是
的好处是_______ 。
②反应体系中会有 检出,是烃燃烧产物
检出,是烃燃烧产物 与原料气中残留的
与原料气中残留的 反应而成。研究表明在
反应而成。研究表明在 催化下,
催化下, 转化为
转化为 经两步完成,用方程式表示该转变过程
经两步完成,用方程式表示该转变过程_______ 、_______ 。
热解反应:

副反应:

请回答:
(1)已知相关键能的数据如下表所示,则:
| 化学键 |  |  |  |  |
键能/ | 348 | 615 | 413 | 436 |
①热解反应的

 。
。②裂解气中存在浓度不低的
 ,从结构角度解释度原因
,从结构角度解释度原因③裂解反应的选择性随温度变化如图所示,则丙烷裂解应控制温度在

(2)恒定不同压强(
 、
、 ),热解气中丙烷及丙烯的平衡物质的量分数随温度变化如图所示。
),热解气中丙烷及丙烯的平衡物质的量分数随温度变化如图所示。
①压强:

 (填“>”或“<”)。
(填“>”或“<”)。②若
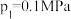 ,则
,则 点对应温度下,热解反应的平衡常数
点对应温度下,热解反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)向容器中通入一定量
 进行丙烷氧化脱氢,可提高产物丙烯的选择性。
进行丙烷氧化脱氢,可提高产物丙烯的选择性。①通
 的好处是
的好处是②反应体系中会有
 检出,是烃燃烧产物
检出,是烃燃烧产物 与原料气中残留的
与原料气中残留的 反应而成。研究表明在
反应而成。研究表明在 催化下,
催化下, 转化为
转化为 经两步完成,用方程式表示该转变过程
经两步完成,用方程式表示该转变过程
您最近半年使用:0次
名校
7 . 将2.00 mol X和1.00 mol Y充入体积不变的密闭容器中,在一定条件下发生反应:X(g)+Y(g)⇌Z(g),达到平衡时X为1.50 mol,如果此时移走1.00 mol X和0.50 mol Y,保持温度和体积不变,再次达到平衡时,X的物质的量可能为
| A.0.75 mol | B.0.55 mol | C.0.80 mol | D.1.00 mol |
您最近半年使用:0次
2021-02-04更新
|
804次组卷
|
2卷引用:河南省2020-2021学年高二上学期期末考试化学试题
名校
8 . 在容积可变的密闭容器中充入2mol A和1mol B发生反应:mA(g) + nB(g)  pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是

 pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
| A.维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min) |
| B.P从2×105Pa增加到5×105Pa时,平衡逆向移动 |
C.P为1×106Pa时,平衡常数表达式K=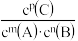 |
D.其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示 |
您最近半年使用:0次
2018-12-05更新
|
2323次组卷
|
3卷引用:【全国百强校】云南省玉溪市第一中学2018-2019学年高二上学期期中考试化学试题
2011高三·全国·竞赛
9 . NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g) 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了_______ 倍。
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?____________ 为什么?_______________
 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?
您最近半年使用:0次



