名校
解题方法
1 . 合成氨是人工固氮比较成熟的技术,在工业上有重要的用途。
(1)已知化学键的键能如下表,则
___________ 。
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是___________ 。
①体系压强保持不变
②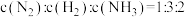
③每消耗 ,有
,有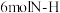 键发生断裂
键发生断裂
④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变
⑥
(3)合成氨反应的平衡常数与温度的对应关系如下表:
试解释平衡常数随温度的升高而减小的原因___________ 。工业上合成氨一般以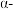 铁触媒为催化剂,
铁触媒为催化剂,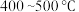 条件下反应,选取该反应温度而非室温或更高温度的原因是
条件下反应,选取该反应温度而非室温或更高温度的原因是___________ 。
(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的 与
与 后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲
后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲___________ 乙(填“>”、“<”或“=”)。反应达平衡后向甲容器中再充入一定量的 ,则甲容器中
,则甲容器中 的转化率
的转化率___________ (填“增大”、“减小”或“不变”)。
(5)肼 又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为
又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为___________ 。

(1)已知化学键的键能如下表,则

| 化学键 |  |  |  |  |
键能/ | 435.9 | 946.5 | 391.1 | 192.8 |
①体系压强保持不变
②
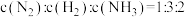
③每消耗
 ,有
,有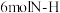 键发生断裂
键发生断裂④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变
⑥

(3)合成氨反应的平衡常数与温度的对应关系如下表:
温度( ) ) | 25 | 400 | 450 |
| 平衡常数 | 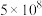 | 0.507 | 0.152 |
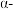 铁触媒为催化剂,
铁触媒为催化剂,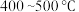 条件下反应,选取该反应温度而非室温或更高温度的原因是
条件下反应,选取该反应温度而非室温或更高温度的原因是(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的
 与
与 后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲
后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲 ,则甲容器中
,则甲容器中 的转化率
的转化率(5)肼
 又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为
又称联氨可看成是氨气中的氢原子被氨基取代后的产物,常用作火箭的液体燃料。肼燃料电池的原理如图所示,则负极发生的电极反应式为
您最近半年使用:0次
名校
2 . 合成氨是人工固氮比较成熟的技术,在工业上有重要的用途。
(1)已知化学键的键能如下表,
_______ 。
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是_______ 。
①体系压强保持不变
②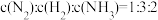
③每消耗 ,有
,有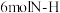 键发生断裂
键发生断裂
④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变
⑥v正(NH3)=0
(3)合成氨反应的平衡常数与温度的对应关系如下表:
试解释平衡常数随温度的升高而减小的原因_______ 。工业上合成氨一般以α-铁触媒为催化剂,400~500℃条件下反应,选取该反应温度而非室温或更高温度的原因是_______ 。
(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的N2与H2后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲_______ 乙(填“>”、“<”或“=”)。
(1)已知化学键的键能如下表,

| 化学键 | H-H | N≡N | N-H | N-N |
| 键能(kJ·mol-1) | 435.9 | 946.5 | 391.1 | 192.8 |
(2)恒温条件下,在体积固定的容器中发生合成氨的反应,下列叙述表明反应已达平衡状态的是
①体系压强保持不变
②
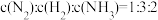
③每消耗
 ,有
,有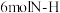 键发生断裂
键发生断裂④混合气体的密度保持不变
⑤混合气体的平均摩尔质量保持不变
⑥v正(NH3)=0
(3)合成氨反应的平衡常数与温度的对应关系如下表:
| 温度(℃) | 25 | 400 | 450 |
| 平衡常数 | 5×108 | 0.507 | 0.152 |
试解释平衡常数随温度的升高而减小的原因
(4)在恒温条件下实验室模拟合成氨反应,甲、乙两容器充入相同量的N2与H2后体积相同,甲容器保持体积不变,乙容器保持压强不变,则反应到达平衡状态时,转化率甲
您最近半年使用:0次
解题方法
3 . CO2可用于制备CH4、合成气(CO、H2),是CO2资源化利用的重要途径。
(1)CO2甲烷化过程可能发生反应:
i.
ii.
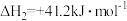
iii.
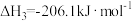
①
___________  。
。
②利用不同催化剂,在一定温度和反应时间条件下,测得产物的生成速率与催化剂的关系如图1.可知有利于制甲烷的催化剂是___________ 。
③压强一定时,按照 投料,发生上述反应,
投料,发生上述反应, 的平衡转化率与温度的关系如图2。
的平衡转化率与温度的关系如图2。
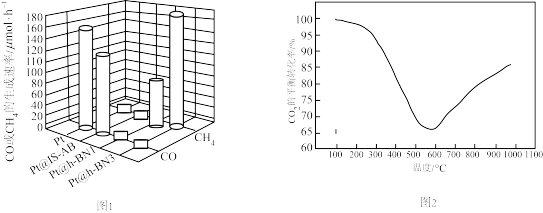
请解释温度高于600℃之后,随着温度升高 转化率增大的原因
转化率增大的原因___________ 。
(2)利用CO、 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
①由此可知,P1_____ P2(填“大于”或“小于”)。有利于提高CO平衡转化率的措施是______ 。
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为_____ ,该反应的压强平衡常数Kp=_______ (kPa)2(用分压代替浓度,分压=总压×该组分物质的量分数,用P2的式子表示)。
(1)CO2甲烷化过程可能发生反应:
i.

ii.

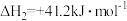
iii.

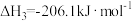
①

 。
。②利用不同催化剂,在一定温度和反应时间条件下,测得产物的生成速率与催化剂的关系如图1.可知有利于制甲烷的催化剂是
③压强一定时,按照
 投料,发生上述反应,
投料,发生上述反应, 的平衡转化率与温度的关系如图2。
的平衡转化率与温度的关系如图2。
请解释温度高于600℃之后,随着温度升高
 转化率增大的原因
转化率增大的原因(2)利用CO、
 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:| 温度/℃ 转化率 压强/kPa | 50 | 100 | 150 | 200 | 250 | 300 |
| P1 | 0.82 | 0.70 | 0.34 | 0.12 | 0.04 | 0.02 |
| P2 | 0.90 | 0.86 | 0.76 | 0.48 | 0.20 | 0.10 |
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为
您最近半年使用:0次
名校
4 . 右图表示某可逆反应:N2(g)+3H2(g) 2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
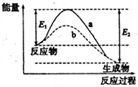
 2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
| A.反应物的总键能小于生成物的总键能 |
| B.如果对上述反应加压,平衡正向移动,△H减小 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.a与b相比,a的反应速率更快 |
您最近半年使用:0次
2017-12-04更新
|
226次组卷
|
2卷引用:山东省青岛市城阳区2018届高三上学期期中学分认定考试化学试题
名校
5 . NH3是世界上产量最多的无机化合物之一,具有广泛的用途。工业上通常用N2和H2来合成NH3。
(1)已知:i.H2的燃烧热为-285.8kJ•mol-1
ii.N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1
iii.4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-1170kJ•mol-1
工业合成氨的热化学方程式为______ ;在恒温恒容密闭容器中进行合成氨的反应,下列不能说明反应已达到平衡状态的是______ 。
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.N2百分含量保持不变
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:______ T2(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是:_______ 。
③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是______ 。
(3)恒温下,向一个4L的恒容密闭容器中充入1.8molN2和4.2molH2,反应过程中对NH3的浓度进行检测。
①20min后,反应达平衡,氨气的浓度为0.3mol•L-1,用N2表示的平均反应速率为______ mol•L-1•min-1。且此时,混合气体的总压强为p,则该反应的化学平衡常数Kp=_______ (对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p•x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
②若维持容器的体积不变,温度不变,向原平衡体系中再加入1.8molN2和4.2molH2,再次达平衡后,氨气的浓度_______ 0.6mol/L(填“大于”或“小于”或“等于”)。
(1)已知:i.H2的燃烧热为-285.8kJ•mol-1
ii.N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1
iii.4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-1170kJ•mol-1
工业合成氨的热化学方程式为
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.N2百分含量保持不变
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:

②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是:
③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是
(3)恒温下,向一个4L的恒容密闭容器中充入1.8molN2和4.2molH2,反应过程中对NH3的浓度进行检测。
①20min后,反应达平衡,氨气的浓度为0.3mol•L-1,用N2表示的平均反应速率为
②若维持容器的体积不变,温度不变,向原平衡体系中再加入1.8molN2和4.2molH2,再次达平衡后,氨气的浓度
您最近半年使用:0次
6 . 金属钛(Ti)在航空航天,医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
ⅰ.直接氯化法:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1>0 Kpl
ⅱ.碳氯化法:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2<0 Kp2
①反应2C(s)+O2(g)=2CO(g) △H3 Kp3,则△H3=______ (用含△H1、△H2的代数式表示),Kp3=______ (用含Kp1,Kp2的代数式表示),____ (填“低温”“高温”或“任意温度”)有利于该反应自发进行。
②对于直接氯化法:仅增大压强,平衡_______ (填“向左”“向右”或“不”)移动;仅升高温度,Cl2(g)平衡转化率_______ (填“变大”“变小”或“不变”)。
(2)在压强为170kPa恒压作用下,将TiO2(s)、C(s)、Cl2(g)以物质的量之比为1:2.2:2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
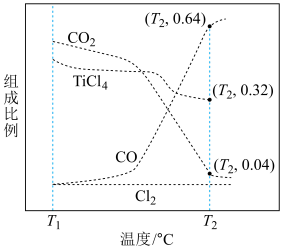
①原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为______ 。
②反应C(s)+CO2(g)=2CO(g)的平衡常数Kp(T2℃)=______ kPa(分压=物质的量分数×总压)。
(3)查阅资料可知:Kp2>Kp1,即碳氯化法的反应趋势远大于直接氯化法,其原因为___________ 。
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
ⅰ.直接氯化法:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1>0 Kpl
ⅱ.碳氯化法:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2<0 Kp2
①反应2C(s)+O2(g)=2CO(g) △H3 Kp3,则△H3=
②对于直接氯化法:仅增大压强,平衡
(2)在压强为170kPa恒压作用下,将TiO2(s)、C(s)、Cl2(g)以物质的量之比为1:2.2:2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态钛原子,其价电子自旋磁量子数的代数和为②反应C(s)+CO2(g)=2CO(g)的平衡常数Kp(T2℃)=
(3)查阅资料可知:Kp2>Kp1,即碳氯化法的反应趋势远大于直接氯化法,其原因为
您最近半年使用:0次
名校
7 . CO2的资源化利用意义重大,其主要产品——甲醇可用于生产二甲醚,二甲醚在日用化工、制药、农药、染料、涂料等方面有广泛的用途。
该反应体系中涉及以下两个主要反应:
主反应: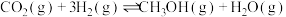
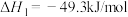
副反应:

(1)已知25℃和101kPa下, 、
、 的燃烧热
的燃烧热 分别为
分别为 、
、 ,
,
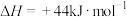 ,则
,则
___________ kJ/mol。
(2)在CO2加氢制甲醇的体系中,下列说法错误的是___________ 。
a.增大初始投料比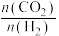 ,有利于提高CO2的转化率
,有利于提高CO2的转化率
b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.平衡后,压缩容器体积,主反应平衡正向移动,副反应平衡不移动
d.选用合适的催化剂可提高CO2的平衡转化率
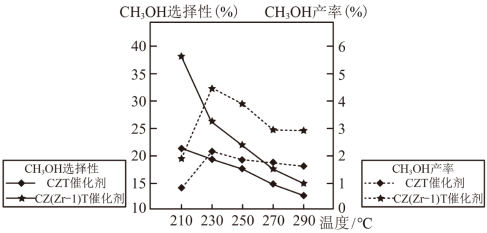
(3)不同条件下,相同的时间段内CH3OH的选择性和产率随温度的变化如图。
CH3OH选择性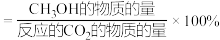
①由图可知,合成甲醇的适宜条件为___________ (填标号)。
A.C2T催化剂 B.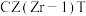 催化剂 C.230℃ D.290℃
催化剂 C.230℃ D.290℃
②在230℃以上,升高温度,CO2的平衡转化率增大,但甲醇的产率降低,原因是___________ 。
(4)在某密闭容器中充入 的混合气体,于5.0MPa和催化剂作用下发生反应,平衡时CO和CH3OH在含碳产物中物质的量百分数及CO2的转化率随温度的变化如图所示。
的混合气体,于5.0MPa和催化剂作用下发生反应,平衡时CO和CH3OH在含碳产物中物质的量百分数及CO2的转化率随温度的变化如图所示。
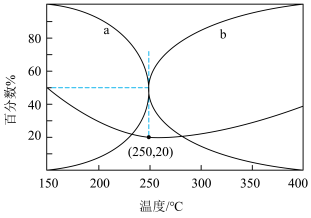
①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是___________ (填“a”或“b”)。
②250℃时副反应 的Kp=
的Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
该反应体系中涉及以下两个主要反应:
主反应:
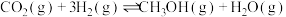
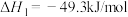
副反应:


(1)已知25℃和101kPa下,
 、
、 的燃烧热
的燃烧热 分别为
分别为 、
、 ,
,
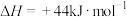 ,则
,则
(2)在CO2加氢制甲醇的体系中,下列说法错误的是
a.增大初始投料比
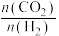 ,有利于提高CO2的转化率
,有利于提高CO2的转化率b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.平衡后,压缩容器体积,主反应平衡正向移动,副反应平衡不移动
d.选用合适的催化剂可提高CO2的平衡转化率
(3)不同条件下,相同的时间段内CH3OH的选择性和产率随温度的变化如图。

CH3OH选择性
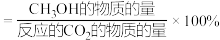
①由图可知,合成甲醇的适宜条件为
A.C2T催化剂 B.
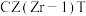 催化剂 C.230℃ D.290℃
催化剂 C.230℃ D.290℃②在230℃以上,升高温度,CO2的平衡转化率增大,但甲醇的产率降低,原因是
(4)在某密闭容器中充入
 的混合气体,于5.0MPa和催化剂作用下发生反应,平衡时CO和CH3OH在含碳产物中物质的量百分数及CO2的转化率随温度的变化如图所示。
的混合气体,于5.0MPa和催化剂作用下发生反应,平衡时CO和CH3OH在含碳产物中物质的量百分数及CO2的转化率随温度的变化如图所示。
①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是
②250℃时副反应
 的Kp=
的Kp=
您最近半年使用:0次
名校
解题方法
8 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石TiO2 转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=172kJ∙mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2=-51kJ∙mol-1,Kp2=1.2×1012Pa
①反应2C(s)+O2(g)=2CO(g)的H 为___________ kJ mol-1, Kp =___________ Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是___________ 。
③对于碳氯化反应:增大压强,平衡___________ 移动(填“向左”“向右”或“不”);温度升高,平衡转化率___________ (填“变大”“变小”或“不变”)。
(2)在1.0 105 Pa ,将TiO2、C、Cl2以物质的量比 1∶2.2∶2 进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
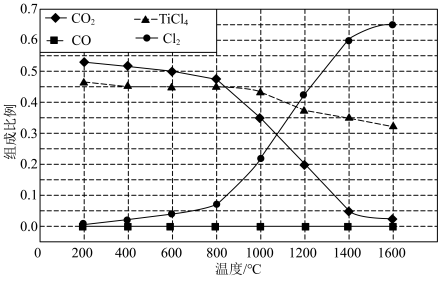
图中显示,在200℃平衡时TiO2 几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是___________ 。
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2 C “固—固”接触的措施是________ 。
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(i)直接氯化:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=172kJ∙mol-1,Kp1=1.0×10-2
(ii)碳氯化:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H2=-51kJ∙mol-1,Kp2=1.2×1012Pa
①反应2C(s)+O2(g)=2CO(g)的H 为
②碳氯化的反应趋势远大于直接氯化,其原因是
③对于碳氯化反应:增大压强,平衡
(2)在1.0 105 Pa ,将TiO2、C、Cl2以物质的量比 1∶2.2∶2 进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

图中显示,在200℃平衡时TiO2 几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2 C “固—固”接触的措施是
您最近半年使用:0次
解题方法
9 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_______ 。该反应需要在加压下进行,原因是_______ 。
(2)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_______ 。
(3)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
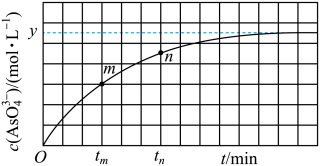
①下列可判断反应达到平衡的是_______ (填标号)。
a.溶液的pH不再变化 b.v(I−)=2v( )
)
c. c( )/c(
)/c( )不再变化 d. c(I−)=y mol·L−1
)不再变化 d. c(I−)=y mol·L−1
②tm时v逆_______ tn时v逆(填“大于”“小于”或“等于”),理由是_______ 。
③tm若平衡时溶液的pH=14,则该反应的平衡常数K为_______ 。
(1)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(2)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH22As(s)+
 O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
(3)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I−)=2v(
 )
)c. c(
 )/c(
)/c( )不再变化 d. c(I−)=y mol·L−1
)不再变化 d. c(I−)=y mol·L−1②tm时v逆
③tm若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近半年使用:0次
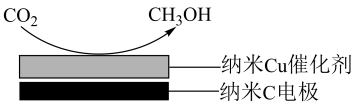
10 . 甲醇是重要的化上原料,研究甲醇的制备及用途在工业上有重要的意义。回答下列问题:
(1)一种重要的工业制备甲醇的反应为
 。
。
已知:①

②
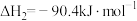
该制备反应的
______ 。升高温度,该制备反应的 的平衡转化率
的平衡转化率______ (填“增大”“减小”或“不变”)。
(2)已知反应 的
的 ,
, ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
在540K下,按初始投料比 、
、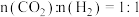 、
、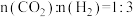 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
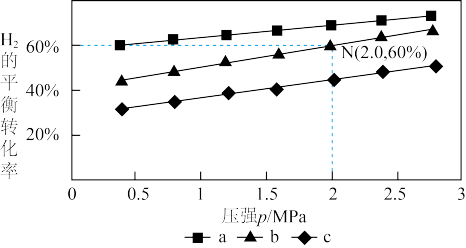
①a、b、c各曲线所表示的投料比由大到小的顺序为______ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数
______  (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻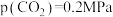 ,
, ,
,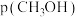
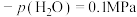 ,此时
,此时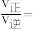
______ (保留两位小数)。
(3)甲醇催化可制取丙烯,反应为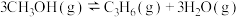 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能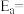
______  。
。
(4)Kistiakowsky曾研究了NOCl光化学分解反应。在一定频率(v)光的照射下,反应的机理为:
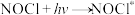

其中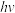 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。则吸收1mol光子可分解
表示NOCl的激发态。则吸收1mol光子可分解______ mol NOCl。
(5)在饱和 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 ,其原理如图所示,则阴极的电极反应式为
,其原理如图所示,则阴极的电极反应式为______ 。
(1)一种重要的工业制备甲醇的反应为

 。
。已知:①


②

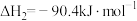
该制备反应的

 的平衡转化率
的平衡转化率(2)已知反应
 的
的 ,
, ,其中
,其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。
分别为正、逆反应速率常数,p为气体分压(分压=总压/物质的量分数)。在540K下,按初始投料比
 、
、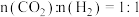 、
、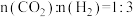 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
①a、b、c各曲线所表示的投料比由大到小的顺序为
②N点在b曲线上,540K时的压强平衡常数

 (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。③540K条件下,某容器测得某时刻
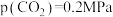 ,
, ,
,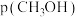
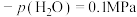 ,此时
,此时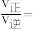
(3)甲醇催化可制取丙烯,反应为
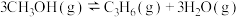 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能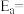
 。
。
(4)Kistiakowsky曾研究了NOCl光化学分解反应。在一定频率(v)光的照射下,反应的机理为:
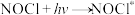

其中
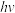 表示一个光子能量,
表示一个光子能量, 表示NOCl的激发态。则吸收1mol光子可分解
表示NOCl的激发态。则吸收1mol光子可分解(5)在饱和
 电解液中,电解活化的
电解液中,电解活化的 也可以制备
也可以制备 ,其原理如图所示,则阴极的电极反应式为
,其原理如图所示,则阴极的电极反应式为
您最近半年使用:0次



