1 . 下列方案设计、现象和结论都正确的是
| 实验 | 目的 | 方案设计 | 现象和结论 |
| ① | 探究压强对 与 与 平衡的影响 平衡的影响 | 快速压缩装有 、 、 平衡混合气体的针筒 平衡混合气体的针筒 | 如果气体颜色变深,则增大压强,平衡向生成 的方向移动 的方向移动 |
| ② | 探究 与 与 氧化性的强弱 氧化性的强弱 | 向 和 和 的混合溶液中滴入 的混合溶液中滴入 酸化的 酸化的 溶液 溶液 | 溶液变红,说明氧化性: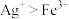 |
| ③ | 验证 溶液中存在水解平衡 溶液中存在水解平衡 | 取2  溶液于试管中,加2滴酚酞,再加入少量 溶液于试管中,加2滴酚酞,再加入少量 固体 固体 | 如果溶液红色变浅,则 溶液中存在水解平衡 溶液中存在水解平衡 |
| ④ | 相同温度下,比较 与 与 的酸性强弱 的酸性强弱 | 向等体积的水中分别通入 、 、 至饱和,再用 至饱和,再用 计测定两种溶液的 计测定两种溶液的 | 如果通 后所得溶液的 后所得溶液的 小,则 小,则 的酸性比弱 的酸性比弱 |
| A.① | B.② | C.③ | D.④ |
您最近半年使用:0次
2 . 卤素化合物在生产生活中应用广泛,回答下列问题
(1)研究表明 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: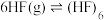 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是____________ ;在测定 相对分子质量的实验中,
相对分子质量的实验中,____________ (填“低压”或“高压”)有利于测定的准确性.
(2) 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为__________ ;产物中的另一种气体可以起到的作用是________________ .
(3) 与
与 以共价键形成
以共价键形成 ,其中
,其中________ 显负电性, 与水反应的方程式是
与水反应的方程式是____________ .
(4)利用 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: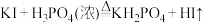 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:________ (“强酸性”“强氧化性”“高沸点”).
(1)研究表明
 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: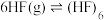 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是 相对分子质量的实验中,
相对分子质量的实验中,(2)
 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为(3)
 与
与 以共价键形成
以共价键形成 ,其中
,其中 与水反应的方程式是
与水反应的方程式是(4)利用
 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: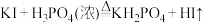 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:
您最近半年使用:0次
3 . 室温下,下列实验方案不能达到探究目的的是
| 选项 | 实验方案 | 探究目的 |
| A | 向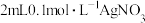 溶液中先滴加4滴 溶液中先滴加4滴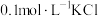 溶液,再滴加4滴 溶液,再滴加4滴 溶液,观察生成沉淀的颜色 溶液,观察生成沉淀的颜色 | 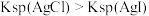 |
| B | 用注射器收集一定体积 气体,连接色度传感器,通过抽拉活塞改变气体体积,记录体系中气体颜色变化 气体,连接色度传感器,通过抽拉活塞改变气体体积,记录体系中气体颜色变化 | 探究压强对化学平衡的影响 |
| C | 向溶有 的 的 溶液中加入 溶液中加入 溶液,观察生成沉淀的情况 溶液,观察生成沉淀的情况 |  在酸性条件下具有强氧化性 在酸性条件下具有强氧化性 |
| D | 向盛有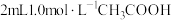 溶液的试管中滴加 溶液的试管中滴加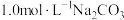 溶液,观察气泡产生的情况 溶液,观察气泡产生的情况 | 探究 的 的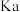 与 与 的 的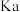 大小 大小 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
4 . 下列陈述Ⅰ与陈述Ⅱ均正确,且两者存在因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 将稀硝酸加入过量铁粉中充分反应后,滴加KSCN溶液后无明显现象 | 稀硝酸有氧化性,只能将Fe氧化为 |
| B | 已知反应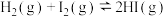 ,压缩体积可观察到体系颜色加深 ,压缩体积可观察到体系颜色加深 | 改变压强可使化学平衡发生移动 |
| C | 用熟石灰处理酸性废水 | 熟石灰中含有 |
| D | 用pH计测定相同浓度的 、NaCl溶液,测得 、NaCl溶液,测得 溶液的pH大于NaCl溶液 溶液的pH大于NaCl溶液 | 比较酸性: |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
5 . 在下列实验中,解释或结论正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向某无色溶液中加入稀盐酸 | 生成的无色气体能使品红褪色 | 该无色溶液中存在 |
| B | 向FeBr3溶液中加入足量H2O2 | 生成大量气泡 | FeBr3作氧化剂且氧化性: Fe3+>H2O2 |
| C | 一定温度下,向某容器中充入HI气体,一段时间后压缩容器体积为原来的一半 | 气体颜色变深 | 气体压强增大使平衡正向移动 |
| D | 将溴乙烷制备乙烯生成的气体依次通过足量蒸馏水、酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙烯能被酸性高锰酸钾氧化 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
6 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用铜电极电解饱和KCl溶液 | 有气体生成 | Cl-的失电子能力比OH-强 |
| B | Cl2通入石蕊试液 | 溶液先变红后褪色 | Cl2具有酸性和漂白性 |
| C | 对H2(g)+I2(g) 2HI(g)的平衡体系加压 2HI(g)的平衡体系加压 | 气体颜色加深 | 加压平衡向生成I2(g)的方向移动 |
| D | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,并有黑色颗粒产生 | CO2具氧化性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2020-07-26更新
|
110次组卷
|
2卷引用:河南省驻马店市2019-2020学年高二下学期期末考试化学试题
名校
解题方法
7 . (1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
由此计算上述反应的反应热△H=___________ kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________ (用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________ ,O2的转化率为___________ (用百分数表示,且保留小数点后一位),该反应的平衡常数为___________ (列出计算式即可)。
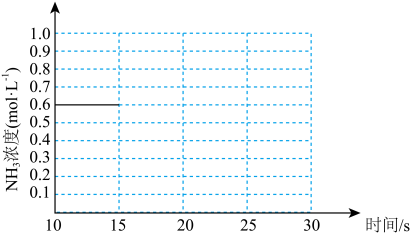
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________
(3)下列有关该反应的说法正确的是___________ (填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________ 。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查阅资料可得有关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。

(3)下列有关该反应的说法正确的是
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:
您最近半年使用:0次
2019-02-07更新
|
472次组卷
|
3卷引用:【市级联考】山西省晋中市2019届高三上学期1月高考适应性考试理科综合化学试题
2019高三·全国·专题练习
8 . (1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,从而减少SO2的排放,但产生的CO又会与CaSO4发生化学反应,从而降低脱硫效率。相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)ΔH1=+210.5 kJ·mol-1
CaO(s)+SO2(g)+CO2(g)ΔH1=+210.5 kJ·mol-1
② CaSO4(s)+CO(g)
CaSO4(s)+CO(g) 
 CaS(s)+CO2(g) ΔH2=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH2=-47.3 kJ·mol-1
请回答下列问题:
反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ΔH3=
CaS(s)+3CO2(g) ΔH3=________ kJ•mol-1;平衡时增大压强,此反应________ (填“正向”“逆向”或“不”)移动。
(2)有机物加氢反应中镍是常用的催化剂,但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
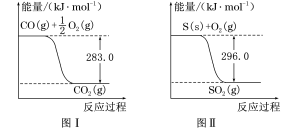
则:①不用通入O2氧化的方法除去CO的原因是_______________________ 。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=____________ 。
(3)汽车发动机工作时会引发N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,其能量变化示意图如下:
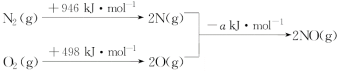
则NO中氮氧键的键能为____________ kJ·mol-1。
①CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g)ΔH1=+210.5 kJ·mol-1
CaO(s)+SO2(g)+CO2(g)ΔH1=+210.5 kJ·mol-1 ②
 CaSO4(s)+CO(g)
CaSO4(s)+CO(g) 
 CaS(s)+CO2(g) ΔH2=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH2=-47.3 kJ·mol-1请回答下列问题:
反应CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g) ΔH3=
CaS(s)+3CO2(g) ΔH3=(2)有机物加氢反应中镍是常用的催化剂,但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:

则:①不用通入O2氧化的方法除去CO的原因是
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=
(3)汽车发动机工作时会引发N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,其能量变化示意图如下:

则NO中氮氧键的键能为
您最近半年使用:0次
名校
解题方法
9 . 氮元素广泛存在于自然界中,对人类生产和生活具有重要意义。
(1)铵态氮肥为何不能与碱性物质混用_______ 。
(2)在合成氨工业中,压强通常控制在20~50MP,其原因是_______ 。
(3)常温下,在氯化铵溶液中加入一定量的氢氧化钠至恰好完全反应,此时溶液中的离子浓度由大到小的顺序_______ 。
(4)用氨气处理氮氧化物是一种常见的大气污染治理方法,其反应方程式为:4NH3+6NO=5N2+6H2O,为了使该反应发生得更有效率,将该反应设计成电解池,以惰性电极为阴、阳极,以NaOH溶液为电解液,则阳极的电极方程式为_______ 。
(5)N2H4易溶于水,是与氨相类似的弱碱,已知其常温下电离常数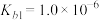 ,常温下,将0.2mol∙L-1N2H4∙H2O与0.1mol∙L-1盐酸等体积混合(忽略体积变化),则此时溶液的pH约等于
,常温下,将0.2mol∙L-1N2H4∙H2O与0.1mol∙L-1盐酸等体积混合(忽略体积变化),则此时溶液的pH约等于_______ (忽略N2H4的二级电离)
(1)铵态氮肥为何不能与碱性物质混用
(2)在合成氨工业中,压强通常控制在20~50MP,其原因是
(3)常温下,在氯化铵溶液中加入一定量的氢氧化钠至恰好完全反应,此时溶液中的离子浓度由大到小的顺序
(4)用氨气处理氮氧化物是一种常见的大气污染治理方法,其反应方程式为:4NH3+6NO=5N2+6H2O,为了使该反应发生得更有效率,将该反应设计成电解池,以惰性电极为阴、阳极,以NaOH溶液为电解液,则阳极的电极方程式为
(5)N2H4易溶于水,是与氨相类似的弱碱,已知其常温下电离常数
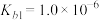 ,常温下,将0.2mol∙L-1N2H4∙H2O与0.1mol∙L-1盐酸等体积混合(忽略体积变化),则此时溶液的pH约等于
,常温下,将0.2mol∙L-1N2H4∙H2O与0.1mol∙L-1盐酸等体积混合(忽略体积变化),则此时溶液的pH约等于
您最近半年使用:0次
10 . 下列实验中,对现象的解释正确的是
| 选项 | A | B | C | D |
| 装置及操作 |  装有  的密闭注射器向右轻轻推动活塞压缩体积 的密闭注射器向右轻轻推动活塞压缩体积 | 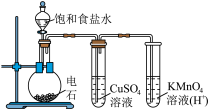 制备乙炔 |  用pH计分别测定饱和  溶液和饱和 溶液和饱和 溶液的pH 溶液的pH | 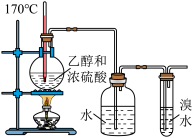 制备乙烯时迅速升温到170℃ |
| 现象 | 气体红棕色先变深再变浅 | 酸性高锰酸钾溶液褪色 | 前者的pH较小 | 溴水褪色 |
| 解释 | 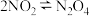 压强增大,平衡先逆向移动,再正向移动 | 乙炔具有还原性 | 酸性: | 制得的气体是乙烯 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



