解题方法
1 . 氢能和液态甲醇(CH3OH)的应用是新时代背景下发展绿色能源的重要路线之一。回答下列问题:
(1)一种催化电解法制取甲醇的原理如图所示:
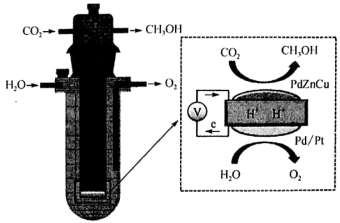
装置工作时,H+向_______ (填“阴”或“阳”)极迁移,PdZnCu极上发生的电极反应式为_______ 。
(2)CO2与H2合成甲醇主要包括的反应如下(不考虑其他反应):
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2>0
①CO2和H2在某催化剂表面上合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。
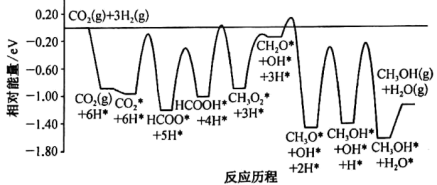
反应I的△H1_______ 0(填“>”或“<”);该历程中最小能垒(活化能)步骤的化学方程式为_______ 。
②下列有利于提高CH3OH的平衡产率的是_______ (填字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
③起始时n(CO2):n(H2)=1:10,维持恒压36 MPa时,甲醇的选择性(生成甲醇所用的含碳反应物的物质的量与总消耗的含碳反应物的物质的量的比值)、CO2的转化率、CO的选择性(生成CO所用的含碳反应物的物质的量与总消耗的含碳反应物的物质的量的比值)随温度(T)变化如图所示:

温度高于260℃时,随温度升高,CO的选择性增大的主要原因是_______ ;T℃时,CO2的转化率为α,CH3OH的选择性为S,CO的分压p(CO)=_______ MPa。
(1)一种催化电解法制取甲醇的原理如图所示:

装置工作时,H+向
(2)CO2与H2合成甲醇主要包括的反应如下(不考虑其他反应):
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2>0
①CO2和H2在某催化剂表面上合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。

反应I的△H1
②下列有利于提高CH3OH的平衡产率的是
A.高温低压 B.低温高压 C.高温高压 D.低温低压
③起始时n(CO2):n(H2)=1:10,维持恒压36 MPa时,甲醇的选择性(生成甲醇所用的含碳反应物的物质的量与总消耗的含碳反应物的物质的量的比值)、CO2的转化率、CO的选择性(生成CO所用的含碳反应物的物质的量与总消耗的含碳反应物的物质的量的比值)随温度(T)变化如图所示:

温度高于260℃时,随温度升高,CO的选择性增大的主要原因是
您最近半年使用:0次
2 . 三甲胺N(CH3)3是重要的化工原料。我国科学家实现了使用铜催化剂将N,N﹣二甲基甲酰胺[(CH3)2NCHO,简称DMF]转化为三甲胺的合成路线。结合实验与计算机模拟结果,研究单个DMF分子在铜催化剂表面的反应历程如图所示(*装示物质吸附在铜催化剂上)。下列说法错误的是
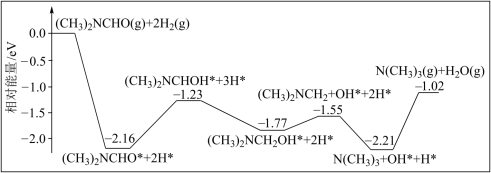

| A.增大压强可以增大DMF的平衡转化率 |
| B.该历程中的最大能垒(活化能)为1.19eV |
| C.若1mol DMF完全转化为三甲胺,则会释放出1.02eV的能量 |
| D.铜催化剂的作用之一是吸附反应物形成更稳定的反应中间体 |
您最近半年使用:0次
名校
解题方法
3 . (一)一种工业制硝酸的方法经历下列几个步骤:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H1<0
4NO(g)+6H2O(g) △H1<0
2NO(g)+O2(g) 2NO2(g) △H2<0
2NO2(g) △H2<0
3NO2(g)+H2O(l)=NO(g)+2HNO3(aq) △H3<0
已知:NO在1000℃以上会发生分解反应。
(1)工业生产中未直接在一个设备中将NH3催化氧化至NO2,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有________ 的目的。
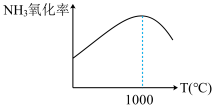
(2)实验发现,单位时间内NH3的氧化率[n(NO)生成/n(NH3)原料]会随着温度的升高先增大后减小(如图所示),分析1000℃后NH3的氧化率减小的主要原因是________ 。

(3)2NO(g)+O2(g) 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g) N2O2(g)(快) △H1<0 v1正=k1正•c²(NO) v1逆=k1逆•c(N2O2);
N2O2(g)(快) △H1<0 v1正=k1正•c²(NO) v1逆=k1逆•c(N2O2);
反应II:N2O2(g)+O2(g) 2NO2(g)(慢) △H2<0 v2正=k2正•c(N2O2)•c(O2) v2逆=k2逆•c2(NO2)。
2NO2(g)(慢) △H2<0 v2正=k2正•c(N2O2)•c(O2) v2逆=k2逆•c2(NO2)。
①一定条件下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,平衡常数K=
2NO2(g)达到平衡状态,平衡常数K=________ (用含k1正、k1逆、k2正、k2逆的代数式表示)。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数________ k2逆增大的倍数(填“大于”“小于”或“等于”)。
(二)工业上也可以直接由N2O4合成HNO3,其中最关键的步骤为2NO2(g) N2O4(g),利用现代手持技术传感器可以探究压强对该平衡的影响。
N2O4(g),利用现代手持技术传感器可以探究压强对该平衡的影响。
在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
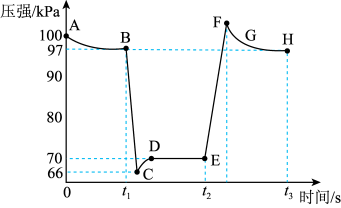
(4)有关该过程说法正确的是________ 。
a.E、H两点对应的的NO2体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
e.图像中C、E两点气体平均摩尔质量最大的点为C
(5)求B点NO2的转化率为________ 。
4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H1<0
4NO(g)+6H2O(g) △H1<02NO(g)+O2(g)
 2NO2(g) △H2<0
2NO2(g) △H2<03NO2(g)+H2O(l)=NO(g)+2HNO3(aq) △H3<0
已知:NO在1000℃以上会发生分解反应。
(1)工业生产中未直接在一个设备中将NH3催化氧化至NO2,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有
(2)实验发现,单位时间内NH3的氧化率[n(NO)生成/n(NH3)原料]会随着温度的升高先增大后减小(如图所示),分析1000℃后NH3的氧化率减小的主要原因是

(3)2NO(g)+O2(g)
 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:反应I:2NO(g)
 N2O2(g)(快) △H1<0 v1正=k1正•c²(NO) v1逆=k1逆•c(N2O2);
N2O2(g)(快) △H1<0 v1正=k1正•c²(NO) v1逆=k1逆•c(N2O2);反应II:N2O2(g)+O2(g)
 2NO2(g)(慢) △H2<0 v2正=k2正•c(N2O2)•c(O2) v2逆=k2逆•c2(NO2)。
2NO2(g)(慢) △H2<0 v2正=k2正•c(N2O2)•c(O2) v2逆=k2逆•c2(NO2)。①一定条件下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,平衡常数K=
2NO2(g)达到平衡状态,平衡常数K=②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数
(二)工业上也可以直接由N2O4合成HNO3,其中最关键的步骤为2NO2(g)
 N2O4(g),利用现代手持技术传感器可以探究压强对该平衡的影响。
N2O4(g),利用现代手持技术传感器可以探究压强对该平衡的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

(4)有关该过程说法正确的是
a.E、H两点对应的的NO2体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
e.图像中C、E两点气体平均摩尔质量最大的点为C
(5)求B点NO2的转化率为
您最近半年使用:0次
解题方法
4 . 液态的 可作制冷剂,
可作制冷剂, 还可用于制造铵态(
还可用于制造铵态( )氮肥和硝态(
)氮肥和硝态( )氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在
)氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在 Pa、550°C的条件下以
Pa、550°C的条件下以 和
和 为原料合成了
为原料合成了 :
:
 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。对于反应
。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。对于反应 ,下列说法正确的是
,下列说法正确的是
 可作制冷剂,
可作制冷剂, 还可用于制造铵态(
还可用于制造铵态( )氮肥和硝态(
)氮肥和硝态( )氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在
)氮肥。20世纪初,德国化学家哈伯首次用锇作催化剂在 Pa、550°C的条件下以
Pa、550°C的条件下以 和
和 为原料合成了
为原料合成了 :
:
 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。对于反应
。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。对于反应 ,下列说法正确的是
,下列说法正确的是| A.高温条件,有利于反应的自发进行 |
| B.升高温度,反应的化学平衡常数K增大 |
| C.增大压强,活化分子百分数增多,反应速率加快 |
D.若反应放出92.4kJ热量,则过程中有3mol 被氧化 被氧化 |
您最近半年使用:0次
9-10高三·四川成都·阶段练习
5 . 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是________ 。
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:________ 。
②CH4不完全燃烧也可制得合成气:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为______ (填序号);原因是____________ 。
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g) CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
I.H2的转化率为________ ;
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=_____ mol。
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向_______ 反应方向移动(填“正”或“逆”);
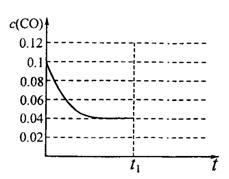
在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线_____ 。
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。
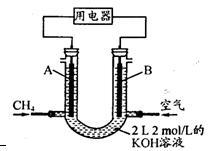
持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为____ ;
②44.8 L<V≤89.6 L时,负极电极反应为______ ;
③V=67.2 L时,溶液中离子浓度大小关系为______ ;
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:
②CH4不完全燃烧也可制得合成气:CH4(g)+
 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);△H=-35.4 kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g)
 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。I.H2的转化率为
II.在相同条件下,若起始时向密闭容器中加入a mol CH3OH(g),反应平衡后吸收热量Q2kJ,且Q1+Q2=Q,则a=
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向

在上图中画出从tl开始到再次达到平衡后,CO浓度与时间的变化趋势曲线
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。

持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为
②44.8 L<V≤89.6 L时,负极电极反应为
③V=67.2 L时,溶液中离子浓度大小关系为
您最近半年使用:0次
名校
6 . 硝酸广泛用于化肥、化纤、医药、染料、橡胶等的制造,在国防工业、冶金工业、印染工业以及其他工业部门中,也是不可缺少的重要的化学试剂。
(1)工业生产中未直接在一个设备中将 催化氧化至
催化氧化至 ,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有
,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有_____ 目的;
(2)实验发现,单位时间内 的氧化率[
的氧化率[ ]会随着温度的升高先增大后减小(如图所示),分析1000℃后
]会随着温度的升高先增大后减小(如图所示),分析1000℃后 的氧化率减小的可能原因
的氧化率减小的可能原因_____
(3) 的反应历程如下:
的反应历程如下:
反应Ⅰ: (快)
(快) 


反应Ⅱ: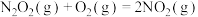 (慢)
(慢) 

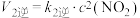
①一定条件下,反应 达到平衡状态,平衡常数
达到平衡状态,平衡常数
_____ (用含 、
、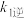 、
、 、
、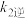 的代数式表示);
的代数式表示);
②已知反应速率常数k随温度升高而增大,则升高温度后 增大的倍数
增大的倍数_____ 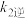 增大的倍数(填“大于”“小于”或“等于”)。
增大的倍数(填“大于”“小于”或“等于”)。
(Ⅱ)工业上也可以直接由 合成
合成 ,其中最关键的步骤为
,其中最关键的步骤为 ,利用现代手持技术传感器可以探究压强对该平衡的影响。
,利用现代手持技术传感器可以探究压强对该平衡的影响。
在恒定温度和标准压强条件下,往针筒中充入一定体积的 气体后密封并保持活塞位置不变。分别在
气体后密封并保持活塞位置不变。分别在 、
、 时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

(4)有关该过程说法正确的是_____
a.E、H两点对应的 的体积分数较大的为E点
的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深X
(5)下列表述能表示该反应已达平衡的是_____ (填序号)
a.活塞位置不变时,针管中的压强不再改变
b.针管内各物质的物质的量相等
c.针管内气体的平均摩尔质量不再改变
d.针管中温度、压强不变时,管内气体的密度不再改变
(6)求D点
_____ (不必化成小数)
(7)图像中C、E两点气体平均摩尔质量最大的点为_____ (填代号)。
(1)工业生产中未直接在一个设备中将
 催化氧化至
催化氧化至 ,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有
,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有(2)实验发现,单位时间内
 的氧化率[
的氧化率[ ]会随着温度的升高先增大后减小(如图所示),分析1000℃后
]会随着温度的升高先增大后减小(如图所示),分析1000℃后 的氧化率减小的可能原因
的氧化率减小的可能原因
(3)
 的反应历程如下:
的反应历程如下:反应Ⅰ:
 (快)
(快) 


反应Ⅱ:
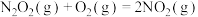 (慢)
(慢) 

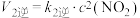
①一定条件下,反应
 达到平衡状态,平衡常数
达到平衡状态,平衡常数
 、
、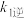 、
、 、
、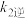 的代数式表示);
的代数式表示);②已知反应速率常数k随温度升高而增大,则升高温度后
 增大的倍数
增大的倍数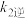 增大的倍数(填“大于”“小于”或“等于”)。
增大的倍数(填“大于”“小于”或“等于”)。(Ⅱ)工业上也可以直接由
 合成
合成 ,其中最关键的步骤为
,其中最关键的步骤为 ,利用现代手持技术传感器可以探究压强对该平衡的影响。
,利用现代手持技术传感器可以探究压强对该平衡的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的
 气体后密封并保持活塞位置不变。分别在
气体后密封并保持活塞位置不变。分别在 、
、 时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
(4)有关该过程说法正确的是
a.E、H两点对应的
 的体积分数较大的为E点
的体积分数较大的为E点b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深X
(5)下列表述能表示该反应已达平衡的是
a.活塞位置不变时,针管中的压强不再改变
b.针管内各物质的物质的量相等
c.针管内气体的平均摩尔质量不再改变
d.针管中温度、压强不变时,管内气体的密度不再改变
(6)求D点

(7)图像中C、E两点气体平均摩尔质量最大的点为
您最近半年使用:0次
7 . (一)一种工业制硝酸的方法经历下列几个步骤:
 △H1<0
△H1<0
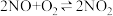 △H2<0
△H2<0
 △H3<0
△H3<0
已知:NO在1000℃以上会发生分解反应。
(1)工业生产中未直接在一个设备中将NH3催化氧化至NO2,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有_______________ 目的;
(2)实验发现,单位时间内NH3的氧化率[ ]会随着温度的升高先增大后减小(如图所示),分析1000℃后NH3的氧化率减小的可能原因
]会随着温度的升高先增大后减小(如图所示),分析1000℃后NH3的氧化率减小的可能原因________________ 。

(3) 的反应历程如下:
的反应历程如下:
反应Ⅰ: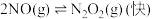 △H1<0
△H1<0

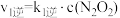
反应Ⅱ: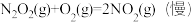 △H2<0
△H2<0
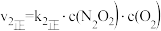
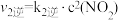
①一定条件下,反应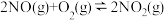 达到平衡状态,平衡常数K=
达到平衡状态,平衡常数K=________________ 。(用含k1正、k1逆、k2正、k2逆的代数式表示);
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数________________ k2逆增大的倍数(填“大于”“小于”或“等于”)。
(二)工业上也可以直接由N2O4合成HNO3,其中最关键的步骤为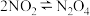 ,利用现代手持技术传感器可以探究压强对该平衡的影响。
,利用现代手持技术传感器可以探究压强对该平衡的影响。
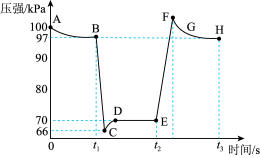
在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
(4)有关该过程说法正确的是_______________ 。
a.E、H两点对应的NO2的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
(5)求D点Kp=_______________ (不必化成小数);
(6)图像中C、E两点气体平均摩尔质量最大的点为_______________ (填代号)。
 △H1<0
△H1<0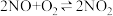 △H2<0
△H2<0 △H3<0
△H3<0已知:NO在1000℃以上会发生分解反应。
(1)工业生产中未直接在一个设备中将NH3催化氧化至NO2,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了节约能源,还有
(2)实验发现,单位时间内NH3的氧化率[
 ]会随着温度的升高先增大后减小(如图所示),分析1000℃后NH3的氧化率减小的可能原因
]会随着温度的升高先增大后减小(如图所示),分析1000℃后NH3的氧化率减小的可能原因
(3)
 的反应历程如下:
的反应历程如下:反应Ⅰ:
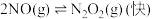 △H1<0
△H1<0 
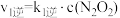
反应Ⅱ:
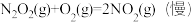 △H2<0
△H2<0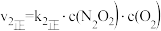
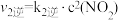
①一定条件下,反应
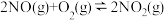 达到平衡状态,平衡常数K=
达到平衡状态,平衡常数K=②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数
(二)工业上也可以直接由N2O4合成HNO3,其中最关键的步骤为
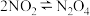 ,利用现代手持技术传感器可以探究压强对该平衡的影响。
,利用现代手持技术传感器可以探究压强对该平衡的影响。
在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
(4)有关该过程说法正确的是
a.E、H两点对应的NO2的体积分数较大的为E点
b.B向里快速推注射器活塞,E向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
(5)求D点Kp=
(6)图像中C、E两点气体平均摩尔质量最大的点为
您最近半年使用:0次
8 . 2021年,中国科学院天津工业生物技术研究所马延和研究员带领团队,采用一种类似“搭积木”的方式,从头设计、构建了11步反应的非自然固碳与淀粉合成途径,在实验室中首次实现从二氧化碳到淀粉分子的全合成。其原理首先是利用化学催化剂将高浓度二氧化碳在高密度氢能作用下合成CH3OH。已知:
i.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.19kJ•mol-1
CO(g)+H2O(g) △H1=+41.19kJ•mol-1
ii.CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-49.58kJ•mol-1
CH3OH(g)+H2O(g) △H3=-49.58kJ•mol-1
请回答下列问题:
(1)写出反应i化学平衡常数的表达式:K=______ 。
(2)反应ii的△H2=______ ,在______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)在容积为2L的密闭容器中充入1molCO2(g)和3molH2(g)发生上述反应iii,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
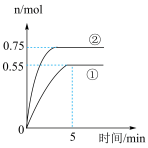
①前5min内实验①用CH3OH浓度变化表示的平均反应速率为______ ,实验②中CO2的平衡转化率为______ ,与①相比,②仅改变一种反应条件,所改变的条件是______ 。
②能说明上述反应达到平衡状态的是______ (填编号)。
a.容器内压强不再变化
b.单位时间内每消耗3molH2,同时生成1molH2O
c.CO2的浓度保持不变
d.v逆(CO2)=3v正(H2)
i.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.19kJ•mol-1
CO(g)+H2O(g) △H1=+41.19kJ•mol-1ii.CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2iii.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-49.58kJ•mol-1
CH3OH(g)+H2O(g) △H3=-49.58kJ•mol-1请回答下列问题:
(1)写出反应i化学平衡常数的表达式:K=
(2)反应ii的△H2=
(3)在容积为2L的密闭容器中充入1molCO2(g)和3molH2(g)发生上述反应iii,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:

①前5min内实验①用CH3OH浓度变化表示的平均反应速率为
②能说明上述反应达到平衡状态的是
a.容器内压强不再变化
b.单位时间内每消耗3molH2,同时生成1molH2O
c.CO2的浓度保持不变
d.v逆(CO2)=3v正(H2)
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
9 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.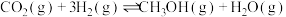
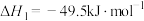
Ⅱ.

Ⅲ.

回答下列问题:
(1)不同压强下,按照 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。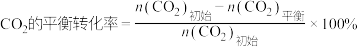
CH3OH的平衡产率=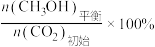
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
I.
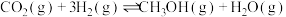
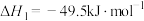
Ⅱ.


Ⅲ.


回答下列问题:
(1)不同压强下,按照
 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。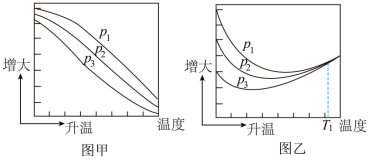
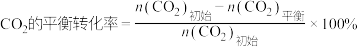
CH3OH的平衡产率=
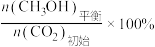
其中纵坐标表示CO2平衡转化率的是图
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
您最近半年使用:0次
名校
解题方法
10 . 将玉米秸秆进行热化学裂解可制备出以CO、 、
、 、
、 为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
(1)已知:几种常见共价键的键能如下表所示:
由此可计算反应 的焓变
的焓变
___________ kJ⋅mol 。
。
(2)若在恒容绝热的密闭容器中进行上述反应,下列说法正确的是___________(填标号)。
(3) 和
和 合成乙醇的反应为
合成乙醇的反应为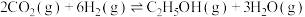 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的变化关系如图所示。
的体积分数随温度和压强的变化关系如图所示。
___________  (填“>、<”或“=”,下同)。判断依据是
(填“>、<”或“=”,下同)。判断依据是___________ 。
②a、b两点的平衡常数
___________  。
。
③已知Arrhenius经验公式为 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
___________ J⋅mol 。从图中信息获知催化效率较高的催化剂是
。从图中信息获知催化效率较高的催化剂是___________ (填“m”或“n”)。
 、
、 、
、 为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。
为主要成分的生物质原料气,对原料气进行预处理后,可用于生产甲醇、乙醇等燃料。(1)已知:几种常见共价键的键能如下表所示:
| 共价键 | C-H | C-O | C≡O | H-H | O-H |
键能(kJ⋅mol ) ) | 413 | 358 | 839 | 436 | 467 |
 的焓变
的焓变
 。
。(2)若在恒容绝热的密闭容器中进行上述反应,下列说法正确的是___________(填标号)。
| A.体系温度不再发生变化时,反应达到化学平衡状态 |
B.体系中若 和 和 的物质的量之比达到2∶1,则反应已达到平衡 的物质的量之比达到2∶1,则反应已达到平衡 |
C.加入催化剂,可以提高 的平衡产率 的平衡产率 |
| D.其它条件不变,增大CO的浓度,能提高H2的平衡转化率 |
(3)
 和
和 合成乙醇的反应为
合成乙醇的反应为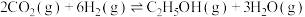 。将等物质的量的
。将等物质的量的 和
和 充入一刚性容器中,测得平衡时
充入一刚性容器中,测得平衡时 的体积分数随温度和压强的变化关系如图所示。
的体积分数随温度和压强的变化关系如图所示。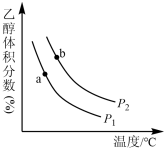

 (填“>、<”或“=”,下同)。判断依据是
(填“>、<”或“=”,下同)。判断依据是②a、b两点的平衡常数

 。
。③已知Arrhenius经验公式为
 (
( 为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得下图所示曲线。在n催化剂作用下,该反应的活化能
 。从图中信息获知催化效率较高的催化剂是
。从图中信息获知催化效率较高的催化剂是
您最近半年使用:0次



