名校
1 . 特定催化剂作用下乙酸加氢制备乙醇的反应如下:
主反应:
副反应: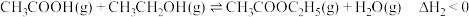
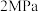 下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化;
下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化; 下,平衡时S(乙醇)和S(乙酸乙酯)随压强变化如图:
下,平衡时S(乙醇)和S(乙酸乙酯)随压强变化如图: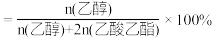
②副反应热效应小,放出的热量可忽略
下列说法错误的是
主反应:

副反应:
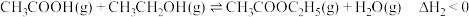
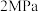 下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化;
下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化; 下,平衡时S(乙醇)和S(乙酸乙酯)随压强变化如图:
下,平衡时S(乙醇)和S(乙酸乙酯)随压强变化如图: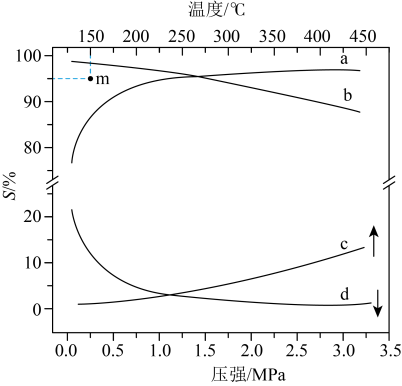
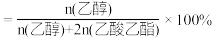
②副反应热效应小,放出的热量可忽略
下列说法错误的是
A.恒温恒压密闭容器中,按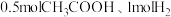 和 和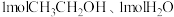 分别投料,达平衡时热量变化分别为 分别投料,达平衡时热量变化分别为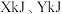 ,则 ,则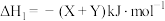 |
B.恒温恒压下,向体积为 的密闭容器中通入 的密闭容器中通入 和 和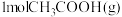 ,平衡时 ,平衡时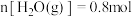 ,体积减小20%,主反应的平衡常数 ,体积减小20%,主反应的平衡常数 |
C. 时,S(乙醇)随压强变化的曲线为a; 时,S(乙醇)随压强变化的曲线为a; 时,S(乙醇)随温度的变化曲线为c 时,S(乙醇)随温度的变化曲线为c |
D. 时, 时, 和 和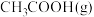 反应一段时间后,乙醇的选择性位于m点,其他条件不变,增大压强一定能提高乙醇选释性 反应一段时间后,乙醇的选择性位于m点,其他条件不变,增大压强一定能提高乙醇选释性 |
您最近一年使用:0次
7日内更新
|
45次组卷
|
2卷引用:2024届山东省潍坊市四县联考高三下学期三模化学试题
名校
解题方法
2 . 乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)  C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L]。
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L]。
 C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L]。
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L]。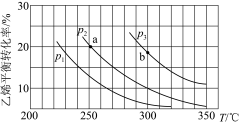
| A.乙烯气相直接水合反应的ΔH<0 |
| B.图中压强的大小关系为p1>p2>p3 |
C.图中a点对应的平衡常数K= |
| D.达到平衡状态a、b所需要的时间:a>b |
您最近一年使用:0次
2021-09-06更新
|
2050次组卷
|
49卷引用:山东省潍坊市昌乐县2020年高三上学期第一次高考模拟化学试题
山东省潍坊市昌乐县2020年高三上学期第一次高考模拟化学试题【区级联考】北京市朝阳区2019届高三下学期二模考试化学试题2021年北京高考化学试题变式题11-19江苏省镇江第一中学2021-2022学年高三下学期模拟考试化学试题(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编内蒙古翁牛特旗乌丹第一中学2019-2020学年高二10月月考化学试题福建省莆田四中2019-2020学年高二上学期期中考试化学试题吉林省大安一中2019-2020学年高三上学期第四次月考化学试题陕西省咸阳市三原县南郊中学2020届高三第五次月考化学试题湖南省部分重点中学2020届高三上学期期末考试理综化学试题山东省聊城市2019-2020学年高二上学期期末考试化学试题山东省济宁市嘉祥县第一中学2020届高三下学期第三次质量检测化学试题山东省2020届高三模拟考试化学试题(已下线)考点10 化学平衡常数及其图象分析-2020年高考化学命题预测与模拟试题分类精编江西省上饶市横峰中学、铅山一中、弋阳一中2020-2021学年高二上学期开学联考化学试题(课改班)黑龙江省哈尔滨师范大学附属中学2020-2021学年高二10月月考化学试题甘肃省天水一中2020-2021学年高二上学期第一学段考试化学试题黑龙江哈尔滨师范大学附属中学中2020-2021学年高二上学期第一次月考化学试题(已下线)第七章 能力提升检测卷-2021年高考化学一轮复习讲练测江西省南昌市第二中学2020-2021学年高二上学期期中考试化学试题辽宁省抚顺市2020-2021学年高二上学期期中考试化学试题广东省佛山市第一中学2020-2021学年高二上学期第一次段考化学(选考)试题(已下线)【南昌新东方】3. 2020 高二上 南昌二中 期中考试 吴丹江西省南昌市南昌县莲塘第三中学2020-2021学年高二上学期第二次月考化学试题甘肃省武威市民勤县第四中学2020-2021学年高二上学期期末考试(实验班)化学试题江苏省连云港市赣榆区2020-2021学年高二下学期期中考试化学试题(已下线)专题2.4 化学反应的调控(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)2.4 化学反应的调控-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题七 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省泰安肥城市2021-2022学年高三上学期第一次摸底考试化学试题(已下线)专题23 化学平衡的移动和化学反应进行的方向(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题河南省实验中学2021-2022学年高二上学期期中考试化学试题河南省重点高中2021-2022学年高二上学期阶段性调研联考二化学试题江西省赣州市定南中学2021-2022学年高二下学期3月月考化学试题湖南省娄底涟源市第一中学2022届高三下学期四月月考化学试题辽宁省铁岭市六校协作体2021-2022学年高一下学期期末联考化学试题宁夏银川市第二中学2021-2022学年高二下学期期末考试化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)浙江省嘉兴八校联盟2021-2022学年高二上学期期中联考化学试题黑龙江省牡丹江市阳明区2022-2023学年高三上学期第四次阶段考试化学试题辽宁省大连庄河市高级中学2022-2023学年高二上学期12月月考化学(B卷)试题(已下线)第七章 化学反应速率与化学平衡 第42练 化学平衡常数及转化率的计算北京市中国人民大学附属中学朝阳学校2021-2022学年高三上学期第一次月考化学试题河南省南阳市第一中学校2022-2023学年高二上学期第二次月考化学试题云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题山东省济宁市嘉祥县第一中学2023-2024学年高二上学期10月月考化学试题北京市顺义区第一中学2023-2024学年高三上学期期中考试化学试题四川省雅安市天立学校2022-2023学年高二下学期6月月考化学试题
2010·浙江·二模
名校
解题方法
3 . 化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是()
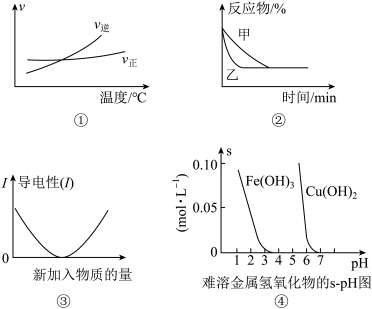

A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)+Q的Q﹤0 2AB3(g)+Q的Q﹤0 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右 |
您最近一年使用:0次
2020-03-31更新
|
211次组卷
|
26卷引用:2011届山东省潍坊市三县最后一次模拟联考(理综)化学部分
(已下线)2011届山东省潍坊市三县最后一次模拟联考(理综)化学部分(已下线)2010年浙江省第二次五校联考理科综合试题卷(已下线)2010年四川省绵阳市南山中学高三考前模拟考试(理科综合)化学部分(已下线)2010届江苏启东中学高三考前辅导训练化学试题(已下线)2011届山东省济宁一中高三第一次模拟测试试题理综化学试卷(已下线)2011届吉林省长春市高三第二次模拟考试(理综)化学部分(已下线)2011届广东省深圳高级中学高三高考前最后模拟试卷(理综)化学部分(已下线)2012届福建省漳州市芗城中学高三适应性检测化学试卷2016届山东省济南外国语学校高三上学期1月模拟测试理综化学试卷湖南省五市十校教研教改共同体2018届高三12月联考化学试题(已下线)上海市2011届高三六校联考化学试题(已下线)2012届浙江省杭州市学军中学高三上学期第一次月考化学试卷(已下线)2012届江苏省启东中学高三上学期第二次月考化学试卷(已下线)2014届河北省正定中学高三上学期第四次月考化学试卷2016届黑龙江省牡丹江高级中学高三上学期期末理综化学试卷2015-2016学年四川成都石室中学高二4月月考化学试卷2017届陕西省师范大学附属中学高三上学期第二次模考化学试卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【押题专练】重庆市綦江中学2018-2019学年高二上学期第三次月考化学试题山西省长治市城区第二中学校2018-2019学年高二上学期期末考试化学试题山西省吕梁市汾阳中学2018-2019学年高二下学期期中考试化学试题2020届高三化学二轮冲刺新题专练——化学反应速率的图像分析夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 沉淀溶解平衡及其影响因素新疆和田地区第二中学2020届高三上学期12月月考化学试题(重点普通班)广东实验中学2021-2022学年高二上学期期中考试化学试题湖南省长沙市雅礼中学2022-2023学年高二上学期期中考试化学试题
4 . 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式________ 。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L·min),则平衡后n(CO)=________ mol,关于该平衡的下列说法正确的是________ 。
a.增大压强,平衡一定向右移动
b.其它条件不变,升高温度,化学反应速率一定增大
c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.向平衡后的容器中再充人0. 2mol NO和0.1mol CO,化学平衡常数增大
e.达到平衡后v正(NO)=2v逆(N2)
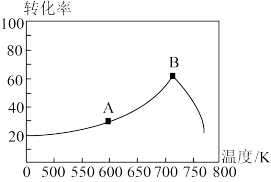
(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示。A点的反应速率v正________ v逆(填><或=),A、B两点反应的平衡常数较大的是_________ (填A或B)。
(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH )较小,试分析原因:
)较小,试分析原因:________ .0.1mol·L-1NH4NO3溶液中离子浓度由大到小的顺序是________ ,常温下NO 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=________ mol·L-1(保留两位有效数字)。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1)
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)
 2CO2(g)+N2(g) △H=-748kJ·mol-1
2CO2(g)+N2(g) △H=-748kJ·mol-12CO(g)+O2(g)=2CO2(g) △H2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO气体,写出反应的热化学方程式
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol/(L·min),则平衡后n(CO)=
a.增大压强,平衡一定向右移动
b.其它条件不变,升高温度,化学反应速率一定增大
c.其它条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.向平衡后的容器中再充人0. 2mol NO和0.1mol CO,化学平衡常数增大
e.达到平衡后v正(NO)=2v逆(N2)
(3)其它条件相同,tmin时不同温度下测得NO的转化率如图所示。A点的反应速率v正

(4)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH
 )较小,试分析原因:
)较小,试分析原因: 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=
您最近一年使用:0次
2013·山东潍坊·一模
5 . 碳元素的单质及其化合物与人类的生产、生活、科研息息相关。请回答下列问题:
(1)绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s)=4(C3H6O3)+(s)+O2(g)+4e- △H=+1360kJ·mol-1
12(C3H6O3)+(s)+12e-=C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:_______ ,
(2)工业上利用水煤气合成甲醇的主要反应可表示为:H2(g)+1/2CO(g)⇌1/2CH3OH(g)△H=-45.4kJ·mol-1。
向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①该温度条件下,上述反应的化学平衡常数K=_______ 。
②若容器容积不变,下列措施可增加CH3OH产率的是_______ (填写序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入O210molH2和0.05molCO
③若该反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,则平衡向_______ (填“逆向”、“正向”或“不”)移动,化学平衡常数K_______ (填“增大”、“减小”或“不变”)。
(3)已知反应:2CO(g)+O2(g)=2CO2(g) △H<0,根据原电池原理该反应能否设计成燃料电池。若能,请写出当电解质溶液为KOH溶液时的负极反应式(若不能,该空可不作答):_______ 。
(1)绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s)=4(C3H6O3)+(s)+O2(g)+4e- △H=+1360kJ·mol-1
12(C3H6O3)+(s)+12e-=C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:
(2)工业上利用水煤气合成甲醇的主要反应可表示为:H2(g)+1/2CO(g)⇌1/2CH3OH(g)△H=-45.4kJ·mol-1。
向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①该温度条件下,上述反应的化学平衡常数K=
②若容器容积不变,下列措施可增加CH3OH产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入O210molH2和0.05molCO
③若该反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,则平衡向
(3)已知反应:2CO(g)+O2(g)=2CO2(g) △H<0,根据原电池原理该反应能否设计成燃料电池。若能,请写出当电解质溶液为KOH溶液时的负极反应式(若不能,该空可不作答):
您最近一年使用:0次



