1 . 在一定条件下aA+bB cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:
(1)若A、B、C、D都是气体,在加压后平衡向正反应方向移动,则a、b、c、d关系是_______ 。
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是_______ (填状态)。
(3)若保持容器容积不变,加入气体B,气体A的转化率_______ (填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量增大,则正反应是_______ 反应(填“放热”或“吸热”)。
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡逆向移动,则a、b、c、d关系是_______ 。
 cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:(1)若A、B、C、D都是气体,在加压后平衡向正反应方向移动,则a、b、c、d关系是
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是
(3)若保持容器容积不变,加入气体B,气体A的转化率
(4)若加热后,C的百分含量增大,则正反应是
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡逆向移动,则a、b、c、d关系是
您最近一年使用:0次
解题方法
2 . 按要求填空
Ⅰ.可逆反应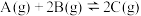
 ,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,v(正)___________ 。
(2)使用催化剂,A的物质的量___________ 。
(3)压缩容器体积,v(逆)___________ ,C占混合气体的体积分数___________ 。
(4)增大A的浓度,则B的转化率___________ 。
Ⅱ. 已知可逆反应: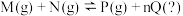 请回答下列问题:
请回答下列问题:
(5)在某温度下,反应物的起始浓度分别为: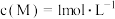 ,
,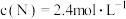 ;
;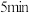 后达到平衡,
后达到平衡, 的转化率为
的转化率为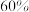 ,此时
,此时 的转化率为
的转化率为___________ ;用物质P表示的反应速率为___________ 。
(6)若其他条件不变,加热后P的质量分数减少,则正反应是___________ 热反应。
(7)若其他条件不变,增大压强时,如果平衡不发生移动,则Q是___________ 态(填“气”、“液”、“固”),n=___________ 。
Ⅰ.可逆反应
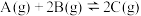
 ,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:(1)升高温度,v(正)
(2)使用催化剂,A的物质的量
(3)压缩容器体积,v(逆)
(4)增大A的浓度,则B的转化率
Ⅱ. 已知可逆反应:
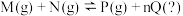 请回答下列问题:
请回答下列问题:(5)在某温度下,反应物的起始浓度分别为:
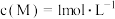 ,
,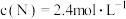 ;
;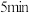 后达到平衡,
后达到平衡, 的转化率为
的转化率为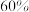 ,此时
,此时 的转化率为
的转化率为(6)若其他条件不变,加热后P的质量分数减少,则正反应是
(7)若其他条件不变,增大压强时,如果平衡不发生移动,则Q是
您最近一年使用:0次
解题方法
3 . 在密闭容器中进行如下反应: ,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
(1)增加C的含量,平衡____________ ,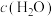
___________ .
(2)保持反应容器体积和温度不变,通入 ,平衡
,平衡____________ ,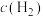
____________ .
(3)在一定温度下,缩小反应容器体积,平衡向____________ 方向移动,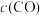
___________ , 的转化率
的转化率
______________ 。
(4)保持反应容器体积不变,升高温度,平衡向_________ 方向移动,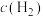
___________ .
(5)保持反应容器体积和温度不变,再通入 ,平衡向
,平衡向__________ 方向移动, 的转化率
的转化率
_________ ,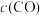
___________ 。
 ,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。
,达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况。(1)增加C的含量,平衡
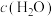
(2)保持反应容器体积和温度不变,通入
 ,平衡
,平衡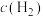
(3)在一定温度下,缩小反应容器体积,平衡向
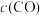
 的转化率
的转化率
(4)保持反应容器体积不变,升高温度,平衡向
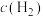
(5)保持反应容器体积和温度不变,再通入
 ,平衡向
,平衡向 的转化率
的转化率
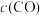
您最近一年使用:0次
4 . 在密闭容器中进行如下反应
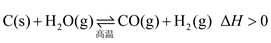
达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)增加C的含量,平衡____________ ,c(H2O)___________ 。
(2)保持反应容器体积和温度不变,通入He,平衡____________ ,c(H2)____________ 。
(3)在一定温度下,缩小反应容器体积,平衡向____________ 方向移动,c(CO)___________ ,H2O(g)的转化率
______________ 。
(4)保持反应容器体积不变,升高温度,平衡向_________ 方向移动,c(H2)___________ 。
(5)保持反应容器体积和温度不变,再通入H2O(g),平衡向__________ 方向移动,H2O(g)的转化率
_________ ,c(CO)___________ 。
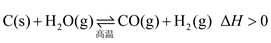
达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)增加C的含量,平衡
(2)保持反应容器体积和温度不变,通入He,平衡
(3)在一定温度下,缩小反应容器体积,平衡向

(4)保持反应容器体积不变,升高温度,平衡向
(5)保持反应容器体积和温度不变,再通入H2O(g),平衡向

您最近一年使用:0次
2021-11-07更新
|
313次组卷
|
2卷引用:四川省成都市蓉城名校联盟2021-2022学年高二上学期期中联考化学试题
名校
5 . 合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
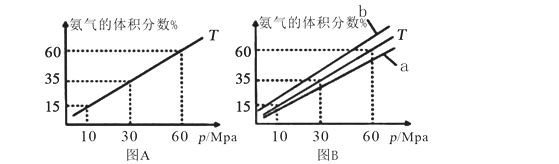
①图A中氨气的体积分数为15%时,H2的转化率为_______ 。
②图B中T=500℃,则温度为450℃时对应的曲线是_______ (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
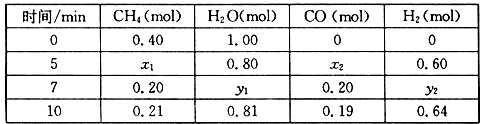
①分析表中数据,判断5 min时反应是否处于平衡状态?_____ (填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________ 。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________ (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________ 。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______ 。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
①当压强从2×105 Pa增加到5×105 Pa时,平衡______ 移动(填“正向、逆向或不”)。
②当压强为1×106 Pa时,此反应的平衡常数表达式为______________ 。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为
②图B中T=500℃,则温度为450℃时对应的曲线是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
①分析表中数据,判断5 min时反应是否处于平衡状态?
②该温度下,上述反应的平衡常数K=
③反应在7~10 min内,CO的物质的量减少的原因可能是
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)
 CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡
②当压强为1×106 Pa时,此反应的平衡常数表达式为
您最近一年使用:0次
2017-10-22更新
|
464次组卷
|
2卷引用:四川省成都市郫都区第一中学2017-2018学年高二上学期第一次月考化学试题
名校
解题方法
6 . 对于可逆反应2A(?)+B(g) 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:

(1)物质A的状态是_________ (填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是_____ ;
(3)v(a)、v(b)、v(c)按由大到小排序_________________ ;
(4)对于2SO2(g)+O2(g) 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是___________ ;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率__________ (填“会”或“不会”)。
 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是
(3)v(a)、v(b)、v(c)按由大到小排序
(4)对于2SO2(g)+O2(g)
 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是
您最近一年使用:0次



