合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
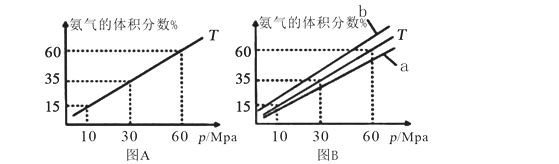
①图A中氨气的体积分数为15%时,H2的转化率为_______ 。
②图B中T=500℃,则温度为450℃时对应的曲线是_______ (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g) CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
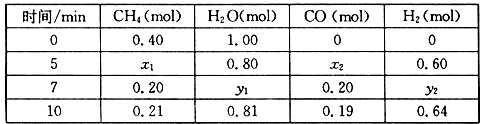
①分析表中数据,判断5 min时反应是否处于平衡状态?_____ (填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________ 。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________ (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________ 。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______ 。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
①当压强从2×105 Pa增加到5×105 Pa时,平衡______ 移动(填“正向、逆向或不”)。
②当压强为1×106 Pa时,此反应的平衡常数表达式为______________ 。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为
②图B中T=500℃,则温度为450℃时对应的曲线是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
①分析表中数据,判断5 min时反应是否处于平衡状态?
②该温度下,上述反应的平衡常数K=
③反应在7~10 min内,CO的物质的量减少的原因可能是
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)
 CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡
②当压强为1×106 Pa时,此反应的平衡常数表达式为
更新时间:2017/10/22 00:05:26
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2),在催化剂的作用下合成甲醇,可能发生的反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1 = -49.5 kJ· mol−1
Ⅱ.CO2(g)+ H2(g)⇌CO(g)+H2O(g) ΔH2 = +40.9 kJ· mol−1
Ⅲ.CO (g)+2H2(g)⇌CH3OH(g) ΔH3 = -90.4 kJ· mol−1
回答下列问题:
(1)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CO (g)和CH3OH (g)的物质的量分别为ɑ mol、b mol,此时H2O(g)的浓度为________ mol﹒L−1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数K为________ 。
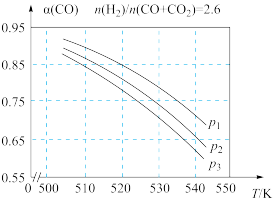
(2)如图为合成气的组成n(H2)/n(CO+CO2)=2.6时,体系中CO的平衡转化率α(CO)与温度和压强的关系,图中的压强由大到小的顺序为________ 。
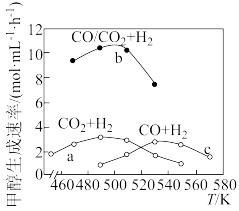
(3)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是________ 。(填“A”或“B” )
A.CO CO2
CO2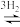 CH3OH+H2O
CH3OH+H2O
B.CO2 CO
CO CH3OH
CH3OH
(4)如图为一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系。
①温度为470K时,图中P点的v正________ v逆。(填“>”“<”或“=”)
②下列说法错误的是________ 。(填标号)
A.增大压强或加入大量催化剂均一定能提高甲醇的产率
B.490K之前,甲醇的产率随温度升高而增大的原因可能是升高温度使反应Ⅰ的平衡正向移动
C.490K之后,甲醇的产率随温度升高而减小的原因可能是因为催化剂活性降低
D.490K之后,甲醇的产率随温度的升高而减小的原因可能是升高温度使反应Ⅲ的平衡逆向移动
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1 = -49.5 kJ· mol−1
Ⅱ.CO2(g)+ H2(g)⇌CO(g)+H2O(g) ΔH2 = +40.9 kJ· mol−1
Ⅲ.CO (g)+2H2(g)⇌CH3OH(g) ΔH3 = -90.4 kJ· mol−1
回答下列问题:
(1)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CO (g)和CH3OH (g)的物质的量分别为ɑ mol、b mol,此时H2O(g)的浓度为
(2)如图为合成气的组成n(H2)/n(CO+CO2)=2.6时,体系中CO的平衡转化率α(CO)与温度和压强的关系,图中的压强由大到小的顺序为

(3)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是

A.CO
 CO2
CO2 CH3OH+H2O
CH3OH+H2OB.CO2
 CO
CO CH3OH
CH3OH(4)如图为一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系。

①温度为470K时,图中P点的v正
②下列说法错误的是
A.增大压强或加入大量催化剂均一定能提高甲醇的产率
B.490K之前,甲醇的产率随温度升高而增大的原因可能是升高温度使反应Ⅰ的平衡正向移动
C.490K之后,甲醇的产率随温度升高而减小的原因可能是因为催化剂活性降低
D.490K之后,甲醇的产率随温度的升高而减小的原因可能是升高温度使反应Ⅲ的平衡逆向移动
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】燃煤烟气脱硫有很多方法
方法I:先用氨水将SO2转化为NH4HSO3,再通入空气氧化成(NH4)2SO4。
方法II:用Na2SO3溶液吸收SO2,再经电解转化为H2SO4。
据此回答以下问题:
(1)方法I中发生氧化还原反应的离子方程式__________ 。能提高方法I燃煤烟气SO2中去除率的措施有__________ (填字母)。
A.增大氨水浓度 B.增大燃煤烟气的流速
C.事先去除燃煤烟气中的二氧化碳 D.增大压强
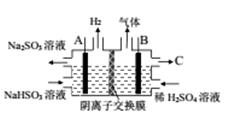
(2)采用方法II脱硫,燃煤烟气中的二氧化碳能否与生成的NaHSO3溶液反应_______ (说明理由)。已知H2SO3为的电离平衡常数为K1=1.54×10-2,K2=1.02×10-7。则NaHSO3溶液中含S元素粒子浓度由大到小的顺序为_______ 。通过右图所示电解装置可将生成的NaHSO3转化为硫酸,电极材料皆为石墨。则A为电解池的______ (填“阴极”或“阳极”)。C为______ (填物质名称)。若将阴离子交换膜换成阳子交换膜,写出阳极区域发生的电极反应______ 。
方法I:先用氨水将SO2转化为NH4HSO3,再通入空气氧化成(NH4)2SO4。
方法II:用Na2SO3溶液吸收SO2,再经电解转化为H2SO4。
据此回答以下问题:
(1)方法I中发生氧化还原反应的离子方程式
A.增大氨水浓度 B.增大燃煤烟气的流速
C.事先去除燃煤烟气中的二氧化碳 D.增大压强
(2)采用方法II脱硫,燃煤烟气中的二氧化碳能否与生成的NaHSO3溶液反应
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】(1)SO2、NOx、CO等气体和可吸入颗粒物对环境的污染尤其严重,为了减少它们对环境的污染,通常采用下列措施进行处理:
已知:①N2(g)+O2(g) 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为____________________________ ,该反应自发进行的条件是_________ 。
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g) 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。
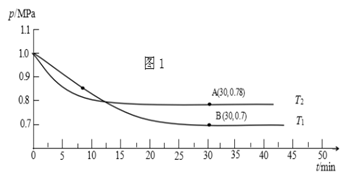
①下列说法不正确的是________ ;
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=__________________________ (提示:用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。______________
(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)______________________________ ;常温下,若用pH=3的盐酸滴定pH=11的氨水生成NH4Cl溶液,则用去两溶液的体积关系:V(盐酸)________ V(氨水)(填“>”、“=”或“<”),滴定终点的判断:__________________ 。
已知:①N2(g)+O2(g)
 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g)
 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。
①下列说法不正确的是
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。

(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)
您最近一年使用:0次
【推荐1】氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应N2+3H2 2NH3。该可逆反应达到平衡的标志是
2NH3。该可逆反应达到平衡的标志是________ 。
A.3v正(H2)=2v逆(NH3)
B.单位时间生成mmolN2的同时生成3mmolH2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据。
请回答下列问题:
①该温度下,上述反应的平衡常数K=________ ;
②反应在7~10min内,CO的物质的量减少的原因可能是________ (填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2L的恒容密闭容器中同时充入0.2molCH4、0.6molH2O、amolCO和0.5molH2,当a=0.2时,上述反应向________ (填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为________ (已知:0.253=0.0156)
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应N2+3H2
 2NH3。该可逆反应达到平衡的标志是
2NH3。该可逆反应达到平衡的标志是A.3v正(H2)=2v逆(NH3)
B.单位时间生成mmolN2的同时生成3mmolH2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据。
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
①该温度下,上述反应的平衡常数K=
②反应在7~10min内,CO的物质的量减少的原因可能是
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2L的恒容密闭容器中同时充入0.2molCH4、0.6molH2O、amolCO和0.5molH2,当a=0.2时,上述反应向
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】CO 可用于合成甲醇,化学方程式为 CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)图 1是反应 CO(g)+2H2(g) CH3OH(g)在不同温度下CO的转化率随时间变化的线。
CH3OH(g)在不同温度下CO的转化率随时间变化的线。
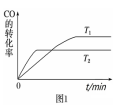
①该反应的焓变 ΔH________ 0 (填“>”、“<”或“=”)。
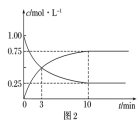
②T1和 T2温度下的平衡常数大小关系是 K1________ (填“>”、“<”或“=”)K2。在T1 温度下,往体积为 1 L 的密闭容器中,充入 1 mol CO和2 molH2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为__________________________ 。
(2)若容器容积不变,下列措施可增加 CO 转化率的是____ 。
a.升高温度 b.将 CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
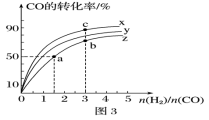
(3)在容积为 1 L 的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线z对应的温度是________ ℃;该温度下上述反应的化学平衡常数为________ 。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________ 。
(4)CO(g)+2H2(g) CH3OH(g)的反应
CH3OH(g)的反应_____________ 进行(填“高温自发”或“低温自发” )。
 CH3OH(g)。
CH3OH(g)。(1)图 1是反应 CO(g)+2H2(g)
 CH3OH(g)在不同温度下CO的转化率随时间变化的线。
CH3OH(g)在不同温度下CO的转化率随时间变化的线。


①该反应的焓变 ΔH
②T1和 T2温度下的平衡常数大小关系是 K1
(2)若容器容积不变,下列措施可增加 CO 转化率的是
a.升高温度 b.将 CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(3)在容积为 1 L 的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线z对应的温度是
(4)CO(g)+2H2(g)
 CH3OH(g)的反应
CH3OH(g)的反应
您最近一年使用:0次
【推荐3】已知NO2和N2O4可以相互转化,反应:2NO2(g) N2O4(g) △H=-57.2kJ•mol-1。
N2O4(g) △H=-57.2kJ•mol-1。
(1)一定温度下,将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是__ (填字母,下同)。
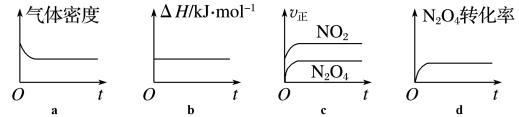
(2)在恒容容器中,该反应达平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是__ 。
(3)若反应2NO2(g) N2O4(g)在容积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量NO2,平衡移动
N2O4(g)在容积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量NO2,平衡移动__ (填“向左”“向右”或“不”),重新达到平衡后,和原平衡相比,NO2的转化率__ (填“增大”“减小”或“不变”)。
(4)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g) N2O4(g)。反应中测得相关数据如表所示:
N2O4(g)。反应中测得相关数据如表所示:
①此条件下该反应的化学平衡常数K=__ 。
②在50min末,向容器中加入 molNO2,若要保持平衡不发生移动,则应加入的N2O4为
molNO2,若要保持平衡不发生移动,则应加入的N2O4为__ mol。
③该温度下,若将9.2gNO2和N2O4的混合气体充入1L密闭容器中,某时刻测得容器内气体的相对分子质量为56,则此时v正(NO2)___ v逆(N2O4)(填“<”“>”或“=”)。
 N2O4(g) △H=-57.2kJ•mol-1。
N2O4(g) △H=-57.2kJ•mol-1。(1)一定温度下,将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

(2)在恒容容器中,该反应达平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是
| A.充入一定量的NO2 | B.分离出一定量NO2 |
| C.充入一定量的N2 | D.降低温度 |
 N2O4(g)在容积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量NO2,平衡移动
N2O4(g)在容积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量NO2,平衡移动(4)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g)
 N2O4(g)。反应中测得相关数据如表所示:
N2O4(g)。反应中测得相关数据如表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
①此条件下该反应的化学平衡常数K=
②在50min末,向容器中加入
 molNO2,若要保持平衡不发生移动,则应加入的N2O4为
molNO2,若要保持平衡不发生移动,则应加入的N2O4为③该温度下,若将9.2gNO2和N2O4的混合气体充入1L密闭容器中,某时刻测得容器内气体的相对分子质量为56,则此时v正(NO2)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)  xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x=_____________ 。
(2)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)________________ 。
A.向正反应方向移动 B. 向逆反应方向移动 C. 不移动
(3)若向原平衡混合物的容器中再充入3 molA和1 molB,在t℃时达到新的平衡,此时B转化率___________ (“变大”、“变小”或“不变”)。
(4)假如上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_______________________________________________ 。
 xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:(1)x=
(2)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)
A.向正反应方向移动 B. 向逆反应方向移动 C. 不移动
(3)若向原平衡混合物的容器中再充入3 molA和1 molB,在t℃时达到新的平衡,此时B转化率
(4)假如上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g) △H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g) △H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
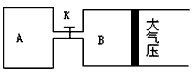
(1)B中X 的转化率α(X)B为_________________________
(2)A中W和B中Z的物质的量的比较: n(W)A_______________ n(Z)B (填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为__________________ 升 (用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是_______________________
 Z(g)+2W(g) △H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g) △H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
(1)B中X 的转化率α(X)B为
(2)A中W和B中Z的物质的量的比较: n(W)A
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为
(4)要使B容器恢复原来反应前的体积,可采取的措施是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】我国提出“ 排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发
排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发 的利用技术,降低空气中
的利用技术,降低空气中 的含量是实现该目标的重要途径。
的含量是实现该目标的重要途径。
(1)下面是用 捕捉
捕捉 时发生的两个反应:
时发生的两个反应:
I.

II.

①反应I、II的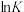 随
随 的变化如图所示,则
的变化如图所示,则
___________ 0(填“>”“<”或“=”)0;有利于该反应自发进行的温度是___________ (填“高温”或“低温”)。
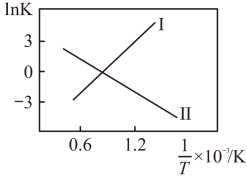
②将一定量的 和
和 的混合气体充入密闭容器中,
的混合气体充入密闭容器中, 、
、 与温度的关系如下图所示,400℃之后
与温度的关系如下图所示,400℃之后 降低的原因是
降低的原因是___________ ,而速率仍然增大的可能原因是___________ 。

③220℃时,将4mol 与1mol
与1mol 的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡,
的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡, 的转化率为80%,
的转化率为80%, 的选择性为33.3%,则生成的
的选择性为33.3%,则生成的 平均速率为
平均速率为___________ (保留两位有效数字),反应II的平衡常数 为
为___________ [已知: 的选择性
的选择性 ]
]
(2)利用化学链将高炉废气中的 转化为CO的示意图如下。
转化为CO的示意图如下。
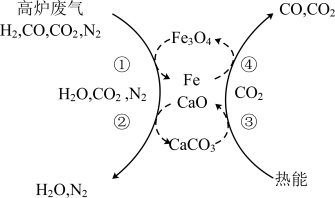
此过程中可循环利用的物质有___________ ,该化学链的总反应是___________ 。
 排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发
排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发 的利用技术,降低空气中
的利用技术,降低空气中 的含量是实现该目标的重要途径。
的含量是实现该目标的重要途径。(1)下面是用
 捕捉
捕捉 时发生的两个反应:
时发生的两个反应:I.


II.
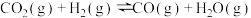

①反应I、II的
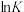 随
随 的变化如图所示,则
的变化如图所示,则

②将一定量的
 和
和 的混合气体充入密闭容器中,
的混合气体充入密闭容器中, 、
、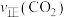 与温度的关系如下图所示,400℃之后
与温度的关系如下图所示,400℃之后 降低的原因是
降低的原因是
③220℃时,将4mol
 与1mol
与1mol 的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡,
的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡, 的转化率为80%,
的转化率为80%, 的选择性为33.3%,则生成的
的选择性为33.3%,则生成的 平均速率为
平均速率为 为
为 的选择性
的选择性 ]
](2)利用化学链将高炉废气中的
 转化为CO的示意图如下。
转化为CO的示意图如下。
此过程中可循环利用的物质有
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】密闭容器中加入4molA、1.2molC和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。

(1)若t1=15s,则t0~t1阶段的反应速率为υ(C)=___________ 。
(2)t4时刻改变的条件为_____________ 。
(3)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q 为正值),试写出该反应的热化学方程式:__________________________

(1)若t1=15s,则t0~t1阶段的反应速率为υ(C)=
(2)t4时刻改变的条件为
(3)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q 为正值),试写出该反应的热化学方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g)⇌H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1
①该反应在低温下___________ (填“能”或“不能”)自发进行。
②写出该反应的平衡常数表达式___________ 。
(2)已知在400℃时,N2(g)+3H2(g)⇌2NH3(g)的K=0.5。
①400℃时,2NH3(g)⇌N2(g)+3H2(g)的K'=___________ (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正___________ v(N2)逆(填“>”“<”“=”或“不能确定”)。
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡___________ 移动(填“向左”、“向右”或“不”);反应的∆H___________ (填“增大”、“减小”或“不变”)。
(3)水煤气转化反应CO(g)+H2O(g) ⇌CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组数据:
①平衡常数K(650℃)___________ K(900℃)(填“大于”,“小于”或“等于”)
②若将实验2中CO和H2O的物质的量加倍,则平衡时H2的物质的量浓度为___________ 。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g)⇌H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1
①该反应在低温下
②写出该反应的平衡常数表达式
(2)已知在400℃时,N2(g)+3H2(g)⇌2NH3(g)的K=0.5。
①400℃时,2NH3(g)⇌N2(g)+3H2(g)的K'=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡
(3)水煤气转化反应CO(g)+H2O(g) ⇌CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量)/mol | 平衡量)/mol | 达到平衡所需时间)/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①平衡常数K(650℃)
②若将实验2中CO和H2O的物质的量加倍,则平衡时H2的物质的量浓度为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】 是一种主要温室气体,研究
是一种主要温室气体,研究 的利用对促进低碳社会构建具有重要的意义。
的利用对促进低碳社会构建具有重要的意义。
(1)一定条件下,某恒容密闭容器中充入一定量 和足量
和足量 ,同时发生两个反应:
,同时发生两个反应:
Ⅰ. ,
,
Ⅱ.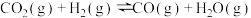 。反应Ⅰ的速率可表示为
。反应Ⅰ的速率可表示为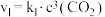 ,反应Ⅱ的速率可表示为
,反应Ⅱ的速率可表示为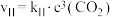 (
(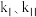 为速率常数)。反应体系中组分
为速率常数)。反应体系中组分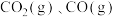 的浓度随时间变化情况如图甲。
的浓度随时间变化情况如图甲。
① 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为______________  (保留两位有效数字)。
(保留两位有效数字)。
②如果反应能够进行到底,反应结束时,______________  的
的 转化为
转化为 。
。
③活化能较大的反应为______________ (填“Ⅰ”或“Ⅱ")。
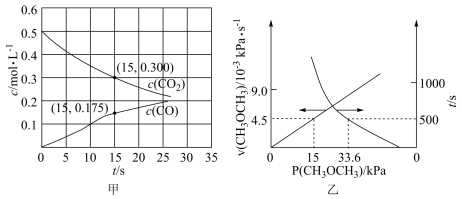
(2) 还可以转化为甲醚。一定温度下,在恒容密闭容器中通入
还可以转化为甲醚。一定温度下,在恒容密闭容器中通入 ,发生反应
,发生反应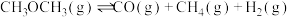 ,测得容器中初始压强为
,测得容器中初始压强为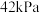 ,时间
,时间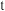 和反应速率
和反应速率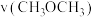 与
与 分压
分压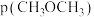 的关系如图乙。
的关系如图乙。
①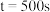 时,
时, 的转化率
的转化率
______________ 。
②若反应速率满足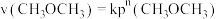 ,则
,则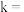
______________ 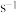 ,
,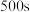 时
时
______________ 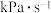 。
。
 是一种主要温室气体,研究
是一种主要温室气体,研究 的利用对促进低碳社会构建具有重要的意义。
的利用对促进低碳社会构建具有重要的意义。
(1)一定条件下,某恒容密闭容器中充入一定量
 和足量
和足量 ,同时发生两个反应:
,同时发生两个反应:Ⅰ.
 ,
,Ⅱ.
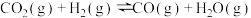 。反应Ⅰ的速率可表示为
。反应Ⅰ的速率可表示为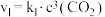 ,反应Ⅱ的速率可表示为
,反应Ⅱ的速率可表示为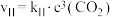 (
(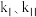 为速率常数)。反应体系中组分
为速率常数)。反应体系中组分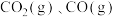 的浓度随时间变化情况如图甲。
的浓度随时间变化情况如图甲。①
 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为 (保留两位有效数字)。
(保留两位有效数字)。②如果反应能够进行到底,反应结束时,
 的
的 转化为
转化为 。
。③活化能较大的反应为
(2)
 还可以转化为甲醚。一定温度下,在恒容密闭容器中通入
还可以转化为甲醚。一定温度下,在恒容密闭容器中通入 ,发生反应
,发生反应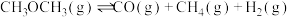 ,测得容器中初始压强为
,测得容器中初始压强为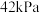 ,时间
,时间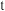 和反应速率
和反应速率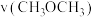 与
与 分压
分压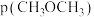 的关系如图乙。
的关系如图乙。①
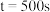 时,
时, 的转化率
的转化率
②若反应速率满足
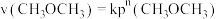 ,则
,则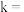
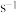 ,
,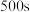 时
时
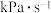 。
。
您最近一年使用:0次



