名校
解题方法
1 . (1)在密闭容器中,一定量混合气体发生下列反应:aM(g)+bN(g)⇌cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则N的转化率_______ (填变大,变小或不变)
(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是_______
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)向相同容积的甲、乙两容器中都分别充入1 mol SO2和0.5 mol O2,若甲容器保持温度、容积不变,乙容器保持温度、压强不变,分别达到平衡,下列说法正确的是_______
A.平衡时,容器内的压强:甲>乙
B.反应达到平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙
D.平衡时,容器内SO3的体积百分数:甲>乙
(4)下列说法正确的是_______
(2)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)向相同容积的甲、乙两容器中都分别充入1 mol SO2和0.5 mol O2,若甲容器保持温度、容积不变,乙容器保持温度、压强不变,分别达到平衡,下列说法正确的是
A.平衡时,容器内的压强:甲>乙
B.反应达到平衡时所需时间:甲<乙
C.平衡时,氧气的浓度:甲<乙
D.平衡时,容器内SO3的体积百分数:甲>乙
(4)下列说法正确的是
| A | B | C | D |
 |  |  |  |
| 绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)⇌2C(g),如图为其正反应速率随时间变化的示意图,则该反应为放热反应 | 催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。如图显示的是催化反应与无催化反应过程中的能量关系 | 将BaO2放入密闭真空容器中,反应2BaO2(s)⇌2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图所示 | 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)⇌N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).则c点与a点相比,c(NO2)增大,c(N2O4)减小 |
您最近一年使用:0次
名校
解题方法
2 . 在密闭容器中,使1molN2和3molH2混合发生下列反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0。
(1)达到平衡时,充入N2并保持体积不变,平衡将______ 移动(填“正向”、“逆向”或“不”)。
(2)达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______ 移动(同上)。
(3)达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______ 移动(同上)。
(1)达到平衡时,充入N2并保持体积不变,平衡将
(2)达到平衡时,充入氩气(Ar)并保持体积不变,平衡将
(3)达到平衡时,充入氩气(Ar),并保持压强不变,平衡将
您最近一年使用:0次
3 . 在密闭容器中进行如下反应:高温条件下,CO2(g)+C(s) 2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C,平衡________ ,c(CO2)________ 。
(2)缩小反应容器的容积,保持温度不变,则平衡__________ ,c(CO2)__________ 。
(3)保持反应容器的容积和温度不变,通入N2,则平衡________ ,c(CO2)________ 。
(4)保持反应容器的容积不变,升高温度,则平衡__________ ,c(CO)__________ 。
 2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。(1)增加C,平衡
(2)缩小反应容器的容积,保持温度不变,则平衡
(3)保持反应容器的容积和温度不变,通入N2,则平衡
(4)保持反应容器的容积不变,升高温度,则平衡
您最近一年使用:0次
名校
解题方法
4 . 工业上用CO和H2反应制备二甲醚(CH3OCH3)的条件是压强2.0~10.0 MPa,温度300 ℃。设备中进行如下反应。
①CO(g)+2H2(g) CH3OH(g) ΔH=-90.7 kJ/mol
CH3OH(g) ΔH=-90.7 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ/mol
CO2(g)+H2(g) ΔH=-41.2 kJ/mol
请回答下列问题:
(1)在温度和容器容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是_______ 。
a.容器中压强保持不变
b. 混合气体中c(CO)不变
c.混合气体的平均相对分子质量不变
d.v正(CO)=v逆(H2)
(2)在容积为2 L的恒温密闭容器中加入a mol CH3OH(g)发生反应②,达到平衡后若再加入a mol CH3OH(g)重新达到平衡时,CH3OH的转化率_______ (填“增大”“减小”或“不变”)。
(3)850 ℃时在一容积为10 L的密闭容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。
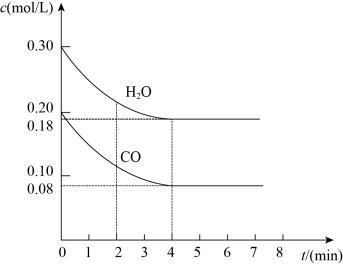
①0~4 min的平均反应速率v(CO)=_______ 。
②若温度不变,向该容器中加入4 mol CO(g)、2 mol H2O(g)、3 mol CO2(g)和3 mol H2(g),起始时v正(CO)_______ v逆(H2)(填“<”“>”或“=”),请结合必要的计算过程说明理由: _______ 。
①CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.7 kJ/mol
CH3OH(g) ΔH=-90.7 kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2 kJ/mol
CO2(g)+H2(g) ΔH=-41.2 kJ/mol请回答下列问题:
(1)在温度和容器容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是
a.容器中压强保持不变
b. 混合气体中c(CO)不变
c.混合气体的平均相对分子质量不变
d.v正(CO)=v逆(H2)
(2)在容积为2 L的恒温密闭容器中加入a mol CH3OH(g)发生反应②,达到平衡后若再加入a mol CH3OH(g)重新达到平衡时,CH3OH的转化率
(3)850 ℃时在一容积为10 L的密闭容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。

①0~4 min的平均反应速率v(CO)=
②若温度不变,向该容器中加入4 mol CO(g)、2 mol H2O(g)、3 mol CO2(g)和3 mol H2(g),起始时v正(CO)
您最近一年使用:0次
名校
5 . 2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。已知:3H2(g)+CO2(g)⇌CH3OH(g)+H2O(g) ΔH=-48.9kJ/mol
(1)为提高CH3OH转化率,理论上应采用的条件是________ (填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[ ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
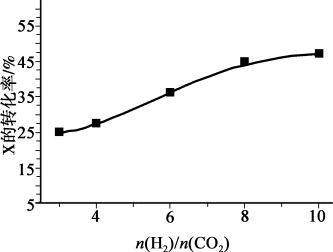
反应物X是_________ (填“CO2”或“H2”),理由是_________ 。
(3)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol,这段时间内H2的平均速率为______ ,化学平衡常数K=___ 。
(1)为提高CH3OH转化率,理论上应采用的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[
 ]时某反应物X平衡转化率变化曲线。
]时某反应物X平衡转化率变化曲线。
反应物X是
(3)250℃、在体积为2.0L的恒容密闭容器中加入6molH2、2molCO2和催化剂,10min时反应达到平衡,测得n(CH3OH)=1.5mol,这段时间内H2的平均速率为
您最近一年使用:0次
6 . 工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
(1)用H2表示前2 h 的平均反应速率v(H2)=__________________________ ;
(2)该温度下,CO2的平衡转化率为________ 。
(3)在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3 通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________ (用含P的表达式表示,其中用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
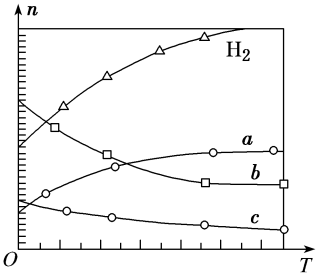
①该反应的ΔH________ 0(填“>”或“<”)。
②曲线c表示的物质为________ 。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是______________ 。(答出一条即可)
 CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
(2)该温度下,CO2的平衡转化率为
(3)在温度为T,压强为P的条件下,将CO2和H2按物质的量之比1∶3 通入一恒压密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①该反应的ΔH
②曲线c表示的物质为
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是
您最近一年使用:0次
2020-11-19更新
|
170次组卷
|
3卷引用:湖北省武汉市江夏实验高级中学2021-2022学年高二上学期10月考试化学试题
7 . 在密闭容器中进行下列反应:CO2(g)+C(s) 2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡________ ,c(CO)________ 。
(2)减小密闭容器的体积,保持温度不变,则平衡___________ ,c(CO2)________ 。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡________ ,c(CO2)________ 。
(4)保持密闭容器的体积不变,升高温度,则平衡___________ ,c(CO)_______ 。
(5)恒压通入N2,CO2的百分含量_________ 。
(6)保持密闭容器的体积和温度不变,加入催化剂,CO2的百分含量________ 。
 2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):(1)增加C,平衡
(2)减小密闭容器的体积,保持温度不变,则平衡
(3)通入N2,保持密闭容器的体积和温度不变,则平衡
(4)保持密闭容器的体积不变,升高温度,则平衡
(5)恒压通入N2,CO2的百分含量
(6)保持密闭容器的体积和温度不变,加入催化剂,CO2的百分含量
您最近一年使用:0次
2020-11-01更新
|
139次组卷
|
2卷引用:山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题
解题方法
8 . Ⅰ.反应N2(g)+3H2(g) 2NH3(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是_________________________ 。
(2)由第一次平衡到第二次平衡,采取的措施是______________________ 。
Ⅱ.在一定温度下,向一容积为5L的恒容密闭容器中充入0.4mol SO2和0.2mol O2,发生反应: 2SO2(g)+O2(g) 2SO3(g) ΔH=-196kJ/mol。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196kJ/mol。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(3)上述反应达到平衡时反应放出的热量为__________ 。
(4)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1_____ T2(填“>”“<”或“=”)。

Ⅲ.一定温度下,在1L恒容密闭容器中充入一定量C2H4(g)和H2O(g),发生如下反应: C2H4(g)+H2O(g) CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图所示。其中T1、T2表示温度,速率方程:v正=k正·c(C2H4)·c(H2O),v逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图所示。其中T1、T2表示温度,速率方程:v正=k正·c(C2H4)·c(H2O),v逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。

(5)N点:
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(6)温度为T1时,测定平衡体系中c(H2O)=0.25 mol·L-1,则 =
=______ L·mol -1。
 2NH3(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g) ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是
(2)由第一次平衡到第二次平衡,采取的措施是
Ⅱ.在一定温度下,向一容积为5L的恒容密闭容器中充入0.4mol SO2和0.2mol O2,发生反应: 2SO2(g)+O2(g)
 2SO3(g) ΔH=-196kJ/mol。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196kJ/mol。经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(3)上述反应达到平衡时反应放出的热量为
(4)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1

Ⅲ.一定温度下,在1L恒容密闭容器中充入一定量C2H4(g)和H2O(g),发生如下反应: C2H4(g)+H2O(g)
 CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图所示。其中T1、T2表示温度,速率方程:v正=k正·c(C2H4)·c(H2O),v逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图所示。其中T1、T2表示温度,速率方程:v正=k正·c(C2H4)·c(H2O),v逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
(5)N点:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(6)温度为T1时,测定平衡体系中c(H2O)=0.25 mol·L-1,则
 =
=
您最近一年使用:0次
9 . 在一容积为 的密闭容器中,加入
的密闭容器中,加入 的
的 和
和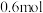 的
的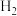 ,在一定条件下发生如下反应:
,在一定条件下发生如下反应: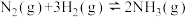
 <
< 。反应中
。反应中 的物质的量浓度的变化情况如图所示,请回答下列问题:
的物质的量浓度的变化情况如图所示,请回答下列问题:
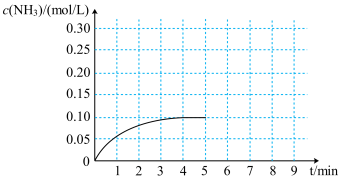
(1)根据图象,计算从反应开始到平衡时,用 表示的平均反应速率
表示的平均反应速率 =
=
(2)该反应达到平衡时 的转化率为
的转化率为
(3)反应达到平衡后,第 末,若保持其他条件不变,仅改变反应温度,则
末,若保持其他条件不变,仅改变反应温度,则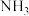 的物质的量浓度不可能为
的物质的量浓度不可能为
a.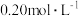 b.
b. c.
c. d.
d.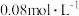
(4)反应达到平衡后,第 末,若保持其他条件不变,只把容器的体积缩小一半,平衡
末,若保持其他条件不变,只把容器的体积缩小一半,平衡
(5)在第 末将容器的体积缩小一半后,若在第
末将容器的体积缩小一半后,若在第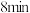 末达到新的平衡(此时
末达到新的平衡(此时 的浓度约为
的浓度约为 )请在图中画出第
)请在图中画出第 末到平衡时
末到平衡时 浓度的变化曲线
浓度的变化曲线
您最近一年使用:0次
2020-10-29更新
|
117次组卷
|
2卷引用:山西省朔州市怀仁县大地学校2019-2020学年高二上学期第一次月考化学试题
名校
10 . 在400℃,1.01×105Pa时,将一定量的SO2和14molO2压入一个装有催化剂的VL密闭反应器中,发生2SO2+O2 2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2。
2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2。
(1)SO2的起始浓度为____ ,SO3(气)的平衡浓度为_____ ;
(2)平衡时SO3(气)占总体积的百分数为___ ,此时体系压强为反应起始时体系压强的____ 倍;
(3)10min时达到平衡后,压缩反应器体积为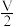 ,一段时间后,达到新的平衡,此时SO3(气)的浓度
,一段时间后,达到新的平衡,此时SO3(气)的浓度_ (大于、小于、等于)10min时SO3(气)浓度的2倍。
(4)10min时达到平衡后,保持容器体积不变,向容器中再充入1molSO2,O2的转化率___ (增大、减小、不变)
 2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2。
2SO3的反应,并且在10min后达到平衡时,测得容器内有2molSO2和12molO2。(1)SO2的起始浓度为
(2)平衡时SO3(气)占总体积的百分数为
(3)10min时达到平衡后,压缩反应器体积为
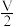 ,一段时间后,达到新的平衡,此时SO3(气)的浓度
,一段时间后,达到新的平衡,此时SO3(气)的浓度(4)10min时达到平衡后,保持容器体积不变,向容器中再充入1molSO2,O2的转化率
您最近一年使用:0次