解题方法
1 . 在一定条件下,反应x A+yB zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是_______ ;
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向______ (填“正”或“逆”)反应方向移动;
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为____ 态;
(4)加热后C的质量分数减少,则正反应是________ (填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变___ (填“大”或“小”)。
 zC达到平衡:
zC达到平衡:(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为
(4)加热后C的质量分数减少,则正反应是
您最近一年使用:0次
2022-12-05更新
|
48次组卷
|
2卷引用:贵州省金沙县精诚中学2021-2022学年高二上学期期中理综化学试题
名校
解题方法
2 . 根据化学反应原理回答下列问题:
(1)在一定条件下的密闭容器中,等物质的量的A、B发生可逆反应 。达到平衡后,如果保持温度不变,压缩容器的体积,则平衡
。达到平衡后,如果保持温度不变,压缩容器的体积,则平衡_______ 移动(填“正向”、“逆向”或“不”);再达到平衡时,B的百分含量_______ (填“增大”、“减小”或“不变”)。
(2)在一定条件下的密闭容器中,可逆反应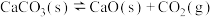 △H>0,达到平衡。如果保持温度和容器容积不变,再通入少量
△H>0,达到平衡。如果保持温度和容器容积不变,再通入少量 ,则平衡
,则平衡_______ 移动(填“正向”、“逆向”或“不”);再达到平衡时,容器的压强_______ (填“增大”、“减小”或“不变”)
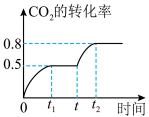
(3)已知 ,在一定温度下,向一恒温容积可变的容器中充入1mol
,在一定温度下,向一恒温容积可变的容器中充入1mol  (g)、2mol
(g)、2mol  (g),
(g), 的转化率与反应时间的关系如图所示。在t时加压保持温度不变,若
的转化率与反应时间的关系如图所示。在t时加压保持温度不变,若 时容器容积为1000mL,则
时容器容积为1000mL,则 时容器容积为
时容器容积为_______ mL。
(4)一定量的 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: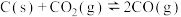 ,平衡时,体系中气体体积分数与温度的关系如图所示:
,平衡时,体系中气体体积分数与温度的关系如图所示:

已知:气体分压(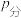 )=气体总压(
)=气体总压( )×体积分数。925℃时,已知总压为
)×体积分数。925℃时,已知总压为 ,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______ 。
(5) 和
和 组合形成的燃料电池的结构如图所示,质子(
组合形成的燃料电池的结构如图所示,质子( )交换膜左右两侧的溶液均为1L 2
)交换膜左右两侧的溶液均为1L 2 的
的 溶液。
溶液。
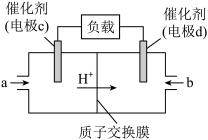
电极c是_______ (填“正”或“负”)极,写出物质a在电极c上发生的反应式为_______ 。
(1)在一定条件下的密闭容器中,等物质的量的A、B发生可逆反应
 。达到平衡后,如果保持温度不变,压缩容器的体积,则平衡
。达到平衡后,如果保持温度不变,压缩容器的体积,则平衡(2)在一定条件下的密闭容器中,可逆反应
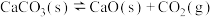 △H>0,达到平衡。如果保持温度和容器容积不变,再通入少量
△H>0,达到平衡。如果保持温度和容器容积不变,再通入少量 ,则平衡
,则平衡(3)已知
 ,在一定温度下,向一恒温容积可变的容器中充入1mol
,在一定温度下,向一恒温容积可变的容器中充入1mol  (g)、2mol
(g)、2mol  (g),
(g), 的转化率与反应时间的关系如图所示。在t时加压保持温度不变,若
的转化率与反应时间的关系如图所示。在t时加压保持温度不变,若 时容器容积为1000mL,则
时容器容积为1000mL,则 时容器容积为
时容器容积为
(4)一定量的
 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应: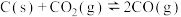 ,平衡时,体系中气体体积分数与温度的关系如图所示:
,平衡时,体系中气体体积分数与温度的关系如图所示:
已知:气体分压(
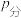 )=气体总压(
)=气体总压( )×体积分数。925℃时,已知总压为
)×体积分数。925℃时,已知总压为 ,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(5)
 和
和 组合形成的燃料电池的结构如图所示,质子(
组合形成的燃料电池的结构如图所示,质子( )交换膜左右两侧的溶液均为1L 2
)交换膜左右两侧的溶液均为1L 2 的
的 溶液。
溶液。
电极c是
您最近一年使用:0次
2022-11-06更新
|
556次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期中考试化学试题
名校
3 . 甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:
I.
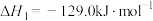
II.

III.

回答下列问题:
(1)
_______ 。
(2)将2.0mol 和3.0mol
和3.0mol  通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得
通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
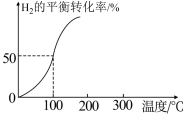
①100℃时反应达到平衡所需的时间为5min,则反应从起始至5min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为_______ 。
②100℃时,反应II的平衡常数K=_______ 。
③下列可用来判断该反应已达到平衡状态的有_______ (填标号)。
A.CO的含量保持不变 B.容器中
C.容器中混合气体的密度保持不变 D.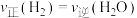
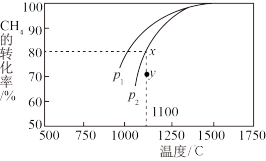
(3)利用天然气制取合成气的原理 ,在密闭容器中通入物质的量浓度均为1
,在密闭容器中通入物质的量浓度均为1 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
_______  (填“大于”或“小于”);压强为
(填“大于”或“小于”);压强为 时,在Y点:
时,在Y点:
_______ 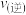 (填“大于”“小于”或“等于”)。为了提高该反应中
(填“大于”“小于”或“等于”)。为了提高该反应中 的转化率,除温度、压强外还可以采取的措施是
的转化率,除温度、压强外还可以采取的措施是_______ 。
 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:I.

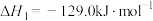
II.


III.


回答下列问题:
(1)

(2)将2.0mol
 和3.0mol
和3.0mol  通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得
通入容积为3L的恒容密闭容器中,在一定条件下发生反应II,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
①100℃时反应达到平衡所需的时间为5min,则反应从起始至5min内,用
 表示该反应的平均反应速率为
表示该反应的平均反应速率为②100℃时,反应II的平衡常数K=
③下列可用来判断该反应已达到平衡状态的有
A.CO的含量保持不变 B.容器中

C.容器中混合气体的密度保持不变 D.
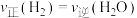
(3)利用天然气制取合成气的原理
 ,在密闭容器中通入物质的量浓度均为1
,在密闭容器中通入物质的量浓度均为1 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
 (填“大于”或“小于”);压强为
(填“大于”或“小于”);压强为 时,在Y点:
时,在Y点:
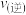 (填“大于”“小于”或“等于”)。为了提高该反应中
(填“大于”“小于”或“等于”)。为了提高该反应中 的转化率,除温度、压强外还可以采取的措施是
的转化率,除温度、压强外还可以采取的措施是
您最近一年使用:0次
2022-11-19更新
|
118次组卷
|
2卷引用:吉林省长春市第二实验中学2022-2023学年高二上学期期中考试化学试题
名校
4 . 氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2mol ,放出92.2kJ热量。写出合成氨反应的热化学方程式
,放出92.2kJ热量。写出合成氨反应的热化学方程式_______ ;该可逆反应,若起始时向容器内放入2mol  和6mol
和6mol  ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______ 184.4kJ。
(2)反应 的化学平衡常数表达式为
的化学平衡常数表达式为_______ 。请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_______ 。
(3)在一定条件下氨的平衡含量如下表。
其他条件不变时,温度升高氨的平衡含量改变的原因是_______ (填字母序号)。
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是_______ 。
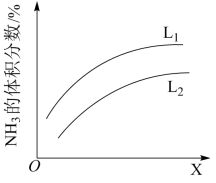
(4)如图是合成氨反应平衡混合气中 的体积分数随温度或压强变化的曲线,图中L(
的体积分数随温度或压强变化的曲线,图中L( 、
、 )、X分别代表温度或压强。其中X代表的是
)、X分别代表温度或压强。其中X代表的是_______ (填“温度”或“压强”);判断小 、
、 的大小关系并说明理由
的大小关系并说明理由_______ 。
(1)合成氨工业中,合成塔中每产生2mol
 ,放出92.2kJ热量。写出合成氨反应的热化学方程式
,放出92.2kJ热量。写出合成氨反应的热化学方程式 和6mol
和6mol  ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)(2)反应
 的化学平衡常数表达式为
的化学平衡常数表达式为| 序号 | 化学反应 | K(298K)的数值 |
| ① |  |  |
| ② |  | 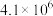 |
| 温度/℃ | 压强/Mpa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(4)如图是合成氨反应平衡混合气中
 的体积分数随温度或压强变化的曲线,图中L(
的体积分数随温度或压强变化的曲线,图中L( 、
、 )、X分别代表温度或压强。其中X代表的是
)、X分别代表温度或压强。其中X代表的是 、
、 的大小关系并说明理由
的大小关系并说明理由
您最近一年使用:0次
2022-11-06更新
|
111次组卷
|
3卷引用:北京市第七中学2022-2023学年高二上学期期中化学试题
解题方法
5 . 2018年是合成氨工业先驱哈珀获得诺贝尔奖100周年,合成氨工业对化学工业和国防工业具有重要意义。
I.N2和H2生成NH3的反应为: N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH(298K)=-46.2kJ·mol-1, 在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) ΔH(298K)=-46.2kJ·mol-1, 在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N* , H2(g)→2H*
表面反应:N*+H*→NH* ,NH*+H*→NH2 * ,NH2 *+H*→NH3*
脱附: NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定合成氨的整体反应速率
(1)利于提高合成氨平衡产率的条件有_______ 。
A.高温 B.低温 C.低压 D.高压 E.催化剂
(2)实际生产中常用工艺条件:Fe作催化剂。控制温度773K,压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由(任写一条)_______ 。
②关于合成氨工艺的下列理解,正确的是_______ (填选项字母)。
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.迅速冷却可将NH3液化,不断将液态氨移去,有利于反应正向进行
D.分离空气可得到N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
II.工业合成氨生产示意图如图所示:
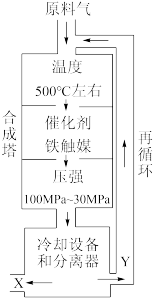
(3)X的化学式为_______ 。
(4)图中条件选定的主要原因是_______ (填字母)。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(5)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和 NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是_______ 。其中表示平衡混合物中NH3的含量最高的一段时间是_______ (填字母)。
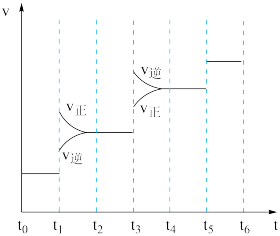
A.0~t1 B.t2~t3 C.t4~t5 D.t5~t6
I.N2和H2生成NH3的反应为:
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH(298K)=-46.2kJ·mol-1, 在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) ΔH(298K)=-46.2kJ·mol-1, 在Fe催化剂作用下的反应历程如下(*表示吸附态)化学吸附:N2(g)→2N* , H2(g)→2H*
表面反应:N*+H*→NH* ,NH*+H*→NH2 * ,NH2 *+H*→NH3*
脱附: NH3*
 NH3(g)
NH3(g)其中,N2的吸附分解反应活化能高、速率慢,决定合成氨的整体反应速率
(1)利于提高合成氨平衡产率的条件有
A.高温 B.低温 C.低压 D.高压 E.催化剂
(2)实际生产中常用工艺条件:Fe作催化剂。控制温度773K,压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由(任写一条)
②关于合成氨工艺的下列理解,正确的是
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.迅速冷却可将NH3液化,不断将液态氨移去,有利于反应正向进行
D.分离空气可得到N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
II.工业合成氨生产示意图如图所示:

(3)X的化学式为
(4)图中条件选定的主要原因是
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(5)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和 NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是

A.0~t1 B.t2~t3 C.t4~t5 D.t5~t6
您最近一年使用:0次
解题方法
6 . 氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:
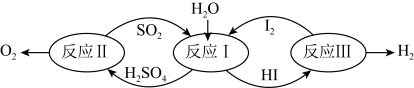
(1)反应Ⅰ的化学方程式是___ 。
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ·mol-1;ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为___ 。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。
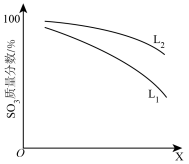
①X代表的物理量是___ 。
②判断L1、L2的大小关系:L1___ L2(填“>”“<”或“=”)。

(1)反应Ⅰ的化学方程式是
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ·mol-1;ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是
②判断L1、L2的大小关系:L1
您最近一年使用:0次
2020-11-18更新
|
54次组卷
|
2卷引用:内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题
名校
7 . 按要求完成下列问题。
(1)已知充分燃烧 乙炔
乙炔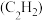 气体时生成
气体时生成 二氧化碳气体和液态水,并放出热量
二氧化碳气体和液态水,并放出热量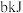 ,则表示乙炔燃烧热的热化学方程式为
,则表示乙炔燃烧热的热化学方程式为___________ 。
(2) ,
, 时,强酸与强碱的稀溶液发生中和反应时,每生成
时,强酸与强碱的稀溶液发生中和反应时,每生成 会放出
会放出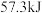 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:___________ 。
(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)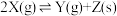
(乙)
当下列物理量不再发生交化时,共中能表明(甲)达到化学平衡状态是___________ ;能表明(乙)达到化学平衡状态是___________ 。
①混合气体的密度②反应容器中生成物的百分含量③反应物的消耗速率与生成物的消耗速率之比等于系数之比④混合气体的压强⑤混合气体的平均相对分子质量⑥混合气体的总物质的量
(4) 和
和 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: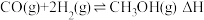 。已知:
。已知: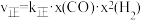 ,
,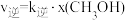 ,其中
,其中 为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和
为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和 ,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
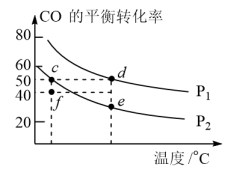
①
___________  (填“>”“<”);升高温度,
(填“>”“<”);升高温度,
___________ (填“增大”“减小”或“不变”);
②c、d、e三点平衡常数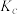 、
、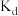 、
、 三者之间的关系为
三者之间的关系为___________ ;
③f点,
___________ 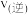 (填“大于”、“等于”或“小于”)。
(填“大于”、“等于”或“小于”)。
(1)已知充分燃烧
 乙炔
乙炔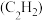 气体时生成
气体时生成 二氧化碳气体和液态水,并放出热量
二氧化碳气体和液态水,并放出热量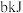 ,则表示乙炔燃烧热的热化学方程式为
,则表示乙炔燃烧热的热化学方程式为(2)
 ,
, 时,强酸与强碱的稀溶液发生中和反应时,每生成
时,强酸与强碱的稀溶液发生中和反应时,每生成 会放出
会放出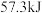 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)
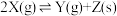
(乙)

当下列物理量不再发生交化时,共中能表明(甲)达到化学平衡状态是
①混合气体的密度②反应容器中生成物的百分含量③反应物的消耗速率与生成物的消耗速率之比等于系数之比④混合气体的压强⑤混合气体的平均相对分子质量⑥混合气体的总物质的量
(4)
 和
和 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: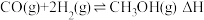 。已知:
。已知: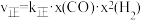 ,
,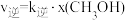 ,其中
,其中 为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和
为各组分的体积分数。在密闭容器中按物质的量之比为1:2充入CO和 ,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
①

 (填“>”“<”);升高温度,
(填“>”“<”);升高温度,
②c、d、e三点平衡常数
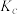 、
、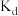 、
、 三者之间的关系为
三者之间的关系为③f点,

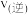 (填“大于”、“等于”或“小于”)。
(填“大于”、“等于”或“小于”)。
您最近一年使用:0次
解题方法
8 . 反应 Fe(s)+CO2(g)⇌FeO(s)+CO(g) △H1,平衡常数为 K1,反应 Fe(s)+H2O(g)⇌FeO(s)+H2(g) △H2,平衡常数为 K2;在不同温度时 K1、K2 的值如表:
(1) 反应 CO2(g)+H2(g)⇌CO(g)+H2O(g)的反应热为△H ,平衡常数为 K,则△H=____________ (用△H1 和△H2 表 示), K= _______________ (用 K1 和 K2 表示),且由上述计算可知,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)是______________________________ 反应(填“吸热”或“放热”)。
(2) 现有反应:mA(g)+nB(g) ⇌ pC(g)达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为反应___________ (填“吸热”或“放热”,且 m+n___ p(填“>"“=或“<”)
②减压使容器容积增大时,A的质量分数____________ (填“增大”“减小”或“不变”,下同)。
③若容积不变加入B,则A的转化率_______________ , B的转化率 ______________
④ 若加入催化剂,平衡时气体混合物的总物质的量____________
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
(1) 反应 CO2(g)+H2(g)⇌CO(g)+H2O(g)的反应热为△H ,平衡常数为 K,则△H=
(2) 现有反应:mA(g)+nB(g) ⇌ pC(g)达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为反应
②减压使容器容积增大时,A的质量分数
③若容积不变加入B,则A的转化率
④ 若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
名校
解题方法
9 . 氮是地球上含量较丰富的一种元素,氮的化合物在工业生产和生活中有重要的作用。
I.已知298K时,发生反应:N2O4(g) 2NO2(g)△H>0
2NO2(g)△H>0
(1)在密闭容器内,一定条件下该反应达到平衡,当分别改变下列条件时,填写下列空白:
①达到平衡时,升高温度,平衡将________ 移动。(填“正向”、“逆向”或“不”)
②达到平衡时,充入Ar气,并保持体积不变,平衡将_________ 移动。(填“正向”、“逆向"或“不”)
③保持容器容积不变,再通入一定量N2O4,,达到平衡时NO2的百分含量________ (填“增大”“减小”或“不变”,下同)。
④保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时N2O4的转化率_____ 。
(2)恒容密闭容器中发生上述反应,已知v正=k正·p(N2O4),v逆=k逆·p2(NO2),Kp=__________ (用k正、k逆表示)。若初始压强为100kPa,k正=2.7×104s-1,当NO2的物质的量分数为50%时,v正=_________ kPa·s-1。[其中Kp为平衡常数,用平衡分压代替平衡浓度计算,p(N2O4)和p(NO2)分别是N2O4和NO2的分压,分压=p总×物质的量分数,k正、k逆为速率常数]
II.在催化剂作用下,H2可以还原NO消除污染,反应为:2NO(g)+2H2(g) N2(g)+2H2O(g)△H=-664kJ/mol
N2(g)+2H2O(g)△H=-664kJ/mol
(3)将2molNO和1molH2充入一个恒容的密闭容器中,经相同时间测得N2的体积分数与温度的关系如图所示。

低于900K时,N2的体积分数_______ (填“是”或“不是")对应温度下平衡时的体积分数,原因是_______________________________ 。高于900K时,Nz的体积分数降低的可能原因是__________________________________________________________ (答出两点)。
I.已知298K时,发生反应:N2O4(g)
 2NO2(g)△H>0
2NO2(g)△H>0(1)在密闭容器内,一定条件下该反应达到平衡,当分别改变下列条件时,填写下列空白:
①达到平衡时,升高温度,平衡将
②达到平衡时,充入Ar气,并保持体积不变,平衡将
③保持容器容积不变,再通入一定量N2O4,,达到平衡时NO2的百分含量
④保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时N2O4的转化率
(2)恒容密闭容器中发生上述反应,已知v正=k正·p(N2O4),v逆=k逆·p2(NO2),Kp=
II.在催化剂作用下,H2可以还原NO消除污染,反应为:2NO(g)+2H2(g)
 N2(g)+2H2O(g)△H=-664kJ/mol
N2(g)+2H2O(g)△H=-664kJ/mol(3)将2molNO和1molH2充入一个恒容的密闭容器中,经相同时间测得N2的体积分数与温度的关系如图所示。

低于900K时,N2的体积分数
您最近一年使用:0次
解题方法
10 . 氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________ 92.4kJ.(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________ ;N2和H2的转化率比是___________ 。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________ 。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________ (填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________ (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________ (填“大于”、“小于”或“等于”)原来的2倍。
II.该反应在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
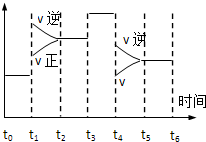
(1)t1、t3、时刻,体系中分别是什么条件发生了变化?
t1_____________________ ,t3_____________________ 。
(2)下列时间段中,氨的百分含量最高的是_______
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
Ⅲ.在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生该反应,反应中NH3的物质的量浓度的变化情况如图所示:
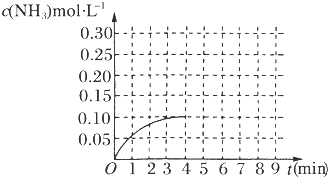
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________ 。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________ 。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____ (选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________ (选填“增大”、“减小”或“不变”)。
 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量
(2)当反应达到平衡时,N2和H2的浓度比是
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
II.该反应在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1、t3、时刻,体系中分别是什么条件发生了变化?
t1
(2)下列时间段中,氨的百分含量最高的是
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
Ⅲ.在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生该反应,反应中NH3的物质的量浓度的变化情况如图所示:

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积
您最近一年使用:0次



