名校
解题方法
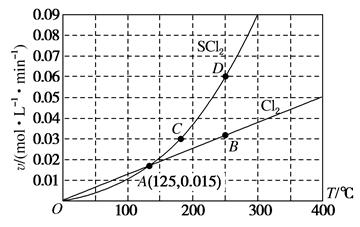
1 . 一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应: S2Cl2(g)+Cl2(g) 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图,以下说法错误的是
| A.正反应的活化能大于逆反应的活化能 |
| B.A、B、C、D四点对应状态下,达到平衡状态的为A点 |
| C.一定温度下,在密闭容器中达到平衡后缩小容器体积,重新达到平衡后,S2Cl2的平衡转化率不变 |
| D.达到平衡后再加热,平衡向逆反应方向移动 |
您最近一年使用:0次
2021-03-29更新
|
326次组卷
|
3卷引用:山东省临沂第七中学2021届高三上学期期末考试化学试题
2 . 下列有关化学平衡的说法正确的是
A.对于恒温密闭容器中进行的反应N2(g)+3H2(g) 2NH3(g),若N2的体积分数保持不变,则一定说明反应已达到平衡状态 2NH3(g),若N2的体积分数保持不变,则一定说明反应已达到平衡状态 |
| B.一定温度下,将2.0g CaCO3固体置于1L恒容密闭容器中充分反应后,c(CO2)=0.0125mol/L,若保持温度不变,将容器体积扩大至2L,达到新平衡后c(CO2)=0.01mol/L |
C.反应:CH4(g)+H2O(g) CO(g)+3H2(g) ∆H>0,在其它条件不变的情况下,升高温度、减小容器体积、增大水蒸气的浓度均能提高CH4的平衡转化率 CO(g)+3H2(g) ∆H>0,在其它条件不变的情况下,升高温度、减小容器体积、增大水蒸气的浓度均能提高CH4的平衡转化率 |
D.一定温度下,恒容密闭容器中充入一定量NO2发生反应:2NO2 N2O4达到平衡后,再向容器中充入一定量的NO2并达到新的平衡,则NO2体积分数先增大后减小,但比原平衡小 N2O4达到平衡后,再向容器中充入一定量的NO2并达到新的平衡,则NO2体积分数先增大后减小,但比原平衡小 |
您最近一年使用:0次
3 . 如图,I是恒压密闭容器,II是恒容密闭容器。其它条件相同时,在I、II中分n别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)⇌aZ(g)。此时I中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
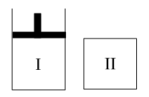

| A.若X、Y均为气态,则平衡时气体平均摩尔质量:II>I, |
| B.若X、Y不均为气态,则平衡时气体平均摩尔质量:I>II |
| C.若X为固态,Y为气态,则I、II中从起始到平衡所需时间相同 |
| D.平衡时I容器的体积小于VL |
您最近一年使用:0次
名校
解题方法
4 . 某密闭容器中,按物质的量之比1:1充入X、Y两种气体,发生反应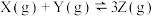
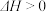 ,达到平衡后,下列有关说法正确的是
,达到平衡后,下列有关说法正确的是
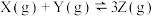
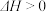 ,达到平衡后,下列有关说法正确的是
,达到平衡后,下列有关说法正确的是| A.继续通入少量物质的量之比为1:1的X、Y气体,保持容器容积不变,达到新平衡时,Z的体积分数增大 |
| B.其他条件不变,升高温度,正逆反应速率都增大,平衡时Z的体积分数比原平衡的体积分数大,平衡常数增大 |
| C.其他条件不变,将容积压缩至原来的一半,平衡逆向移动,平衡时X的体积分数比原平衡的体积分数大,平衡常数减小 |
| D.保持容器容积不变,增加Z的量,平衡逆向移动,平衡时Z的浓度比原平衡的小,体积分数比原平衡的体积分数小 |
您最近一年使用:0次
2020-12-30更新
|
392次组卷
|
6卷引用:安徽省蚌埠第三中学2020-2021学年高二上学期1月教学质量检测化学试题
安徽省蚌埠第三中学2020-2021学年高二上学期1月教学质量检测化学试题陕西省商洛市2020-2021学年高二上学期期末教学质量检测化学试题安徽省六安市舒城中学2020-2021学年高二上学期期末考试化学试题河南省名校联盟2020-2021学年高二上学期12月联合考试化学试题(已下线)练习8 化学平衡的移动-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)
5 . 已知反应: 。当反应达平衡时,
。当反应达平衡时,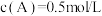 ,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得
,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得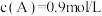 ,下列说法错误的是
,下列说法错误的是
 。当反应达平衡时,
。当反应达平衡时,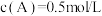 ,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得
,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得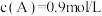 ,下列说法错误的是
,下列说法错误的是A. 的状态一定是气体 的状态一定是气体 | B.平衡常数不变 |
| C.平衡向逆反应方向移动 | D. |
您最近一年使用:0次
2021-02-06更新
|
208次组卷
|
2卷引用:四川省内江市2020-2021学年度第一学期高二期末检测化学试题
6 . t ℃时,在一密闭容器中充入2molA和3 mol B,发生如下化学反应:aA(g)+B(g)⇌C(g)+D(g)。已知,平衡时,ca(A)·c(B)= c(C)·c(D),然后在温度不变的情况下,扩大容器容积至原来10 倍,结果A的百分含量始终未有改变,则下列说法错误的是
| A.a=1 |
| B.B的转化率为24% |
| C.平衡常数K=1 |
| D.温度不变的情况下,扩大容器容积,平衡不移动 |
您最近一年使用:0次
7 . 反应2SO2(g)+O2(g)  2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
 2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是| A.反应物的总能量高于生成物的总能量 |
| B.催化剂可以降低硫氧键键能 |
| C.加压有利于SO3生成,所以工业上压强越高越好 |
| D.升高温度可以增大正反应速率,降低逆反应速率 |
您最近一年使用:0次
8 . 在硫酸工业中,通过下列反应使SO2氧化为SO3:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是
2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是
 2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是
2SO3(g) △H=-196.6kJ/mol。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。下列说法错误的是温度/℃ | 平衡时SO2的转化率/% | ||||
0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
500 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
| A.从理论上分析,为了使二氧化硫尽可能多转化为三氧化硫,应选择的条件是450℃,10MPa |
| B.在实际生产中,选定的温度为400~500℃原因是考虑催化剂的活性最佳 |
| C.在实际生产中,为了增大SO2的转化率可以无限量通入空气 |
| D.在实际生产中,采用的压强为常压原因是常压时转化率已经很高,增大压强对设备及成本要求太高 |
您最近一年使用:0次
2021-01-15更新
|
296次组卷
|
3卷引用:辽宁省丹东市2020-2021学年高二上学期期末考试化学试题
辽宁省丹东市2020-2021学年高二上学期期末考试化学试题山西省汾阳市汾阳中学2020-2021学年高二下学期开学考试化学试题(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)
名校
9 . 下列有关说法正确的是
| A.在外加电流的阴极保护法中,海上石油钢铁钻井平台与直流电源的负极相连 |
| B.常温下,BaSO4分别在同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 |
| C.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
D.对于N2(g)+3H2(g)  2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应速率增大、逆反应速率减小,平衡正向移动 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应速率增大、逆反应速率减小,平衡正向移动 |
您最近一年使用:0次
2020-11-07更新
|
184次组卷
|
2卷引用:江苏省扬州市江都区大桥高级中学2020-2021学年高二下学期学情检测(一)化学试题
10 . 某温度下,在甲、乙、丙三个恒容密闭容器中进行反应CO2(g)+H2(g) CO(g)+H2O(g),起始时投料如下表,达到平衡状态时K=4.
CO(g)+H2O(g),起始时投料如下表,达到平衡状态时K=4.
下列有关说法正确的是
 CO(g)+H2O(g),起始时投料如下表,达到平衡状态时K=4.
CO(g)+H2O(g),起始时投料如下表,达到平衡状态时K=4. 起始浓度(mol·L-1) | 甲 | 乙 | 丙 |
c(CO2) | 0.01 | 0.02 | 0.02 |
c(H2) | 0.01 | 0.01 | 0.02 |
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为0.25 CO2(g)+H2(g)的平衡常数为0.25 |
| B.平衡的时间:t丙>t乙>t甲 |
| C.平衡时,CO2的转化率:乙<甲<丙 |
| D.平衡时,H2的转化率:甲=丙<乙 |
您最近一年使用:0次
2021-05-13更新
|
186次组卷
|
2卷引用:山东省淄博市沂源县第二中学2020-2021学年高二下学期期中考试化学试题



