1 . 2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭成功发射,并顺利完成与天和核心舱对接。火箭采用偏二甲肼(C2H8N2)/N2O4发动机,核心舱电源系统由锂离子蓄电池组以及三结砷化镓(GaAs)太阳电池翼组成。氮化硼(BN)陶瓷基复合材料应用于核心舱电推进系统,碳化硅(SiC)颗粒增强铝基复合材料应用于太阳电池翼伸展机构关键部件,表面处理后镁合金部件应用在核心舱医学样本分析与高微重力科学实验柜中。偏二甲肼(C2H8N2)/N2O4发动机中使用的N2O4存在着N2O4(g)  2NO2(g)平衡。下列说法不正确的是
2NO2(g)平衡。下列说法不正确的是
 2NO2(g)平衡。下列说法不正确的是
2NO2(g)平衡。下列说法不正确的是| A.恒温恒容条件下,若混合气体的颜色保持不变,则该反应达到平衡状态 |
| B.当v (N2O4)正=2 v (NO2)正时,该反应达到平衡状态 |
| C.恒温恒容条件下,达平衡状态后,再充入一定量的N2O4,N2O4转化率将减小 |
| D.该反应在一定条件下能自发进行的原因是∆H>0,∆S>0 |
您最近一年使用:0次
名校
解题方法
2 . 通过反应Ⅰ: 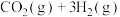

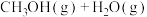
 ,可以实现温室气体资源化利用。该反应通过如下步骤实现:
,可以实现温室气体资源化利用。该反应通过如下步骤实现:
反应Ⅱ: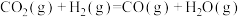
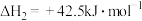
反应Ⅲ:
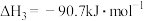
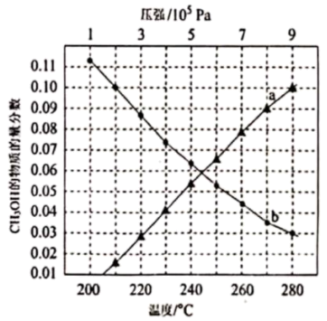
密闭容器中,反应物起始物质的量比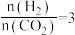 时,在不同条件下(分别在温度为250℃下压强变化和在压强为
时,在不同条件下(分别在温度为250℃下压强变化和在压强为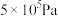 下温度变化)达到平衡时
下温度变化)达到平衡时 物质的量分数变化如图所示。下列有关说法正确的是
物质的量分数变化如图所示。下列有关说法正确的是
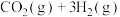

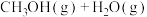
 ,可以实现温室气体资源化利用。该反应通过如下步骤实现:
,可以实现温室气体资源化利用。该反应通过如下步骤实现:反应Ⅱ:
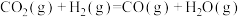
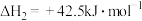
反应Ⅲ:

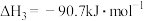
密闭容器中,反应物起始物质的量比
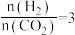 时,在不同条件下(分别在温度为250℃下压强变化和在压强为
时,在不同条件下(分别在温度为250℃下压强变化和在压强为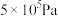 下温度变化)达到平衡时
下温度变化)达到平衡时 物质的量分数变化如图所示。下列有关说法正确的是
物质的量分数变化如图所示。下列有关说法正确的是
A.反应Ⅰ的平衡常数可表示为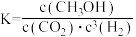 |
B.曲线 表示CH3OH的物质的量分数随温度变化 表示CH3OH的物质的量分数随温度变化 |
| C.提高CO2转化为CH3OH的转化率,需要研发在低温区高效的催化剂 |
D.在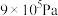 、280℃条件下,平衡时CH3OH的物质的量分数为0.10 、280℃条件下,平衡时CH3OH的物质的量分数为0.10 |
您最近一年使用:0次
2021-09-11更新
|
390次组卷
|
3卷引用:江苏省苏州市2021-2022学年高三上学期期初调研考试化学试题
3 . 工业制硫酸的一步重要反应是SO2在400~600℃下的催化氧化:2SO2(g)+ O2(g)⇌2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法正确的是
| A.使用催化剂可加快反应速率,提高SO3产率 |
| B.其它条件保持不变,温度越高,速率越快,生产效益越好 |
| C.实际生产中选定400~600℃作为操作温度,其原因是在此温度下催化剂的活性最高 |
| D.增大压强可以提高SO3产率,但高压对动力和设备要求太高,会增加生产成本 |
您最近一年使用:0次
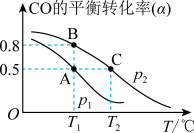
4 . CO可用于合成甲醇,其反应的化学方程式为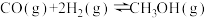 。一容积可变的密闭容器中充有10 molCO与20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)压强(p)的关系如图所示。下列说法
。一容积可变的密闭容器中充有10 molCO与20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)压强(p)的关系如图所示。下列说法不正确 的是
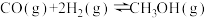 。一容积可变的密闭容器中充有10 molCO与20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)压强(p)的关系如图所示。下列说法
。一容积可变的密闭容器中充有10 molCO与20 mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)压强(p)的关系如图所示。下列说法
| A.合成甲醇的反应为放热反应 |
| B.压强为P1<P2 |
| C.A、B、C三点的平衡常数为KA=KB>KC |
| D.A点的v正和C点的v逆相等 |
您最近一年使用:0次
2021-11-12更新
|
163次组卷
|
3卷引用: 浙江省金华十校2021-2022学年高三上学期11月模拟考试化学试题
浙江省金华十校2021-2022学年高三上学期11月模拟考试化学试题浙江省山河联盟2021-2022学年高二上学期12月考试化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
5 . 在体积可变的密闭容器中投入0.5molE和1molF,在一定条件下发生反应: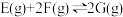
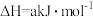 (a<0)。实验测得平衡时F的转化率随温度、压强的变化如图所示。下列说法错误的是
(a<0)。实验测得平衡时F的转化率随温度、压强的变化如图所示。下列说法错误的是

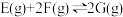
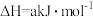 (a<0)。实验测得平衡时F的转化率随温度、压强的变化如图所示。下列说法错误的是
(a<0)。实验测得平衡时F的转化率随温度、压强的变化如图所示。下列说法错误的是
A.Y代表压强,且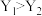 |
B.M、M两点对应的平衡常数: |
C.M、N两点对应的 |
| D.保持温度和压强不变,向平衡体系中再充入物质的量之比为1:2的E(g)和F(g),平衡时反应物的转化率增大 |
您最近一年使用:0次
名校
解题方法
6 . 一定条件下恒温恒容的装置中,固体A和气体B可以反应生成气体C,反应过程中各物质的物质的量随时间的变化如图所示。下列关于该反应的说法正确的是
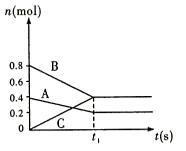

| A.若t1时刻是40s,用B表示该反应的0~t1时段的速率为0.01mol/(L·s) |
| B.t1时刻后,压缩该容器的体积增大压强,C的物质的量增多 |
| C.t1时刻后,再加入1molB,再次达到平衡后C的物质的量为0.9mol |
D.t1时刻后,升高体系的温度,容器内气体的密度减小,该反应的 |
您最近一年使用:0次
2021-11-06更新
|
144次组卷
|
3卷引用:湘豫名校2021-2022学年高三上学期联考(11月)化学试题
7 . 在423K下,同时向容积相同的两密闭容器A和B中,分别加入2 mol HI及1 mol HI气体,待反应2HI(g) H2(g)+I2(g)达到平衡,下列说法中肯定正确的是
H2(g)+I2(g)达到平衡,下列说法中肯定正确的是
 H2(g)+I2(g)达到平衡,下列说法中肯定正确的是
H2(g)+I2(g)达到平衡,下列说法中肯定正确的是| A.从反应开始到建立平衡所需时间:t(A)>t(B) |
| B.平衡时HI的转化率(α)∶α(A)=α(B) |
| C.平衡时I2蒸气在混合气体中的体积分数:A容器中>B容器中 |
| D.平衡时I2在A容器中的浓度c (I2)A等于I2在B容器中的浓度c(I2)B |
您最近一年使用:0次
21-22高三上·江苏·阶段练习
名校
8 . 根据流程图,下列有关硝酸工业制备说法不正确 的是
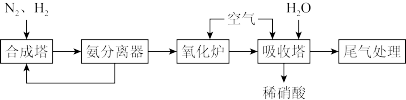

| A.合成塔中使用催化剂,可以提高单位时间内N2的转化率 |
| B.加压可以提高氧化炉中NH3的平衡转化率 |
| C.吸收塔中鼓入过量的空气可以提高硝酸的产率 |
| D.采用气-液逆流接触法是为了使尾气中的氮氧化物吸收更充分 |
您最近一年使用:0次
名校
9 . 利用传感技术可探究压强对2NO2(g) N2O4(g)化学平衡移动的影响。在常温、100 kPa条件下,往注射器中充入适量NO2气体,当活塞位置不变时,分别在t1、t2s时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是
N2O4(g)化学平衡移动的影响。在常温、100 kPa条件下,往注射器中充入适量NO2气体,当活塞位置不变时,分别在t1、t2s时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是
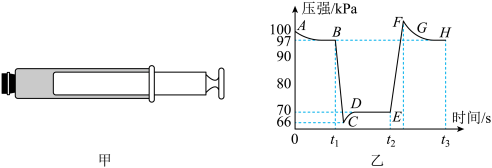
 N2O4(g)化学平衡移动的影响。在常温、100 kPa条件下,往注射器中充入适量NO2气体,当活塞位置不变时,分别在t1、t2s时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是
N2O4(g)化学平衡移动的影响。在常温、100 kPa条件下,往注射器中充入适量NO2气体,当活塞位置不变时,分别在t1、t2s时快速移动注射器活塞并保持活塞位置不变,测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是
| A.由B点到D点观察到注射器内气体颜色先变浅后逐渐变深 |
| B.由E点到F点注射器内气体颜色加深是平衡移动所致 |
| C.B、H两点对应的正反应速率vB= vH |
| D.B点处NO2的转化率为6% |
您最近一年使用:0次
2021-10-19更新
|
583次组卷
|
10卷引用:山西省怀仁市第一中学2021-2022学年高二上学期第二次月考理科综合化学试题
山西省怀仁市第一中学2021-2022学年高二上学期第二次月考理科综合化学试题四川省成都外国语学校2021-2022学年高二上学期10月月考化学试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)浙江省宁波效实中学2021-2022学年高二上学期期中考试化学试题(已下线)第13讲 第二章《化学反应速率与化学平衡》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)福建省厦门第一中学2022-2023学年高二上学期第一次月考化学试题甘肃省平凉市第一中学2022-2023学年高二上学期第一次月考化学试题浙江省杭州第四中学2022-2023学年高二上学期期中考试 化学试题河北省石家庄市第四十一中学2023-2024学年高二上学期第一次月考化学试题广东省佛山市顺德区罗定邦中学2023-2024学年高二上学期期中考试化学试题
名校
10 . 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列有关说法
4NO(g)+6H2O(g),下列有关说法不 正确的是
 4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列有关说法
4NO(g)+6H2O(g),下列有关说法| A.该反应一定能自发进行 |
| B.该反应的正反应的活化能小于逆反应的活化能 |
| C.断裂1mol N—H键的同时断裂1molO—H键,说明该反应达到平衡状态 |
| D.达到平衡时,增大容器的体积,v(正)增加、v(逆)减小 |
您最近一年使用:0次
2021-10-14更新
|
1431次组卷
|
8卷引用:江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题



