名校
1 . 在T℃时,向1L固定体积的密闭容器M中加入2molX和1molY,发生如下反应: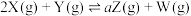
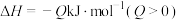 ;该反应达到平衡后,放出的热量为
;该反应达到平衡后,放出的热量为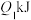 ,物质X的转化率为
,物质X的转化率为 ;若平衡后再升高温度,混合气体的平均相对分子质量减小。
;若平衡后再升高温度,混合气体的平均相对分子质量减小。
请回答下列问题:
(1)化学计量数 的值为
的值为___________ 。
(2)下列能说明该反应达到了化学平衡状态的是___________ 。
a.容器内压强一定
b.容器内气体的密度一定
c.容器内Z的分子数一定
d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2molX、1molY和1molAr(稀有气体不参与反应),则反应达到平衡后放出的热量是___________ 。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2molX和1molY,发生题给反应并达到平衡,则___________ (填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M___________ N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
若在某温度下,2molX和1molY在容器M中反应并达到平衡,X的平衡转化率为50%,则该温度为___________ ℃。
(6)维持T℃温度不变,若起始时向容器M中加入4molX和6molY,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为___________ kJ。
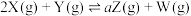
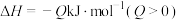 ;该反应达到平衡后,放出的热量为
;该反应达到平衡后,放出的热量为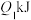 ,物质X的转化率为
,物质X的转化率为 ;若平衡后再升高温度,混合气体的平均相对分子质量减小。
;若平衡后再升高温度,混合气体的平均相对分子质量减小。请回答下列问题:
(1)化学计量数
 的值为
的值为(2)下列能说明该反应达到了化学平衡状态的是
a.容器内压强一定
b.容器内气体的密度一定
c.容器内Z的分子数一定
d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2molX、1molY和1molAr(稀有气体不参与反应),则反应达到平衡后放出的热量是
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2molX和1molY,发生题给反应并达到平衡,则
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
(6)维持T℃温度不变,若起始时向容器M中加入4molX和6molY,反应达到平衡时容器内的分子数目减少10%,则反应中放出的热量为
您最近一年使用:0次
2023-05-30更新
|
76次组卷
|
2卷引用:河南省南阳市镇平县第一高级中学2022-2023学年高二下学期5月月考化学试题
2 . 我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。因此,研发 利用技术,降低空气中
利用技术,降低空气中 的含量成为研究热点。当前,科学家成功利用
的含量成为研究热点。当前,科学家成功利用 和
和 合成了
合成了 ,这对节能减排、降低碳排放具有重大意义。回答下列问题:
,这对节能减排、降低碳排放具有重大意义。回答下列问题:
 催化加氢制甲醇是极具前景的资源化研究领域,主要反成有:
催化加氢制甲醇是极具前景的资源化研究领域,主要反成有:
i.

ii.

iii.

(1)已知反应i速率方程为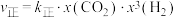 ,
, ,
, 、
、 均为速率常数且只与温度有关,x为物质的量分数。则反应ⅰ用物质的量分数表示的平衡常数
均为速率常数且只与温度有关,x为物质的量分数。则反应ⅰ用物质的量分数表示的平衡常数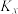 =
=_______ (用 、
、 表示;
表示;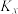 指平衡时用各物质的物质的量分数来代替该物质的平衡浓度来计算平衡常数的一种新的表达式)。
指平衡时用各物质的物质的量分数来代替该物质的平衡浓度来计算平衡常数的一种新的表达式)。
(2)5MPa时,往某密闭容器中按投料比 充入
充入 和
和 。反成达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图中所示。
。反成达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图中所示。

①图甲中X代表_______ (填化学式)。
②250℃时反应ⅱ的K_______ 1(填“>”“<”或“=”)。
③下列措施中,一定无法提高甲醇产率的是_______ (填字母)。
A.加入适量CO B.增加 C.循环利用原料气 D.升高温度
C.循环利用原料气 D.升高温度
(3)在10MPa下,将 、CO按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图乙所示。曲线b代表的物质为
、CO按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图乙所示。曲线b代表的物质为_______ (填化学式)。温度为700K时,该反应的平衡常数K=_______  (结果用分数表示)。
(结果用分数表示)。

(4)研究表明, 与
与 在催化剂作用下,发生反应ⅰ合成
在催化剂作用下,发生反应ⅰ合成 时会发生副反应(反应ⅱ)。将一定量的
时会发生副反应(反应ⅱ)。将一定量的 和
和 通入刚性的密闭容器中,
通入刚性的密闭容器中, 的平衡转化率和甲醇的选择率随温度的变化趋势如图所示:
的平衡转化率和甲醇的选择率随温度的变化趋势如图所示:

已知: 的选择率
的选择率
随着温度的升高, 的平衡转化率增加但甲醇的选择率降低,请分析其原因:
的平衡转化率增加但甲醇的选择率降低,请分析其原因:_______ 。
 利用技术,降低空气中
利用技术,降低空气中 的含量成为研究热点。当前,科学家成功利用
的含量成为研究热点。当前,科学家成功利用 和
和 合成了
合成了 ,这对节能减排、降低碳排放具有重大意义。回答下列问题:
,这对节能减排、降低碳排放具有重大意义。回答下列问题: 催化加氢制甲醇是极具前景的资源化研究领域,主要反成有:
催化加氢制甲醇是极具前景的资源化研究领域,主要反成有:i.


ii.


iii.


(1)已知反应i速率方程为
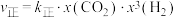 ,
, ,
, 、
、 均为速率常数且只与温度有关,x为物质的量分数。则反应ⅰ用物质的量分数表示的平衡常数
均为速率常数且只与温度有关,x为物质的量分数。则反应ⅰ用物质的量分数表示的平衡常数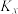 =
= 、
、 表示;
表示;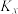 指平衡时用各物质的物质的量分数来代替该物质的平衡浓度来计算平衡常数的一种新的表达式)。
指平衡时用各物质的物质的量分数来代替该物质的平衡浓度来计算平衡常数的一种新的表达式)。(2)5MPa时,往某密闭容器中按投料比
 充入
充入 和
和 。反成达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图中所示。
。反成达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图中所示。
①图甲中X代表
②250℃时反应ⅱ的K
③下列措施中,一定无法提高甲醇产率的是
A.加入适量CO B.增加
 C.循环利用原料气 D.升高温度
C.循环利用原料气 D.升高温度(3)在10MPa下,将
 、CO按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图乙所示。曲线b代表的物质为
、CO按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图乙所示。曲线b代表的物质为 (结果用分数表示)。
(结果用分数表示)。
(4)研究表明,
 与
与 在催化剂作用下,发生反应ⅰ合成
在催化剂作用下,发生反应ⅰ合成 时会发生副反应(反应ⅱ)。将一定量的
时会发生副反应(反应ⅱ)。将一定量的 和
和 通入刚性的密闭容器中,
通入刚性的密闭容器中, 的平衡转化率和甲醇的选择率随温度的变化趋势如图所示:
的平衡转化率和甲醇的选择率随温度的变化趋势如图所示:
已知:
 的选择率
的选择率
随着温度的升高,
 的平衡转化率增加但甲醇的选择率降低,请分析其原因:
的平衡转化率增加但甲醇的选择率降低,请分析其原因:
您最近一年使用:0次
名校
解题方法
3 . (1)一定温度下,在密闭容器内进行某化学反应,气体X、Y的物质的量随反应时间变化的曲线如图所示。

①写出该反应的化学方程式:__________ 。
②在 和
和 时正反应速率分别为
时正反应速率分别为 和
和 ,则二者大小关系为
,则二者大小关系为
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③在 、
、 和
和 三个时刻中,反应程度最大的是
三个时刻中,反应程度最大的是__________ (填“ ”“
”“ ”或“
”或“ ”)。
”)。
(2)一定温度下,将一定量的 和
和 充入固定容积的密闭容器中进行反应
充入固定容积的密闭容器中进行反应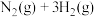
 。
。
①下列描述能说明该可逆反应达到化学平衡状态的有_________ (填序号)。
A 容器内的压强不变
B 容器内气体的密度不变
C 相同时间内有3molH—H键断裂,有6molN—H键形成
D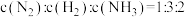
E 的质量分数不再改变
的质量分数不再改变
②若起始时向容器中充入 的N2和
的N2和 的
的 ,10min时测得容器内
,10min时测得容器内 的浓度为
的浓度为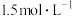 。10min内用
。10min内用 表示的反应速率为
表示的反应速率为__________ ;此时 的转化率为
的转化率为________ 。

①写出该反应的化学方程式:
②在
 和
和 时正反应速率分别为
时正反应速率分别为 和
和 ,则二者大小关系为
,则二者大小关系为
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③在
 、
、 和
和 三个时刻中,反应程度最大的是
三个时刻中,反应程度最大的是 ”“
”“ ”或“
”或“ ”)。
”)。(2)一定温度下,将一定量的
 和
和 充入固定容积的密闭容器中进行反应
充入固定容积的密闭容器中进行反应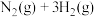
 。
。①下列描述能说明该可逆反应达到化学平衡状态的有
A 容器内的压强不变
B 容器内气体的密度不变
C 相同时间内有3molH—H键断裂,有6molN—H键形成
D
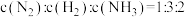
E
 的质量分数不再改变
的质量分数不再改变②若起始时向容器中充入
 的N2和
的N2和 的
的 ,10min时测得容器内
,10min时测得容器内 的浓度为
的浓度为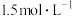 。10min内用
。10min内用 表示的反应速率为
表示的反应速率为 的转化率为
的转化率为
您最近一年使用:0次
2020-09-24更新
|
777次组卷
|
6卷引用:河南省焦作市武陟县第一中学东校区2021-2022学年高一下学期4月月考化学试题
河南省焦作市武陟县第一中学东校区2021-2022学年高一下学期4月月考化学试题 安徽省淮北市第一中学2017-2018学年高一下学期期中考试化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时2 化学反应的限度(已下线)第14讲 化学反应的限度(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)安徽省滁州市定远县民族中学2021-2022学年高一下学期期中考试化学试题广东省广州大同中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
4 .  和
和 在一定条件下合成甲醇的反应为;
在一定条件下合成甲醇的反应为;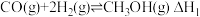 。现在容积均为
。现在容积均为 的a、b、c、d、e五个密闭容器中分别充入
的a、b、c、d、e五个密闭容器中分别充入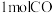 和
和 的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为
的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为 的密闭容器中,甲醇的物质的量:图2:温度分别为
的密闭容器中,甲醇的物质的量:图2:温度分别为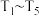 的密闭容器中,反应均进行到
的密闭容器中,反应均进行到 时甲醇的体积分数)。下列叙述正确的是
时甲醇的体积分数)。下列叙述正确的是
 和
和 在一定条件下合成甲醇的反应为;
在一定条件下合成甲醇的反应为;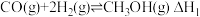 。现在容积均为
。现在容积均为 的a、b、c、d、e五个密闭容器中分别充入
的a、b、c、d、e五个密闭容器中分别充入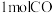 和
和 的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为
的混合气体,控制温度,进行实验,测得相关数据如图(图1:温度分别为 的密闭容器中,甲醇的物质的量:图2:温度分别为
的密闭容器中,甲醇的物质的量:图2:温度分别为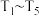 的密闭容器中,反应均进行到
的密闭容器中,反应均进行到 时甲醇的体积分数)。下列叙述正确的是
时甲醇的体积分数)。下列叙述正确的是
A.该反应的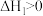 ,且 ,且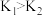 |
| B.图2中所给的abcde五个点均不是平衡状态 |
C. 时,向平衡后的容器中再充入 时,向平衡后的容器中再充入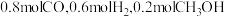 ,平衡正向移动 ,平衡正向移动 |
D.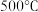 时,向平衡后的容器中再充入 时,向平衡后的容器中再充入 ,重新平衡后, ,重新平衡后, 的百分含量增大 的百分含量增大 |
您最近一年使用:0次
2022-10-13更新
|
769次组卷
|
4卷引用:河南省新乡市第一中学2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
5 . 如图,已知某反应在体积为5L的密闭容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。___________ 。
(2)反应开始至两分钟时,B的平均反应速率为___________ 。
(3)下列能说明反应已达到平衡状态的是___________ 。
A.v(A)=2v(B)
B.容器内气体密度不变
C.各组分的物质的量相等
D.混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为___________ ,C的含量(体积分数)为___________ 。
(5)平衡时容器内气体的压强与起始时容器内压强的比值为___________ 。
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1molNH3过程中放出46kJ的热量。则N≡N的键能为___________ kJ/mol。

(2)反应开始至两分钟时,B的平均反应速率为
(3)下列能说明反应已达到平衡状态的是
A.v(A)=2v(B)
B.容器内气体密度不变
C.各组分的物质的量相等
D.混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为
(5)平衡时容器内气体的压强与起始时容器内压强的比值为
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1molNH3过程中放出46kJ的热量。则N≡N的键能为
您最近一年使用:0次
2021-05-02更新
|
1018次组卷
|
7卷引用:河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题
名校
6 . 在恒容密闭容器中充入一定量的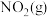 和
和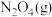 ,发生反应
,发生反应
 ,体系中各物质的百分含量与温度的变化关系如图所示,下列说法错误的是
,体系中各物质的百分含量与温度的变化关系如图所示,下列说法错误的是

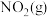 和
和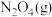 ,发生反应
,发生反应
 ,体系中各物质的百分含量与温度的变化关系如图所示,下列说法错误的是
,体系中各物质的百分含量与温度的变化关系如图所示,下列说法错误的是
A.曲线①表示 的百分含量 的百分含量 |
B. 的键能总和大于 的键能总和大于 的键能总和 的键能总和 |
C.若 点为反应平衡点,此时平衡常数 点为反应平衡点,此时平衡常数 |
| D.反应达到平衡后,保持其他条件不变,往该容器中充入少量稀有气体,反应速率不改变 |
您最近一年使用:0次
2021-07-07更新
|
651次组卷
|
5卷引用:河南省豫南重点高中2021-2022学年高二上学期精英对抗赛化学试题
河南省豫南重点高中2021-2022学年高二上学期精英对抗赛化学试题湖北省十堰市2020-2021学年高二下学期期末调研考试化学试题(已下线)周末培优1 化学反应速率与化学平衡图像问题-2021-2022学年高二化学课后培优练(人教版选修4)四川省绵阳南山中学2021-2022学年高二上学期12月月考化学试题广东省深圳市重点中学2021-2022学年高二上学期期末考试化学试题
7 . 在恒容密闭容器中充入一定量的NO2(g)和N2O4(g),发生反应N2O4(g) 2NO2(g)△H>0,体系中各物质的百分含量与温度的变化关系如图所示,下列说法错误的是
2NO2(g)△H>0,体系中各物质的百分含量与温度的变化关系如图所示,下列说法错误的是

 2NO2(g)△H>0,体系中各物质的百分含量与温度的变化关系如图所示,下列说法错误的是
2NO2(g)△H>0,体系中各物质的百分含量与温度的变化关系如图所示,下列说法错误的是
| A.曲线①表示NO2的百分含量 |
| B.若m点为反应平衡点,此时平衡常数K=4 |
| C.1molN2O4(g)的键能总和大于2molNO2(g)的键能总和 |
| D.反应达到平衡后,保持其他条件不变,往该容器中充入少量稀有气体,反应速率不改变 |
您最近一年使用:0次
2021-06-12更新
|
114次组卷
|
3卷引用:河南省南阳地区2020-2021学年高二下学期阶段检测考试化学试题
真题
名校
8 . 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) ⇌nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
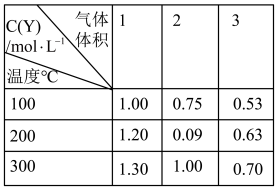
下列说法正确的是

下列说法正确的是
| A.m>n | B.Q<0 |
| C.温度不变,压强增大,Y的质量分数减少 | D.体积不变,温度升高,平衡向逆反应方向移动 |
您最近一年使用:0次
2019-01-30更新
|
1100次组卷
|
16卷引用:河南省安阳市第三十六中学2018-2019学年高二上学期第一次月考化学试题
河南省安阳市第三十六中学2018-2019学年高二上学期第一次月考化学试题河南省南阳市第一中学2019-2020学年高二下学期第三次月考(6月)化学试题2009年普通高等学校招生统一考试理综试题化学部分(四川卷)(已下线)2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(已下线)2013届北京四中高三上学期期中测验化学试卷2015-2016学年辽宁师大附属中学高二10月月考化学试卷2015-2016学年陕西省西安一中高二上10月月考化学试卷2015-2016学年福建省大田一中高二上学期期中考试化学试卷2015-2016学年江西省金溪一中高一下期中化学试卷2016-2017学年河北冀州市中学高二上开学调研化学卷高二人教版选修4 第二章 第三节 化学平衡2019年秋高三化学复习强化练习—— 化学反应速率及化学平衡江苏省东海县第二中学2019-2020学年高二下学期第一次学分认定测试化学试题云南省昆明市东川区明月中学2018-2019学年高二下学期期中考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时2 反应条件对化学平衡的影响上海高考2017届压轴卷 化学试题
名校
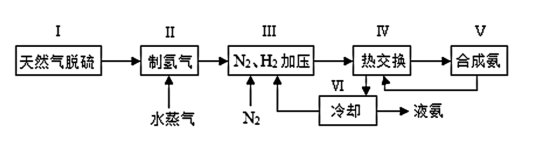
9 . 合成氨是人类科学技术上的一项重大突破,工业合成氨的简式流程图如下
(1)天然气中的H2S杂质常用氨水吸收,写出足量的H2S与氨水反应的化学方程式:__ 。
(2)步骤II中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为___ 。
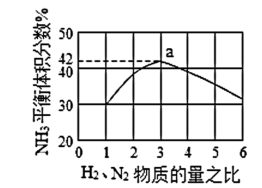
(3)下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数__ 。
(4)依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气 开始,随温度不断升高,NH3物质的量变化的曲线示意图______ 。
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是_ (填序号)。简述本流程中提高合成氨原料总转化率的方法__ 。

(1)天然气中的H2S杂质常用氨水吸收,写出足量的H2S与氨水反应的化学方程式:
(2)步骤II中制氢气的原理如下:
①CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.4kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2kJ·mol-1对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为
(3)下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数

(4)依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从

(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是
您最近一年使用:0次
2020-10-19更新
|
138次组卷
|
2卷引用:河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题
解题方法
10 . 氨是最为重要的基础化工产品之一,其产量居各种化工产品的首位。合成氨方面的研究共产生了三名诺贝尔奖得主,分别是理论可行性研究、工业化研究和机理研究三个方面,这也代表了现代化学研究的三个方面。
回答下列问题:
I.合成氨反应的机理研究:N2和H2在活性铁表面催化合成NH3的机理如图所示,其中(ad)表示物种的吸附状态。

(1)根据反应历程图,写出合成氨反应的热化学方程式___________ 。
(2)合成氨经历如下五个过程:
 N2(g)+
N2(g)+ H2(g)→N(ad)+3H(ad)i
H2(g)→N(ad)+3H(ad)i
N(ad)+3H(ad)→NH(ad)+2H(ad)ii
NH(ad)+2H(ad)→NH2(ad)+H(ad)iii
NH2(ad)+H(ad)→NH3(ad)iv
NH3(ad)→NH3(g)V
下列说法正确的是___________(填选项字母)。
Ⅱ.合成氨反应的反应条件研究:实验测定不同条件下,平衡时氨气的含量与起始氢氮比[ ]之间的关系如图所示。
]之间的关系如图所示。

(3)T0___________ 420°C(填“<”“>”或“=”,下同)。
(4)a点时的转化率:a(N2)___________ a(H2)。
(5)a、b、c、d四点对应的平衡常数由大到小的顺序为___________ (用Ka、Kb、Kc、Kd表示)。
(6)b点对应的平衡常数Kb=___________ MPa-2(用体系中各物质的分压表示平衡常数,物质的分压=物质的量百分含量×容器的总压,列出计算式即可)。
Ⅲ.合成氨的工业化研究:合成氨的原料气中的杂质会影响氨的合成效率,已知某原料气中含有20%N2、40%H2、30%CO、3%Ar。
(7)在恒压条件下,单位时间通入的气体总量一定时,杂质稀有气体Ar会使N2的平衡转化率降低的原因为___________ 。
回答下列问题:
I.合成氨反应的机理研究:N2和H2在活性铁表面催化合成NH3的机理如图所示,其中(ad)表示物种的吸附状态。

(1)根据反应历程图,写出合成氨反应的热化学方程式
(2)合成氨经历如下五个过程:
 N2(g)+
N2(g)+ H2(g)→N(ad)+3H(ad)i
H2(g)→N(ad)+3H(ad)iN(ad)+3H(ad)→NH(ad)+2H(ad)ii
NH(ad)+2H(ad)→NH2(ad)+H(ad)iii
NH2(ad)+H(ad)→NH3(ad)iv
NH3(ad)→NH3(g)V
下列说法正确的是___________(填选项字母)。
| A.升高温度,过程i的反应速率减慢,过程ii的反应速率加快 |
| B.增大压强,有利于提高过程i的转化率 |
C.使用催化剂时,反应 N2(g)+ N2(g)+ H2(g)→N(g)+3H(g)ΔH<0 H2(g)→N(g)+3H(g)ΔH<0 |
Ⅱ.合成氨反应的反应条件研究:实验测定不同条件下,平衡时氨气的含量与起始氢氮比[
 ]之间的关系如图所示。
]之间的关系如图所示。
(3)T0
(4)a点时的转化率:a(N2)
(5)a、b、c、d四点对应的平衡常数由大到小的顺序为
(6)b点对应的平衡常数Kb=
Ⅲ.合成氨的工业化研究:合成氨的原料气中的杂质会影响氨的合成效率,已知某原料气中含有20%N2、40%H2、30%CO、3%Ar。
(7)在恒压条件下,单位时间通入的气体总量一定时,杂质稀有气体Ar会使N2的平衡转化率降低的原因为
您最近一年使用:0次
2020-07-26更新
|
231次组卷
|
2卷引用:河南省驻马店市2019-2020学年高二下学期期末考试化学试题



