名校
1 . 碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应I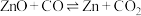 ;
;
反应Ⅱ
在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中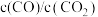 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是
反应I
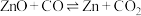 ;
;反应Ⅱ

在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中
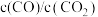 随温度变化的关系如图所示。下列说法正确的是
随温度变化的关系如图所示。下列说法正确的是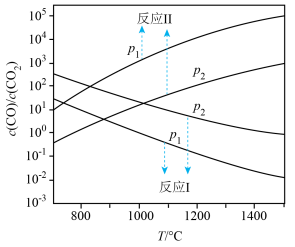
A.压强大小: |
B.在如图所示条件下,反应I可表示为  |
C.选择反应Ⅱ的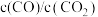 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行 |
D.一定条件下将C与ZnO置于同一密闭容器中反应,当 时,增大 时,增大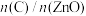 的值,可减少平衡时气体中 的值,可减少平衡时气体中 的含量 的含量 |
您最近一年使用:0次
2023-06-02更新
|
661次组卷
|
3卷引用:江苏省扬州市2023届高三下学期三模化学试题
名校
解题方法
2 . CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
(1)达到平衡时,反应a,b对比:CO2的体积分数φ(a)_______ φ(b)(填“>”、“<”或“=”))。
(2)下列能说明反应a达到平衡状态的是_______ (填字母)。
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
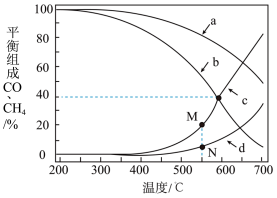
(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 和_______ 。M点平衡组成含量高于N点的原因是_______ 。
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为_______ 。
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
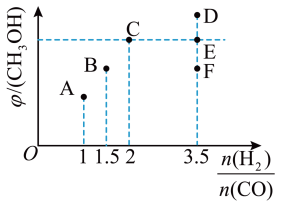
(5)当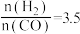 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的_______ (填“D”、“E”或“F”)点。
(6) =
=_______ 时,CH3OH的体积分数最大。
I.工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T℃、1L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
| CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应a(恒温恒容) | 1 | 3 | 0 | 0 |
| 反应b(绝热恒容) | 0 | 0 | 1 | 1 |
(2)下列能说明反应a达到平衡状态的是
A.v正(CO2)=3v逆(H2)
B.混合气体的平均摩尔质量不再改变
C.c(CH3OH)=c(H2O)
D.容器内压强不再改变
II.我国科学家研究了不同反应温度对含碳产物组成的影响。
已知:反应1:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH>0
在密闭容器中通入3mol的的H2和1mol的CO2,分别在1MPa和10MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。

(3)1MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
(4)图中当CH4和CO平衡组成均为40%时,若容器的体积为1L,该温度下反应1的平衡常数K的值为
III.在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的的CO和H2,发生反应CO(g)+2H2(g) ⇌ CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。

(5)当
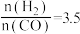 时,达到平衡后,CH3OH的体积分数可能是图象中的
时,达到平衡后,CH3OH的体积分数可能是图象中的(6)
 =
=
您最近一年使用:0次
2021-03-04更新
|
819次组卷
|
4卷引用:江苏省扬州中学2021-2022学年高二上学期期中考试化学试题
江苏省扬州中学2021-2022学年高二上学期期中考试化学试题吉林省延边州2021届高三下学期教学质量检测(2月底) 理综化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测(已下线)第21讲 化学平衡状态 化学平衡的移动(练)-2023年高考化学一轮复习讲练测(全国通用)
解题方法
3 . CO2、CO、H2催化合成醇可减排温室气体并合成可再生燃料,是新能源领域的研究前沿。已知CO2与H2混合后一定条件下可发生下列两个可逆反应:
I、CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol−1
II、CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2= 41.1 kJ·mol−1
(1)H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) = CH3OH(g) ΔH,则ΔH=_______ kJ·mol−1。
(2)1 mol CO2和3 mol H2混和气体在一定条件下反应,测得CO2平衡转化率、平衡时含碳产物中CH3OH和CO的物质的量分数随温度变化如图-1所示
①图中平衡时产物中CO的百分含量对应的曲线是_______ (填“b”或“c”),理由为_______ 。
②图中X点时,CO2的平衡转化率为25%,则此时混合体系中n(CH3OH)∶n(CO)∶n(CO2)=_______ ;H2的转化率为_______ %(保留三位有效数字)。
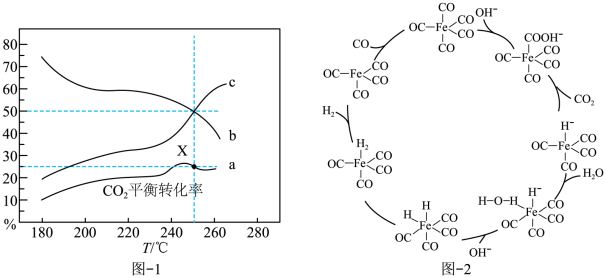
(3)CO和H2O可以在Fe(CO)5催化作用下发生反应II,其反应机理如图-2所示。OH-在此反应中的作用是_______ ;若参与反应的为C18O,则生成的二氧化碳成分为_______ (填“只有CO18O”或“只有CO2” 或“CO18O和CO2”)
I、CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol−1
II、CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2= 41.1 kJ·mol−1
(1)H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g) = CH3OH(g) ΔH,则ΔH=
(2)1 mol CO2和3 mol H2混和气体在一定条件下反应,测得CO2平衡转化率、平衡时含碳产物中CH3OH和CO的物质的量分数随温度变化如图-1所示
①图中平衡时产物中CO的百分含量对应的曲线是
②图中X点时,CO2的平衡转化率为25%,则此时混合体系中n(CH3OH)∶n(CO)∶n(CO2)=

(3)CO和H2O可以在Fe(CO)5催化作用下发生反应II,其反应机理如图-2所示。OH-在此反应中的作用是
您最近一年使用:0次
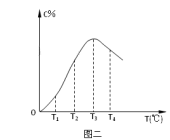
4 . 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。下列分析不正确的是
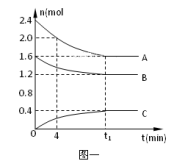


A.0~4 时,A的平均反应速率为0.01mol/(L·min) 时,A的平均反应速率为0.01mol/(L·min) |
B.该反应的平衡常数表达式为: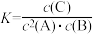 |
| C.由T1向T2变化时,v正>v逆 |
| D.此反应的正反应为吸热反应 |
您最近一年使用:0次
名校
解题方法
5 . 反应A(g) + 3B(g)  2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
 2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的A. | B.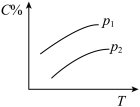 |
C.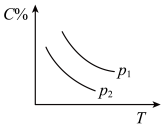 | D.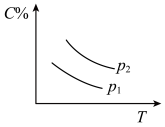 |
您最近一年使用:0次
2020-04-14更新
|
164次组卷
|
21卷引用:江苏省仪征中学2016-2017学年高二4月月考化学试题
江苏省仪征中学2016-2017学年高二4月月考化学试题(已下线)2010年四川省成都市实验中学高二上学期期中考试化学试卷(已下线)2010年黑龙江大庆实验中学高二上学期期中考试化学试卷(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷(已下线)2014-2015学年辽宁大连市第二十高级中学高二上期中考试化学试题(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(A)卷2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷甘肃省天水市第一中学2017-2018学年高二上学期第一阶段考试(理)化学试题湖南省邵东县第十中学2018-2019学年高二上学期期中考试理科班化学试题山东省泰安第四中学2018-2019学年高二上学期12月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二上学期第二次月考化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题广东省惠来县葵潭中学2019-2020学年高二上学期第二次月考化学试题湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题(已下线)上海市松江一中2013届高三上学期期中考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题安徽省黄山市屯溪第一中学2019-2020学年高二下学期入学考试化学试题甘肃省武威第八中学2020-2021学年高二上学期月考化学试题甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 海南省海口市灵山中学2019—2020学年高二上学期期中测试化学试题
2010·江苏扬州·模拟预测
解题方法
6 . T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是( )
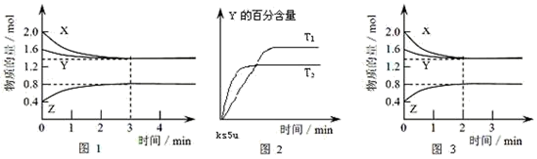

A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行的前3 min内,用X表示的反应速率 υ(X)=0.3mol/(L·min) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K增大 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
您最近一年使用:0次



