名校
1 . 在某密闭容器中发生可逆反应:A(g) + B(g) xC(g)。当其他条件不变时,C的体积分数与温度和压强的关系如图所示,下列说法不正确的是
xC(g)。当其他条件不变时,C的体积分数与温度和压强的关系如图所示,下列说法不正确的是
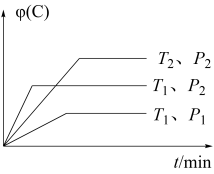
 xC(g)。当其他条件不变时,C的体积分数与温度和压强的关系如图所示,下列说法不正确的是
xC(g)。当其他条件不变时,C的体积分数与温度和压强的关系如图所示,下列说法不正确的是
| A.p1<p2 | B.该反应为吸热反应 |
| C.x=1 | D.T1>T2 |
您最近一年使用:0次
2020-11-16更新
|
417次组卷
|
4卷引用:新疆生产建设兵团第十师北屯高级中学2021-2022学年高二上学期期中考试化学试题
解题方法
2 . I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________ 。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________ kJ/mol。
II.对于反应CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____ ,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________ 。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为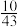 ,则反应的平衡常数K=
,则反应的平衡常数K=______ 。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。
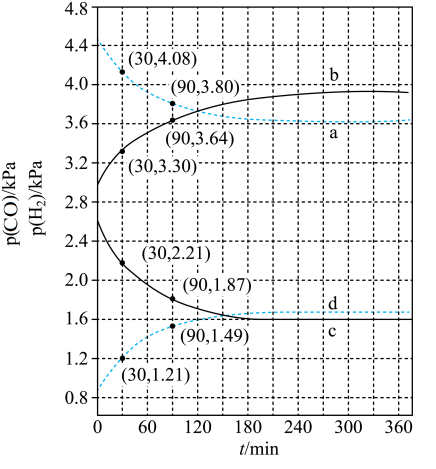
400K时p(H2)随时间变化关系的曲线是______ ,500K时p(CO)随时间变化关系的曲线是_______ 。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g) CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g) CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______ υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________ 。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为
II.对于反应CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
| 时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
| x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为
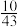 ,则反应的平衡常数K=
,则反应的平衡常数K=(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是
III.在催化剂的作用下发生反应CO(g)+2H2(g)
 CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)
 CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
您最近一年使用:0次
2020-06-30更新
|
131次组卷
|
2卷引用:新疆和田地区和田县2022-2023学年高二上学期11月期中化学试题
12-13高二下·陕西西安·期中
名校
3 . 反应mA(固)+nB(气)⇌eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
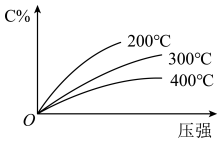

| A.化学方程式中n>e+f |
| B.达到平衡后,若升温,平衡右移 |
| C.到平衡后,加入催化剂,则C%增大 |
| D.达到平衡后,增加A的量有利于平衡向右移动 |
您最近一年使用:0次
2020-06-10更新
|
169次组卷
|
12卷引用:新疆昌吉州教育共同体2020-2021学年高二上学期期中考试化学试题
新疆昌吉州教育共同体2020-2021学年高二上学期期中考试化学试题(已下线)2012-2013学年陕西省长安一中高二下学期期中考试化学试卷(已下线)2013-2014学年海南三亚一中高二上学期期中考试理科化学试卷(B)2015-2016学年江苏省盐城市阜宁中学高二上学期期末选修化学试卷2015-2016学年河南省洛阳市伊川实验高中高二上第二次月考化学试卷2016-2017学年天津市部分区高二上学期期末化学试卷吉林松原乾安七中2019-2020学年高二上学期9月月考化学试题吉林省松原市乾安县七中2019-2020学年高二上学期第一次月考化学试题天津市静海区第一中学2019-2020学年高二上学期期末学生学业能力调研化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期期中考试化学试题云南省水富县云天化中学2020-2021学年高二下学期期中考试化学试题(已下线)2013-2014学年海南省三亚市一中高二上学期期中考试理科化学试卷
名校
4 . 密闭容器中进行的可逆反应aA(g)+bB(g)⇌cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是( )
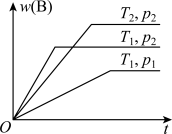

| A.T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B.T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C.T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D.T1>T2,p1>p2,a+b>c,正反应为放热反应 |
您最近一年使用:0次
2020-05-08更新
|
404次组卷
|
25卷引用:2016-2017学年新疆生产建设兵团二中高二上期中化学卷
2016-2017学年新疆生产建设兵团二中高二上期中化学卷新疆呼图壁县第一中学2017-2018学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉市第四中学2018-2019学年第一学期高二第一次月考化学试题新疆自治区昌吉市第九中学2018-2019学年高二上学期第二次月考化学试题内蒙古自治区翁牛特旗乌丹第一中学2018-2019学年高二上学期期中考试化学试题四川省宁南中学2018-2019学年高二下学期第一次月考化学试题云南省玉溪市玉溪一中2019-2020学年高二上学期第一次月考化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题湖北省新高考联考协作体2020-2021学年高二上学期期中考试化学试题贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题重庆市朝阳中学高2020-2021学年高二上学期期中考试化学试题江苏省南京市雨花台中学2020-2021学年高二年级上学期期末调研测试化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题北京市东直门中学2022-2023学年高二上学期期中考试化学试题北京工业大学附属中学2023-2024学年高二上学期期中考试化学试题四川省达州市宣汉县第二中学2023-2024学年高二上学期中期考试化学试题四川省内江市2025届第三中学高二上学期化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题山东省实验中学2020届高三第一次诊断性考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》广东省大埔县虎山中学2022-2023学年高三上学期1月期末考试化学试题河北省承德县第一中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
5 . 反应mA(s) + nB(g) ⇌ eC(g) + fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述不正确的是 ( )


| A.化学方程式中n > e+f |
| B.达到平衡后,若升温,平衡左移 |
| C.到平衡后,加入催化剂C%不变 |
| D.达到平衡后,增加A的质量有利于平衡向右移动 |
您最近一年使用:0次
2020-04-30更新
|
181次组卷
|
5卷引用:新疆北屯高级中学2020-2021学年高二上学期10月月考化学试题
11-12高二上·甘肃张掖·期中
名校
解题方法
6 . 对于达到平衡的反应:2A(g)+B(g) ⇌ nC(g),符合图所示的结论是:( )
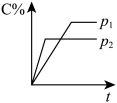

| A.p1>p2,n>3 | B. p1>p2,n<3 |
| C. p1<p2,n>3 | D. p1<p2,n<3 |
您最近一年使用:0次
2020-04-30更新
|
291次组卷
|
16卷引用:新疆乌鲁木齐市第四中学2020-2021学年高二上学期期中考试化学试题
新疆乌鲁木齐市第四中学2020-2021学年高二上学期期中考试化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期段考(期中)化学试题(已下线)2011-2012学年甘肃省张掖中学高二上学期期中考试化学(理)试卷(已下线)2012-2013学年福建龙岩一中高二上第一学段模块考试化学试卷(已下线)2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷2015-2016学年山东省临沂市第十九中学高二上10月月考化学试卷2015-2016学年广东省清远市第一中学高二上学期10月月考化学试卷陕西省宝鸡市金台区2019-2020学年高二上学期期中检测化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期中考试化学(理)试题甘肃省武威第十八中学2020-2021学年高二上学期期中考试化学试题陕西省咸阳百灵中学2020-2021学年高二上学期期中考试化学试题海南省万宁市民族中学2019-2020学年度高二上学期期末考试化学试题陕西省宝鸡市渭滨中学2020-2021学年度高二上学期期中考试化学试题贵州省龙里县九八五实验学校2020-2021学年高二上学期1月月考化学试题吉林省白城市第十四中学2021-2022学年高二上学期期中考试化学试卷题2020届高三化学知识点强化训练—化学平衡的移动及影响因素
名校
7 . 在某密闭容器中,可逆反应:A(g) + B(g) ⇌xC(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图像(Ⅱ)说法不正确的是( )


| A.p3>p4,Y轴表示A的转化率 |
| B.p3>p4,Y轴表示B的质量分数 |
| C.p3>p4,Y轴表示B的转化率 |
| D.p3>p4,Y轴表示混合气体的平均相对分子质量 |
您最近一年使用:0次
2020-02-04更新
|
917次组卷
|
22卷引用:新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题
新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题2016-2017学年西藏拉萨中学高二上月考三化学卷2018-2019学年人教版高中化学选修四章化学反应速率和化学平衡末综合测评(二)甘肃省靖远县第四中学2018-2019学年高二上学期第二次月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二上学期第二次月考化学试题(已下线)第02章 化学反应速率与化学平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)山东省临沂市沂水一中2020-2021学年高二9月月考化学试题辽宁省铁岭市开原市第二高级中学2020-2021学年高二上学期期初考试化学试题山东省济宁曲阜市第一中学2021-2022学年高二10月月考化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期中考试化学(理)试题内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题吉林省长春市九台区营城第一高级中学2022-2023学年高二上学期第一次月考化学试题广东省江门市开平市2022-2023学年高二上学期10月期中考试化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题云南省保山第一中学2022-2023学年高二下学期期末考试化学试题云南省文山州广南县第十中学校2023-2024学年高二上学期期中考试化学试题2020届高考化学二轮复习提升练习《 化学反应反应速率与反应平衡》(已下线)专题讲座(五)反应速率、平衡图像题解题策略(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第七章 化学反应速率与化学平衡 第44练 化学反应速率、平衡的常规图像
名校
解题方法
8 . 课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) 2NH3(g)△H<0,△S<0。
2NH3(g)△H<0,△S<0。
(1)下列关于工业合成氨的说法不正确的是___
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___ 。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:
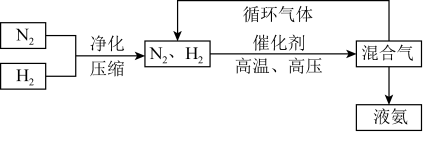
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2__ T1(填“>,<或=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是__ (填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①此条件下该反应的化学平衡常数K=__ 。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向___ 反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__ mol。
(6)已知:N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol
2NH3(g)△H=-92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式__ 。
 2NH3(g)△H<0,△S<0。
2NH3(g)△H<0,△S<0。(1)下列关于工业合成氨的说法不正确的是
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向
③N2(g)+3H2(g)
 2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为(6)已知:N2(g)+3H2(g)
 2NH3(g)△H=-92kJ/mol
2NH3(g)△H=-92kJ/molN2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式
您最近一年使用:0次
9 . 对可逆反应A(g)+B(g) C(g)(正反应为吸热反应),下列图像正确的是
C(g)(正反应为吸热反应),下列图像正确的是
 C(g)(正反应为吸热反应),下列图像正确的是
C(g)(正反应为吸热反应),下列图像正确的是A. | B. | C.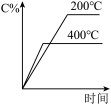 | D.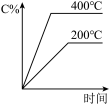 |
您最近一年使用:0次
2019-11-05更新
|
68次组卷
|
2卷引用:新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高二上学期11月期中考试化学试题
10-11高二上·福建·期中
名校
10 . 对于可逆反应2AB3(g) A2(g)+3B2(g)△H>0下列图像不正确的是()
A2(g)+3B2(g)△H>0下列图像不正确的是()
 A2(g)+3B2(g)△H>0下列图像不正确的是()
A2(g)+3B2(g)△H>0下列图像不正确的是()A. | B.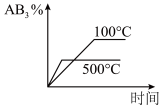 |
C. | D. |
您最近一年使用:0次
2019-10-13更新
|
220次组卷
|
17卷引用:新疆巴州焉耆县第三中学2018-2019学年高二上学期期末考试化学试题
新疆巴州焉耆县第三中学2018-2019学年高二上学期期末考试化学试题(已下线)2010年福建省师大附中高二上学期期中考试化学卷(已下线)2011-2012学年福建省福州文博中学高二下学期期中考试化学试卷(已下线)2011-2012学年江西省南昌三中高二上学期期中考试化学试卷(已下线)2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(已下线)2013-2014学年湖北省武汉市部分学校高二上学期期末考试化学试卷(已下线)2014-2015学年湖北鄂州市泽林镇泽林中学高二上第一次月考化学试卷2015-2016学年四川省宜宾市第三中学高二上学期期中测试化学试卷2015-2016学年安徽省铜陵一中高二上期中测试化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷2016-2017学年河北冀州市中学高二上开学调研化学卷2016-2017学年西藏拉萨中学高二上第一次月考化学试卷2016-2017学年辽宁省盘锦高中高二上期中化学卷【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期期中考试化学试题河南省洛阳市2018-2019学年高二第一学期期中考试化学试题湖北省荆门市龙泉中学、巴东一中2019-2020学年高二10月联考化学试题2016届内蒙古鄂尔多斯市第三中学高三上学期第四次考试化学试卷



