真题
解题方法
1 . 氢能是理想清洁能源,氢能产业链由制氢、储氢和用氢组成。
(1)利用铁及其氧化物循环制氢,原理如图所示。反应器Ⅰ中化合价发生改变的元素有_______ ;含CO和 各1mol的混合气体通过该方法制氢,理论上可获得
各1mol的混合气体通过该方法制氢,理论上可获得_______  。
。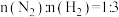 混合匀速通入合成塔,发生反应
混合匀速通入合成塔,发生反应 。海绵状的
。海绵状的 作催化剂,多孔
作催化剂,多孔 作为
作为 的“骨架”和气体吸附剂。
的“骨架”和气体吸附剂。
① 中含有CO会使催化剂中毒。
中含有CO会使催化剂中毒。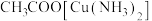 和氨水的混合溶液能吸收CO生成
和氨水的混合溶液能吸收CO生成 溶液,该反应的化学方程式为
溶液,该反应的化学方程式为_______ 。
② 含量与
含量与 表面积、出口处氨含量关系如图所示。
表面积、出口处氨含量关系如图所示。 含量大于
含量大于 ,出口处氨含量下降的原因是
,出口处氨含量下降的原因是_______ 。 可用于储氢。
可用于储氢。
①密闭容器中,其他条件不变,向含有催化剂的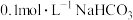 溶液中通入
溶液中通入 ,
, 产率随温度变化如图所示。温度高于
产率随温度变化如图所示。温度高于 ,
, 产率下降的可能原因是
产率下降的可能原因是_______ 。 ,CN是一种碳衍生材料)联合
,CN是一种碳衍生材料)联合 催化剂储氢,可能机理如图所示。氨基能将
催化剂储氢,可能机理如图所示。氨基能将 控制在催化剂表面,其原理是
控制在催化剂表面,其原理是_______ ;用重氢气(D2)代替H2,通过检测是否存在_______ (填化学式)确认反应过程中的加氢方式。
(1)利用铁及其氧化物循环制氢,原理如图所示。反应器Ⅰ中化合价发生改变的元素有
 各1mol的混合气体通过该方法制氢,理论上可获得
各1mol的混合气体通过该方法制氢,理论上可获得 。
。
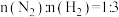 混合匀速通入合成塔,发生反应
混合匀速通入合成塔,发生反应 。海绵状的
。海绵状的 作催化剂,多孔
作催化剂,多孔 作为
作为 的“骨架”和气体吸附剂。
的“骨架”和气体吸附剂。①
 中含有CO会使催化剂中毒。
中含有CO会使催化剂中毒。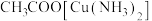 和氨水的混合溶液能吸收CO生成
和氨水的混合溶液能吸收CO生成 溶液,该反应的化学方程式为
溶液,该反应的化学方程式为②
 含量与
含量与 表面积、出口处氨含量关系如图所示。
表面积、出口处氨含量关系如图所示。 含量大于
含量大于 ,出口处氨含量下降的原因是
,出口处氨含量下降的原因是
 可用于储氢。
可用于储氢。①密闭容器中,其他条件不变,向含有催化剂的
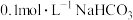 溶液中通入
溶液中通入 ,
, 产率随温度变化如图所示。温度高于
产率随温度变化如图所示。温度高于 ,
, 产率下降的可能原因是
产率下降的可能原因是
 ,CN是一种碳衍生材料)联合
,CN是一种碳衍生材料)联合 催化剂储氢,可能机理如图所示。氨基能将
催化剂储氢,可能机理如图所示。氨基能将 控制在催化剂表面,其原理是
控制在催化剂表面,其原理是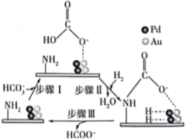
您最近一年使用:0次
名校
2 . 丙烯腈(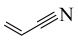 )是一种重要的化工原料,以
)是一种重要的化工原料,以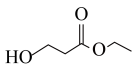 为原料合成丙烯腈的过程如下:
为原料合成丙烯腈的过程如下:

向密闭容器中通入一定量的 和
和 ,测得平衡时体系中含碳物质(乙醇除外)的物质的量分数[如:丙烯腈的物质的量分数
,测得平衡时体系中含碳物质(乙醇除外)的物质的量分数[如:丙烯腈的物质的量分数 ]随温度的变化如图。下列说法错误的是
]随温度的变化如图。下列说法错误的是
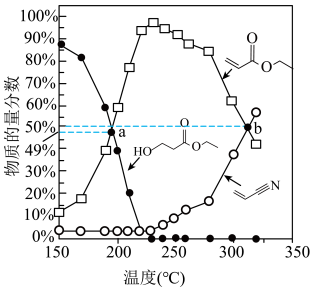
| A.“脱水”反应为吸热反应 |
| B.低于225℃时,“腈化”过程转化率低 |
C.a点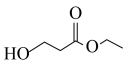 的转化率为51% 的转化率为51% |
D.b点 和 和 的物质的量之比为3:1 的物质的量之比为3:1 |
您最近一年使用:0次
2024-05-24更新
|
197次组卷
|
3卷引用:山东省德州市2024届高三下学期高考适应性练习(二)化学试题
解题方法
3 . 实现碳的氧化物循环利用在工业上占有重要的地位。一氧化碳加氢制甲醇的原理为 。回答下列问题;
。回答下列问题;
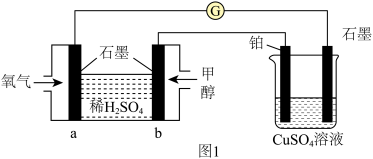
(1)用甲醇燃料电池作为外接电源按图1所示电解硫酸铜溶液,起始时盛有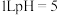 的硫酸铜溶液(25℃,
的硫酸铜溶液(25℃, 足量)。
足量)。
①电解的总反应方程式为______ ,此时可观察到的现象是______ 。
②一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______ (填物质名称),其质量约为______ g。
(2)在不同条件下,向体积可变的密闭容器中充入0.50molCO(g)和1.00molH2(g)的混合气体,实验测得平衡时CH3OH的物质的量随温度、压强的变化如图2所示。
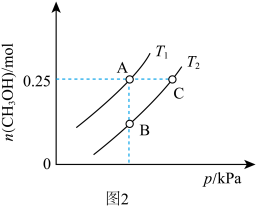
则温度:
______ (填“>”“<”或“=”) 三点对应的平衡常数由大到小关系为
三点对应的平衡常数由大到小关系为______ 。
(3)一定温度下,向恒容密闭容器中充入 和
和 混合气体,测得初始压强为
混合气体,测得初始压强为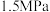 。反应至
。反应至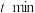 时,恢复到原来温度,测得
时,恢复到原来温度,测得 的转化率为
的转化率为 。已知正反应速率
。已知正反应速率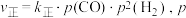 为分压(分压=总压
为分压(分压=总压 物质的量分数)。若该条件下
物质的量分数)。若该条件下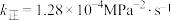 ,则
,则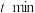 时,
时,
______ 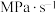 。若升高温,k正
。若升高温,k正______ (填“增大”“减小”或“不变”)。
 。回答下列问题;
。回答下列问题;(1)用甲醇燃料电池作为外接电源按图1所示电解硫酸铜溶液,起始时盛有
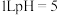 的硫酸铜溶液(25℃,
的硫酸铜溶液(25℃, 足量)。
足量)。①电解的总反应方程式为

②一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入
(2)在不同条件下,向体积可变的密闭容器中充入0.50molCO(g)和1.00molH2(g)的混合气体,实验测得平衡时CH3OH的物质的量随温度、压强的变化如图2所示。

则温度:

 三点对应的平衡常数由大到小关系为
三点对应的平衡常数由大到小关系为(3)一定温度下,向恒容密闭容器中充入
 和
和 混合气体,测得初始压强为
混合气体,测得初始压强为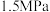 。反应至
。反应至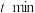 时,恢复到原来温度,测得
时,恢复到原来温度,测得 的转化率为
的转化率为 。已知正反应速率
。已知正反应速率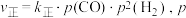 为分压(分压=总压
为分压(分压=总压 物质的量分数)。若该条件下
物质的量分数)。若该条件下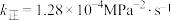 ,则
,则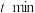 时,
时,
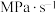 。若升高温,k正
。若升高温,k正
您最近一年使用:0次
名校
解题方法
4 . 汞及其化合物广泛应用于医药、冶金及其他精密高新科技领域。
(1)干燥的 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为___________ 。该反应中氧化产物是___________ 。
(2)富氧燃烧烟气中 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为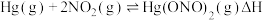
根据实验结果,有研究组提出了 与
与 的可能反应机理:
的可能反应机理:

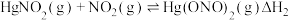

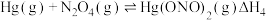
①根据盖斯定律,
___________ (写出一个代数式即可)。
②上述反应体系在一定条件下建立平衡后,下列说法正确的是___________ 。
A.增大 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率
B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入 ,可提高原料的平衡转化率
,可提高原料的平衡转化率
D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为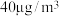 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。 的平均脱除反应速率为
的平均脱除反应速率为___________ 
ⅱ)
___________ 0(填“>”或“<”)
④富氧燃烧烟气中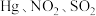 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于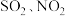 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是___________ 。 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:

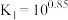
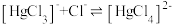
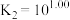
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随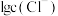 的变化如图所示
的变化如图所示 ]。
]。
①熔融状态的 不能导电,
不能导电, 是
是___________ (填“共价”或“离子”)化合物。
②A点溶液中
___________  。
。
③A点溶液中 的转化率为
的转化率为___________ (列出计算式)。
(1)干燥的
 固体上通入
固体上通入 可反应制得
可反应制得 和
和 ,反应的化学方程式为
,反应的化学方程式为(2)富氧燃烧烟气中
 的脱除主要是通过与
的脱除主要是通过与 反应实现,反应的化学方程式为
反应实现,反应的化学方程式为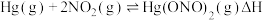
根据实验结果,有研究组提出了
 与
与 的可能反应机理:
的可能反应机理:
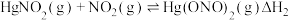

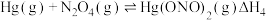
①根据盖斯定律,

②上述反应体系在一定条件下建立平衡后,下列说法正确的是
A.增大
 的浓度,可提高
的浓度,可提高 的平衡脱除率
的平衡脱除率B.升高温度,正反应速率增大,逆反应速率减小
C.恒温恒压下充入
 ,可提高原料的平衡转化率
,可提高原料的平衡转化率D.加入催化剂,可降低反应活化能,提高脱除速率
③在常压、温度范围为15~60℃条件下,将浓度为
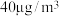 汞蒸气和
汞蒸气和 的
的 气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
气体通入反应容器中,测得出口气流中的汞浓度随反应时间的变化如图1所示。
 的平均脱除反应速率为
的平均脱除反应速率为
ⅱ)

④富氧燃烧烟气中
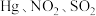 等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于
等污染物可通过配有循环水系统的分压精馏塔进行一体化脱除,污染物脱除率随循环水量的变化如图2所示。循环水的加入有利于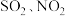 转化为
转化为 而脱除,但随着循环水量的增大,
而脱除,但随着循环水量的增大, 的去除率下降,其原因可能是
的去除率下降,其原因可能是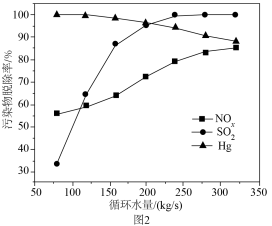
 溶液可用于手术刀消毒。
溶液可用于手术刀消毒。 与
与 的混合溶液中主要存在平衡:
的混合溶液中主要存在平衡:
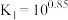
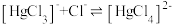
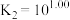
 的
的 溶液中加入
溶液中加入 固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数
固体(设溶液体积保持不变),溶液中含氯微粒的物质的量分数 随
随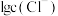 的变化如图所示
的变化如图所示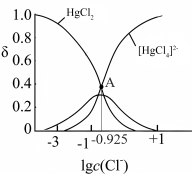
 ]。
]。①熔融状态的
 不能导电,
不能导电, 是
是②A点溶液中

 。
。③A点溶液中
 的转化率为
的转化率为
您最近一年使用:0次
2024-03-01更新
|
523次组卷
|
3卷引用:广东省广州市第二中学2023-2024学年高三上学期期末化学试卷
广东省广州市第二中学2023-2024学年高三上学期期末化学试卷(已下线)大题04 化学反应原理综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)广东省东莞市东华高级中学 东华松山湖高级中学 2024届高三下学期第三次模拟考试 化学试题
名校
解题方法
5 . 磷资源流失到水环境中会造成水体富营养化。已知: 基磁性纳米复合材料,由
基磁性纳米复合材料,由 和纳米
和纳米 经过超声分散制得。能通过纳米
经过超声分散制得。能通过纳米 物理吸附和
物理吸附和 溶出后通过化学反应等去除水体磷。已知:纳米
溶出后通过化学反应等去除水体磷。已知:纳米 颗粒表面带正电荷;部分物质的溶解性如下表。
颗粒表面带正电荷;部分物质的溶解性如下表。
(1)制备复合材料所需的纳米 :一定条件下,先将
:一定条件下,先将 和
和 晶体配制成混合溶液,再与氨水反应可制得纳米
晶体配制成混合溶液,再与氨水反应可制得纳米 ,实验装置如下:
,实验装置如下:
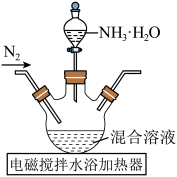
①氨水缓慢滴入,开始一段时间内未出现浑浊,原因是___________ 。
②制备纳米 需控温在50~60°℃之间,写出该反应的化学方程式:
需控温在50~60°℃之间,写出该反应的化学方程式:___________ 。
③配制混合溶液时按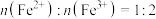 进行投料:实验中需不断通入
进行投料:实验中需不断通入 。通
。通 的目的是
的目的是___________ 。
(2)研究不同pH下向含磷(V)废水中加入 纳米复合材料的除磷效果:
纳米复合材料的除磷效果:
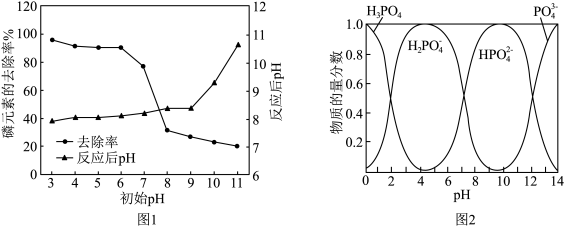
①从图1中可以看出初始pH为3~6时,磷的去除率较高且反应后pH均有一定的上升,反应过程中无气体生成。结合图2,写出对应的离子方程式:___________ 。
②当初始pH为9~10时,磷的去除率明显小于初始pH为3~6的去除率,是因为___________ 。
(3)除磷后续处理
除磷回收得到的磷矿物 ,可进一步转化为
,可进一步转化为 ,作为钾磷复合肥使用。设计由
,作为钾磷复合肥使用。设计由 浆料制备
浆料制备 晶体的实验方案:向含
晶体的实验方案:向含 的浆料中
的浆料中___________ ,干燥。[已知: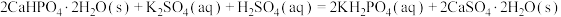 ;室温下从
;室温下从 饱和溶液中可结晶析出
饱和溶液中可结晶析出 晶体;实验中
晶体;实验中须选用 的试剂: 溶液、
溶液、 溶液,pH试纸,无水乙醇]
溶液,pH试纸,无水乙醇]
 基磁性纳米复合材料,由
基磁性纳米复合材料,由 和纳米
和纳米 经过超声分散制得。能通过纳米
经过超声分散制得。能通过纳米 物理吸附和
物理吸附和 溶出后通过化学反应等去除水体磷。已知:纳米
溶出后通过化学反应等去除水体磷。已知:纳米 颗粒表面带正电荷;部分物质的溶解性如下表。
颗粒表面带正电荷;部分物质的溶解性如下表。| 物质 |  |  |  |  |
| 溶解性 | 难溶 | 微溶 | 可溶 | 易溶 |
(1)制备复合材料所需的纳米
 :一定条件下,先将
:一定条件下,先将 和
和 晶体配制成混合溶液,再与氨水反应可制得纳米
晶体配制成混合溶液,再与氨水反应可制得纳米 ,实验装置如下:
,实验装置如下:
①氨水缓慢滴入,开始一段时间内未出现浑浊,原因是
②制备纳米
 需控温在50~60°℃之间,写出该反应的化学方程式:
需控温在50~60°℃之间,写出该反应的化学方程式:③配制混合溶液时按
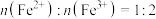 进行投料:实验中需不断通入
进行投料:实验中需不断通入 。通
。通 的目的是
的目的是(2)研究不同pH下向含磷(V)废水中加入
 纳米复合材料的除磷效果:
纳米复合材料的除磷效果:
①从图1中可以看出初始pH为3~6时,磷的去除率较高且反应后pH均有一定的上升,反应过程中无气体生成。结合图2,写出对应的离子方程式:
②当初始pH为9~10时,磷的去除率明显小于初始pH为3~6的去除率,是因为
(3)除磷后续处理
除磷回收得到的磷矿物
 ,可进一步转化为
,可进一步转化为 ,作为钾磷复合肥使用。设计由
,作为钾磷复合肥使用。设计由 浆料制备
浆料制备 晶体的实验方案:向含
晶体的实验方案:向含 的浆料中
的浆料中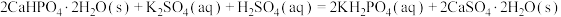 ;室温下从
;室温下从 饱和溶液中可结晶析出
饱和溶液中可结晶析出 晶体;实验中
晶体;实验中 溶液、
溶液、 溶液,pH试纸,无水乙醇]
溶液,pH试纸,无水乙醇]
您最近一年使用:0次
名校
解题方法
6 . 利用A制备B(A和B分子式相同)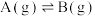 ,反应过程中伴随生成C和D(C和D分子式相同)的副反应
,反应过程中伴随生成C和D(C和D分子式相同)的副反应 ,
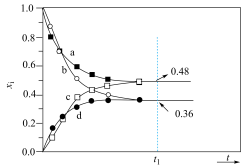
,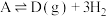 。只考虑主反应,常温下,以0.5mol A为原料,体系向环境放热X kJ;以0.5mol B为原料,体系从环境吸热YkJ(X>Y)。T℃(T<25)下,以A或B为原料发生反应,A和B的物质的量分数(
。只考虑主反应,常温下,以0.5mol A为原料,体系向环境放热X kJ;以0.5mol B为原料,体系从环境吸热YkJ(X>Y)。T℃(T<25)下,以A或B为原料发生反应,A和B的物质的量分数(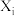 代表i物质的物质的量分数)随时间t变化关系如图所示,下列说法正确的是
代表i物质的物质的量分数)随时间t变化关系如图所示,下列说法正确的是
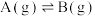 ,反应过程中伴随生成C和D(C和D分子式相同)的副反应
,反应过程中伴随生成C和D(C和D分子式相同)的副反应 ,
,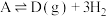 。只考虑主反应,常温下,以0.5mol A为原料,体系向环境放热X kJ;以0.5mol B为原料,体系从环境吸热YkJ(X>Y)。T℃(T<25)下,以A或B为原料发生反应,A和B的物质的量分数(
。只考虑主反应,常温下,以0.5mol A为原料,体系向环境放热X kJ;以0.5mol B为原料,体系从环境吸热YkJ(X>Y)。T℃(T<25)下,以A或B为原料发生反应,A和B的物质的量分数(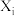 代表i物质的物质的量分数)随时间t变化关系如图所示,下列说法正确的是
代表i物质的物质的量分数)随时间t变化关系如图所示,下列说法正确的是
| A.a、c线代表A物质 |
B. 时, 时, 的物质的量分数为0.12 的物质的量分数为0.12 |
C.主反应的焓变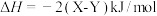 |
D.主反应的 |
您最近一年使用:0次
名校
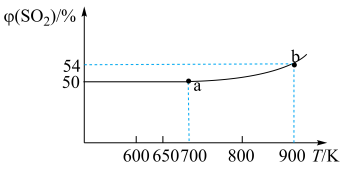
7 . 将 晶体置于真空刚性容器中,升温可发生反应:
晶体置于真空刚性容器中,升温可发生反应: 和
和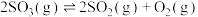 ,该体系达到平衡状态时
,该体系达到平衡状态时 的体积分数
的体积分数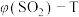 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 晶体置于真空刚性容器中,升温可发生反应:
晶体置于真空刚性容器中,升温可发生反应: 和
和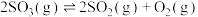 ,该体系达到平衡状态时
,该体系达到平衡状态时 的体积分数
的体积分数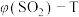 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.700 K前,只发生反应 |
B.650 K时,若容器内气体压强为 ,则 ,则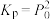 |
C.b点温度下, 分解率为8% 分解率为8% |
| D.在a点容器中加入催化剂,则b点将向上平移 |
您最近一年使用:0次
8 . 2023年全国两会政府工作报告指出,今年工作重点之一是深入推进环境污染防治,持续打好蓝天、碧水、净土保卫战。因此,研究大气中含硫化合物(主要为 、
、 )和含氮化合物的转化对环境保护具有重要意义。
)和含氮化合物的转化对环境保护具有重要意义。
(1)工业上用 和
和 的高温气相反应制备苯硫酚
的高温气相反应制备苯硫酚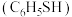 ,同时有副产物
,同时有副产物 生成:
生成:
Ⅰ.
Ⅱ.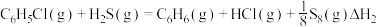
将 和
和 按物质的量比为
按物质的量比为 投入反应器,定时测定反应器尾端出来的混合气体中各产物的量,得到单程收率(
投入反应器,定时测定反应器尾端出来的混合气体中各产物的量,得到单程收率( )与温度的关系如图所示。
)与温度的关系如图所示。

①根据图像推测 *0,
*0,
_____ 0(填“大于”“小于”或“等于”,下同)。温度较低时,活化能Ⅱ_____ Ⅰ,则反应Ⅱ自发进行的条件是_____ (填“高温易自发”“低温易自发”或“任何温度都能自发”)。
②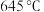 时,反应Ⅰ的化学平衡常数为
时,反应Ⅰ的化学平衡常数为_____ , 以上,随温度升高,苯硫酚的单程收率降低,反应Ⅰ消耗
以上,随温度升高,苯硫酚的单程收率降低,反应Ⅰ消耗
_____ (填“增多”或“减少”)。
(2)在固定体积的密闭容器中发生反应: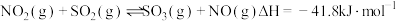 。设
。设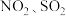 的初始物质的量分别为
的初始物质的量分别为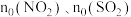 ,使用某种催化剂,改变
,使用某种催化剂,改变 的值进行多组实验(各组实验的温度可能相同,也可能不同),测定
的值进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率。部分实验结果如图所示。
的平衡转化率。部分实验结果如图所示。

①若 点对应实验中
点对应实验中 的起始浓度为
的起始浓度为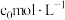 ,经过
,经过 达到平衡状态,该时段
达到平衡状态,该时段 的平均反应速率
的平均反应速率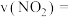
_____  。
。
②若图中C、D两点对应的实验温度分别为 和
和 ,如何通过计算判断
,如何通过计算判断 和
和 的相对大小:
的相对大小:_____ 。
 、
、 )和含氮化合物的转化对环境保护具有重要意义。
)和含氮化合物的转化对环境保护具有重要意义。(1)工业上用
 和
和 的高温气相反应制备苯硫酚
的高温气相反应制备苯硫酚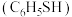 ,同时有副产物
,同时有副产物 生成:
生成:Ⅰ.

Ⅱ.
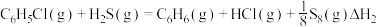
将
 和
和 按物质的量比为
按物质的量比为 投入反应器,定时测定反应器尾端出来的混合气体中各产物的量,得到单程收率(
投入反应器,定时测定反应器尾端出来的混合气体中各产物的量,得到单程收率( )与温度的关系如图所示。
)与温度的关系如图所示。
①根据图像推测
 *0,
*0,
②
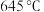 时,反应Ⅰ的化学平衡常数为
时,反应Ⅰ的化学平衡常数为 以上,随温度升高,苯硫酚的单程收率降低,反应Ⅰ消耗
以上,随温度升高,苯硫酚的单程收率降低,反应Ⅰ消耗
(2)在固定体积的密闭容器中发生反应:
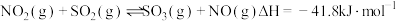 。设
。设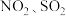 的初始物质的量分别为
的初始物质的量分别为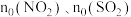 ,使用某种催化剂,改变
,使用某种催化剂,改变 的值进行多组实验(各组实验的温度可能相同,也可能不同),测定
的值进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率。部分实验结果如图所示。
的平衡转化率。部分实验结果如图所示。
①若
 点对应实验中
点对应实验中 的起始浓度为
的起始浓度为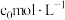 ,经过
,经过 达到平衡状态,该时段
达到平衡状态,该时段 的平均反应速率
的平均反应速率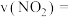
 。
。②若图中C、D两点对应的实验温度分别为
 和
和 ,如何通过计算判断
,如何通过计算判断 和
和 的相对大小:
的相对大小:
您最近一年使用:0次
解题方法
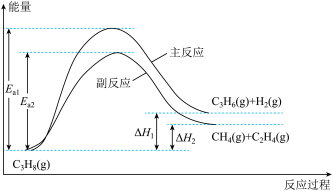
9 . 丙烯是重要的化工原料,丙烷直接脱氢制丙烯的相关反应及能量变化如图。
回答下列问题:
(1)主反应的焓变
______ 0(填“>”或“<”);在600℃、1MPa条件下,丙烷脱氢制丙烯反应到达平衡,测得 、
、 的体积分数均为30%,则此时
的体积分数均为30%,则此时 的体积分数为
的体积分数为____________ 。
(2)向密闭容器中充入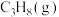 ,发生主反应:
,发生主反应: (忽略副反应的发生)。
(忽略副反应的发生)。
①测得反应速率方程为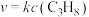 ,k为反应速率常数。已知:
,k为反应速率常数。已知: (R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是
(R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是______ (填“Catl”或“Cat2”)。
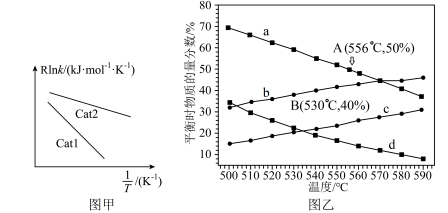
②在100 kPa、10 kPa不同起始压强下达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图乙所示。起始压强为10 kPa,丙烷、丙烯随温度变化的物质的量分数曲线分别是______ 、______ (填代号);A点对应的平衡常数
______ kPa( 为以分压表示的平衡常数);B点丙烷的平衡转化率为
为以分压表示的平衡常数);B点丙烷的平衡转化率为______ 。

回答下列问题:
(1)主反应的焓变

 、
、 的体积分数均为30%,则此时
的体积分数均为30%,则此时 的体积分数为
的体积分数为(2)向密闭容器中充入
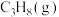 ,发生主反应:
,发生主反应: (忽略副反应的发生)。
(忽略副反应的发生)。①测得反应速率方程为
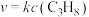 ,k为反应速率常数。已知:
,k为反应速率常数。已知: (R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是
(R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对k的影响如图甲所示,则催化效能较高的是
②在100 kPa、10 kPa不同起始压强下达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图乙所示。起始压强为10 kPa,丙烷、丙烯随温度变化的物质的量分数曲线分别是

 为以分压表示的平衡常数);B点丙烷的平衡转化率为
为以分压表示的平衡常数);B点丙烷的平衡转化率为
您最近一年使用:0次
名校
解题方法
10 . 氨是工农业生产中的重要原料,研究氨的合成和转化是一项重要的科研课题。回答下列问题:
(1)已知:工业合成氨合成塔中每产生2molNH3,放出92.2kJ热量,

则1molN-H键断裂吸收的能量为___________ kJ。
(2)在密闭容器中合成氨气,有利于加快反应速率且能提高H2转化率的措施是___________(填字母)
(3)将0.6molN2和0.8molH2充入恒容密闭容器中,在不同温度下,平衡时NH3的体积分数随压强变化的曲线如图。
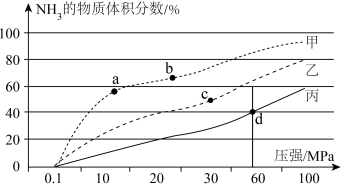
甲、乙、丙中温度从高到低的顺序是___________ 。d点N2的转化率是___________ ,d点Kp=___________ (Kp是以平衡分压表示的平衡常数,平衡分压=平衡时各组分的物质的量分数×总压)。
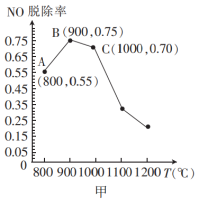
(4)催化氧化法消除NO反应原理为:6NO+4NH3 5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是___________ 。在温度超过1000°C时NO脱除率骤然下降的原因可能是___________ 。
(5)研究发现NH3与NO的反应历程如图乙所示。下列说法正确的是___________(填字母)。

(1)已知:工业合成氨合成塔中每产生2molNH3,放出92.2kJ热量,

则1molN-H键断裂吸收的能量为
(2)在密闭容器中合成氨气,有利于加快反应速率且能提高H2转化率的措施是___________(填字母)
| A.升高反应温度 | B.增大反应的压强 |
| C.及时移走生成的NH3 | D.增加H2的物质的量 |

甲、乙、丙中温度从高到低的顺序是
(4)催化氧化法消除NO反应原理为:6NO+4NH3
 5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
(5)研究发现NH3与NO的反应历程如图乙所示。下列说法正确的是___________(填字母)。

| A.该反应历程中形成了非极性键和极性键 |
| B.每生成2molN2,转移的电子总数为8NA |
| C.Fe2+能降低总反应的活化能,提高反应速率 |
| D.该反应历程中存在:NO+Fe2+-NH2=Fe2++N2↑+H2O |
您最近一年使用:0次
2023-04-16更新
|
542次组卷
|
4卷引用:广西壮族自治区2023届高三下学期第三次联合调研考试理综化学试题
广西壮族自治区2023届高三下学期第三次联合调研考试理综化学试题(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(原理综合题)(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)2024届四川省泸县第五中学高三上学期一诊模拟考试理综试题



