2024高三下·全国·专题练习
1 . 二甲醚(DME)在制药、燃料、农药等化学工业中有许多独特的用途。工业上常用合成气制备二甲醚的主要原理如下:①CO(g)+2H2(g)⇌CH3OH(g) ΔH1<0
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2<0
③CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH3<0
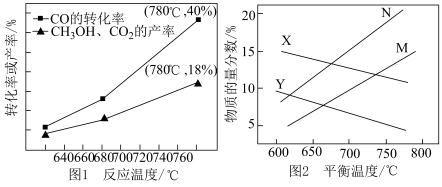
在催化剂作用下,发生上述3个反应,CO的转化率、CH3OH和CO2的产率和随温度变化关系如图1所示。总压分别为100kPa、10kPa时,平衡体系中CO和CH3OCH3(g)的物质的量分数随温度变化关系如图2所示
回答下列问题:
(1)图1中CO的转化率随温度升高而上升的原因是_______ 。
(2)图1中780℃时,CH3OCH3的选择性为_______ 。(CH3OCH3选择性= )
)
(3)能提高CH3OCH3选择性的最关键因素是_______ 。
(4)100kPa时,CO和CH3OCH3的物质的量分数随温度变化关系的曲线分别是_______ 、_______ 。
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2<0
③CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH3<0
在催化剂作用下,发生上述3个反应,CO的转化率、CH3OH和CO2的产率和随温度变化关系如图1所示。总压分别为100kPa、10kPa时,平衡体系中CO和CH3OCH3(g)的物质的量分数随温度变化关系如图2所示

回答下列问题:
(1)图1中CO的转化率随温度升高而上升的原因是
(2)图1中780℃时,CH3OCH3的选择性为
 )
)(3)能提高CH3OCH3选择性的最关键因素是
(4)100kPa时,CO和CH3OCH3的物质的量分数随温度变化关系的曲线分别是
您最近半年使用:0次
名校
解题方法
2 . 合成气(主要成分为CO、 及少量CO、
及少量CO、 )在工业上有广泛用途。
)在工业上有广泛用途。
(1)
 也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如右表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为
也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如右表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为_____ (填编号),基元反应 的焓变
的焓变
_____ kJ/mol。
由表中数据计算WGS反应的焓变
_____ kJ/mol。
(2)合成甲醇的主要反应为:
 。将CO与
。将CO与 混合气体充入密闭容器中,投料比
混合气体充入密闭容器中,投料比 ,测得平衡时混合气体中
,测得平衡时混合气体中 的物质的量分数
的物质的量分数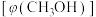 与温度(T)、压强(p)之间的关系如图所示。
与温度(T)、压强(p)之间的关系如图所示。
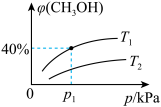
①图像中
_____  (填“>”、“<”或“=”,下同)。温度为
(填“>”、“<”或“=”,下同)。温度为 和
和 时对应的平衡常数分别为
时对应的平衡常数分别为 、
、 ,则
,则
_____  。
。
② 、
、 时,CO的转化率为
时,CO的转化率为_____ (保留3位有效数字)﹔压强平衡常数
_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含 的代数式表示)。
的代数式表示)。
③恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是_____ 。
A.CO、 的物质的量浓度不再随时间的变化而变化
的物质的量浓度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.混合气体的密度不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
 及少量CO、
及少量CO、 )在工业上有广泛用途。
)在工业上有广泛用途。(1)

 也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如右表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为
也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如右表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为 的焓变
的焓变
由表中数据计算WGS反应的焓变

| 基元反应 | 正逆反应活化能 | ||
 |  | ||
| ① |  | 0 | 67 |
| ② | 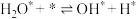 | 150 | 0 |
| ③ |  | 71 | 67 |
| ④ |  | 74 | 25 |
| ⑤ |  | 0 | 42 |
| ⑥ |  | 37 | 203 |
| ⑦ |  | 17 | 0 |
(2)合成甲醇的主要反应为:

 。将CO与
。将CO与 混合气体充入密闭容器中,投料比
混合气体充入密闭容器中,投料比 ,测得平衡时混合气体中
,测得平衡时混合气体中 的物质的量分数
的物质的量分数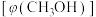 与温度(T)、压强(p)之间的关系如图所示。
与温度(T)、压强(p)之间的关系如图所示。
①图像中

 (填“>”、“<”或“=”,下同)。温度为
(填“>”、“<”或“=”,下同)。温度为 和
和 时对应的平衡常数分别为
时对应的平衡常数分别为 、
、 ,则
,则
 。
。②
 、
、 时,CO的转化率为
时,CO的转化率为
 的代数式表示)。
的代数式表示)。③恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是
A.CO、
 的物质的量浓度不再随时间的变化而变化
的物质的量浓度不再随时间的变化而变化B.混合气体的平均摩尔质量不再随时间的变化而变化
C.混合气体的密度不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
您最近半年使用:0次
2021高三·全国·专题练习
解题方法
3 . 醛类物质的用途广泛。如,甲醛蒸气可对空气消毒、甲醛溶液可用于生物标本的防腐等;脂肪醛类一般具有麻醉、催眠作用等。回答下列问题:
利用乙二醛(OHC—CHO)催化氧化法合成乙醛酸的反应原理为:2OHC—CHO(aq)+O2(g) 2OHC—COOH(aq)
2OHC—COOH(aq)
可能发生副反应有:2OHC—COOH(aq)+O2(g) 2H2C2O4(草酸)
2H2C2O4(草酸)
在反应瓶内加入含1molOHC—CHO(乙二醛)的反应液2L,加热至45~60℃,通入氧气并保持氧气压强为0.12MPa,反应3h达平衡状态,得到的混合液中含0.84molOHC—COOH(乙醛酸),0.12molH2C2O4(草酸),0.04molOHC—CHO(乙二醛)(溶液体积变化可忽略不计)。
(1)草酸的平均生成速率为___ mol·L-1·h-1。
(2)通过化学反应原理分析,增大压强有利于加快反应速率,对于乙二醛的转化率的影响是__ (填“增大”或“减小”)。
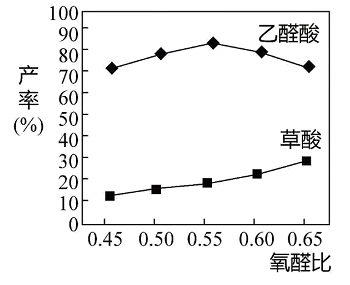
(3)如图所示为起始时氧醛比[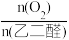 ]对乙醛酸产率的影响,则选择最佳氧醛比为
]对乙醛酸产率的影响,则选择最佳氧醛比为___ 。
利用乙二醛(OHC—CHO)催化氧化法合成乙醛酸的反应原理为:2OHC—CHO(aq)+O2(g)
 2OHC—COOH(aq)
2OHC—COOH(aq)可能发生副反应有:2OHC—COOH(aq)+O2(g)
 2H2C2O4(草酸)
2H2C2O4(草酸)在反应瓶内加入含1molOHC—CHO(乙二醛)的反应液2L,加热至45~60℃,通入氧气并保持氧气压强为0.12MPa,反应3h达平衡状态,得到的混合液中含0.84molOHC—COOH(乙醛酸),0.12molH2C2O4(草酸),0.04molOHC—CHO(乙二醛)(溶液体积变化可忽略不计)。
(1)草酸的平均生成速率为
(2)通过化学反应原理分析,增大压强有利于加快反应速率,对于乙二醛的转化率的影响是
(3)如图所示为起始时氧醛比[
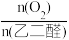 ]对乙醛酸产率的影响,则选择最佳氧醛比为
]对乙醛酸产率的影响,则选择最佳氧醛比为
您最近半年使用:0次
4 . 氨气常用作制冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)如图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
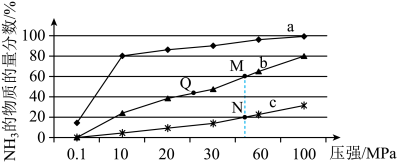
①曲线a对应的温度是_____________ 。
②关于工业合成氨的反应,下列叙述正确的是____________ (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q) >K(N)
③M点对应的H2转化率是____________ 。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3 mol H2时就会放出30.8 kJ的热。
①该反应的热化学方程式是____________________ 。
②反应的化学平衡常数表达式是____________ 。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是____________ 。

A.I图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图象中纵坐标可以为镓的转化率
C.III图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是:___________________ 。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。已知:
往X溶液中缓缓通入CO2,最先析出的氢氧化物是____________ 。
(4)工业上以电解精炼法提炼镓的原理如下:以待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+< Fe2+<Cu2+,电解精炼镓时阳极泥的成分是____________ 。
②GaO2-在阴极放电的电极方程式是___________ 。
(1)如图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是
②关于工业合成氨的反应,下列叙述正确的是
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q) >K(N)
③M点对应的H2转化率是
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3 mol H2时就会放出30.8 kJ的热。
①该反应的热化学方程式是
②反应的化学平衡常数表达式是
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是

A.I图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图象中纵坐标可以为镓的转化率
C.III图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是:
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
(4)工业上以电解精炼法提炼镓的原理如下:以待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+< Fe2+<Cu2+,电解精炼镓时阳极泥的成分是
②GaO2-在阴极放电的电极方程式是
您最近半年使用:0次
名校
解题方法
5 . 运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=_____________ 。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
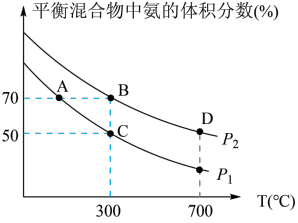
①恒压时,反应一定达到平衡状态的标志是_____________ (填序号)
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C. 保持不变 D.
保持不变 D.
②P1_____ P2 (填“<”或“>”或“=”或“不确定”,下同);反应的平衡常数:B点_______ D点。
③C点 的转化率为
的转化率为________ ;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________ υ(B)。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H=
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A.
 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变C.
 保持不变 D.
保持不变 D.
②P1
③C点
 的转化率为
的转化率为
您最近半年使用:0次
解题方法
6 . 碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。
已知:
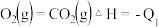

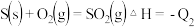

则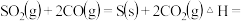
______  ;
;
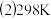 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应: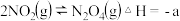

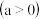 ,
, 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时, 的浓度为
的浓度为 的2倍,回答下列问题。
的2倍,回答下列问题。
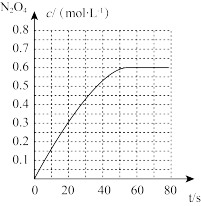
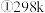 时,该反应的平衡常数为
时,该反应的平衡常数为 精确到小数点后两位
精确到小数点后两位 
______ 。
 在温度为
在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
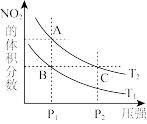
下列说法正确的是______
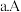 、C两点的反应速率:
、C两点的反应速率:
 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅
 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法
 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得 ,
,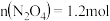 ,则此时
,则此时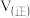
______ 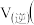 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL 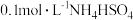 溶液中滴加
溶液中滴加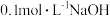 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

 水的电离程度最大的是
水的电离程度最大的是______ ;
 其溶液中
其溶液中 的数值最接近
的数值最接近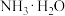 的电离常数K数值的是
的电离常数K数值的是______ 。
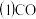 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。已知:

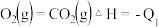

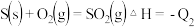

则
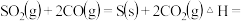
 ;
;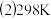 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应: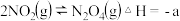

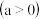 ,
, 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时, 的浓度为
的浓度为 的2倍,回答下列问题。
的2倍,回答下列问题。
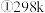 时,该反应的平衡常数为
时,该反应的平衡常数为 精确到小数点后两位
精确到小数点后两位 
 在温度为
在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
下列说法正确的是
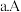 、C两点的反应速率:
、C两点的反应速率:
 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得 ,
,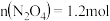 ,则此时
,则此时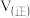
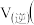 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL 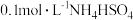 溶液中滴加
溶液中滴加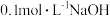 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
 水的电离程度最大的是
水的电离程度最大的是 其溶液中
其溶液中 的数值最接近
的数值最接近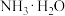 的电离常数K数值的是
的电离常数K数值的是
您最近半年使用:0次
2019-03-28更新
|
238次组卷
|
2卷引用:【市级联考】湖南省长沙市长望刘宁四区县2019届高三模拟考试(3月)理综化学试题
2018高二·全国·专题练习
解题方法
7 . 氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) △H=_________ 。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。
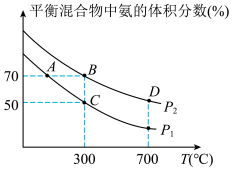
①恒压时,反应一定达到平衡状态的标志是______ (填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C. 比值保持不变 D.
比值保持不变 D.  =2
=2
②P1_____ P2 (填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点____ D点;
③C点H2的转化率____ ;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A)______ v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式__________ ;
②已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O⇌N2H5++OH- K1=1×10-a;N2H5++H2O⇌N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围_________ (用含a、b式子表示)。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) △H=
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。

①恒压时,反应一定达到平衡状态的标志是
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.
 比值保持不变 D.
比值保持不变 D.  =2
=2②P1
③C点H2的转化率
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式
②已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O⇌N2H5++OH- K1=1×10-a;N2H5++H2O⇌N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围
您最近半年使用:0次



