解题方法
1 . 甲醇是重要的化工原料,也可作燃料。工业上可用CO2和H2在一定条件下合成甲醇。回答下列问题。
(1)已知:CO 和 H2 的燃烧热分别为 283.0 kJ·mol-1、285.8kJ·mol-1 ,水的汽化热为 44.0kJ·mol-1, 反应① CO+H2O=CO2+H2 是生成合成甲醇的原料气(CO2、H2)的重要反应,其热化学方程式为: CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =_____ kJ·mol-1。
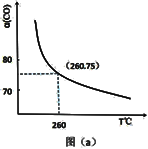
(2)某同学设计实验对反应①进行研究。将 1mol H2O(g)和 1mol CO 充入一个恒容密闭容器中,在催化剂和一定温度下达到化学平衡。如图是 CO 的平衡转化率(%)随温度变化的曲线,260℃时反应①的平衡常数 K=_______ 。
(3)CO2和 H2在催化剂、一定温度下合成甲醇。图为在容积为 1L 的恒容密闭容器中,加入 3 molH2和 1molCO2时经过相同时间甲醇产率与反应温度的关系曲线:
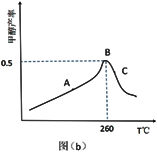
曲线上 A 点_____ (填“是”或“不是”)对应温度下的平衡产率,理由是_____ ,C 点甲醇的产率低于 B 点的原因可能是_____ (填标号)。
A.反应活化能增大 B.催化剂活性低 C.副反应多 D.平衡常数变大 E.平衡逆向移动
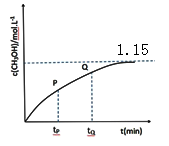
(4)CO和 H2在一定条件下也可以合成甲醇。在容积为1L的恒容密闭容器中,加入 a molH2和2.0molCO,在催化剂和 260℃温度条件下发生反应:CO+2H2=CH3OH。图为甲醇的浓度与反应时间的关系曲线,tP 时的 v 逆_____ tQ 时的 v 逆(填大于、小于或等于),判断的依据是_____ ,达平衡时氢气的浓度为 1.0mol/L,则起始时加入的氢气的物质的量为_____ mol。
(1)已知:CO 和 H2 的燃烧热分别为 283.0 kJ·mol-1、285.8kJ·mol-1 ,水的汽化热为 44.0kJ·mol-1, 反应① CO+H2O=CO2+H2 是生成合成甲醇的原料气(CO2、H2)的重要反应,其热化学方程式为: CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =
(2)某同学设计实验对反应①进行研究。将 1mol H2O(g)和 1mol CO 充入一个恒容密闭容器中,在催化剂和一定温度下达到化学平衡。如图是 CO 的平衡转化率(%)随温度变化的曲线,260℃时反应①的平衡常数 K=

(3)CO2和 H2在催化剂、一定温度下合成甲醇。图为在容积为 1L 的恒容密闭容器中,加入 3 molH2和 1molCO2时经过相同时间甲醇产率与反应温度的关系曲线:

曲线上 A 点
A.反应活化能增大 B.催化剂活性低 C.副反应多 D.平衡常数变大 E.平衡逆向移动
(4)CO和 H2在一定条件下也可以合成甲醇。在容积为1L的恒容密闭容器中,加入 a molH2和2.0molCO,在催化剂和 260℃温度条件下发生反应:CO+2H2=CH3OH。图为甲醇的浓度与反应时间的关系曲线,tP 时的 v 逆

您最近半年使用:0次
名校
解题方法
2 . 磷酸氯喹是治疗新型肺炎的潜力药,磷酸是合成该药的初级原料之一,沸点高,难挥发。化学兴趣小组设计了合成磷酸的流程如图。

回答下列问题:
(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度、体积均不变)反应器中制取A,各物质的物质的量与时间的关系如图。

①前10s消耗的氯气为______ mol,该反应的化学方程式为_______________ (A 用化学式表示)。
②前10s的平均反应速率v(Cl2)=_____ mol•L-1•s-1。
(2)将 A加入热水中,生成两种酸,一种为磷酸,反应过程中各元素化合价不变。
①另一种酸C是___ (写名称)。
②A与热水反应的化学方程式为_____________ 。

回答下列问题:
(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度、体积均不变)反应器中制取A,各物质的物质的量与时间的关系如图。

①前10s消耗的氯气为
②前10s的平均反应速率v(Cl2)=
(2)将 A加入热水中,生成两种酸,一种为磷酸,反应过程中各元素化合价不变。
①另一种酸C是
②A与热水反应的化学方程式为
您最近半年使用:0次
2020-07-22更新
|
54次组卷
|
3卷引用:安徽省阜阳市界首中学2019-2020学年高一下学期期末考试化学试题
解题方法
3 . 氨是重要的化工原料,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)二十世纪初,工业以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
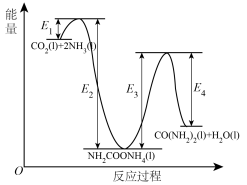
①反应a为反应_____ (填“放热”或“吸热”)。
②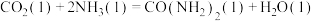

_____ kJ/mol(用含“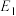 、
、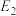 、
、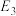 、
、 ”的代数式表示)。
”的代数式表示)。
(2)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位, 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 ),其中
),其中 的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
(i)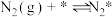
(ii)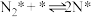
(iii)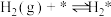
(iv)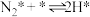
(v)
……
(…)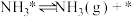
实际生产中, 和
和 的物质的量之比并非
的物质的量之比并非 ,而是
,而是 ,分析说明原料气中
,分析说明原料气中 适度过量的2个理由:
适度过量的2个理由:
①_____ ;②_____ 。
(3)若在不同压强下,以投料比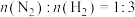 的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数:
的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数: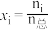 )
)
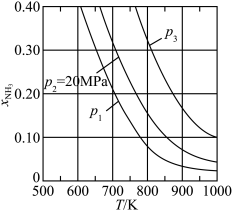
①图中压强由小到大的顺序为_____ 。
②当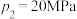 、
、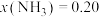 时,氮气的转化率ɑ=
时,氮气的转化率ɑ=_____ (保留到小数点后一位)。
③某温度下,在1L的密闭容器中充入 和
和 ,反应达到平衡后,测得
,反应达到平衡后,测得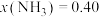 ,计算该温度下合成氨反应的平衡常数为
,计算该温度下合成氨反应的平衡常数为_____ 。
(1)二十世纪初,工业以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:a.
为原料在一定温度和压强下合成尿素。反应分两步:a. 和
和 生成
生成 ;b.
;b. 分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
分解生成尿素,结合反应过程中能量变化示意图(如图),回答问题:
①反应a为反应
②
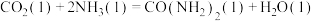

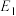 、
、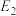 、
、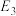 、
、 ”的代数式表示)。
”的代数式表示)。(2)研究表明,合成氨反应在Fe催化剂上可能通过下图机理进行(*表示催化剂表面吸附位,
 表示被吸附于催化剂表面的
表示被吸附于催化剂表面的 ),其中
),其中 的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。
的吸附分解反应活化能高,速率慢,是合成氨反应的决速步。(i)
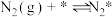
(ii)
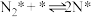
(iii)
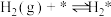
(iv)
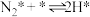
(v)

……
(…)
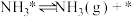
实际生产中,
 和
和 的物质的量之比并非
的物质的量之比并非 ,而是
,而是 ,分析说明原料气中
,分析说明原料气中 适度过量的2个理由:
适度过量的2个理由:①
(3)若在不同压强下,以投料比
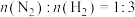 的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数:
的方式进料,反应达平衡时氨的物质的量分数与温度的计算结果如图所示:(物质i的物质的量分数: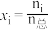 )
)
①图中压强由小到大的顺序为
②当
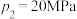 、
、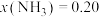 时,氮气的转化率ɑ=
时,氮气的转化率ɑ=③某温度下,在1L的密闭容器中充入
 和
和 ,反应达到平衡后,测得
,反应达到平衡后,测得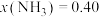 ,计算该温度下合成氨反应的平衡常数为
,计算该温度下合成氨反应的平衡常数为
您最近半年使用:0次
名校
解题方法
4 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应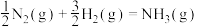 的
的
___________  。
。

(2)合成氮的原料混合气体的进料组成为 ;
;
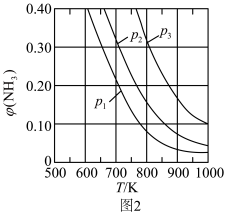
①在不同压强下反应达平衡时,氨的体积分数 与温度的关系如图2所示,其中压强(
与温度的关系如图2所示,其中压强( 、
、 、
、 )
)由小到大 的顺序为___________ 。
②将混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中 的体积分数
的体积分数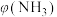 关系如图3所示,图3中各点表示的状态一定
关系如图3所示,图3中各点表示的状态一定未达到 平衡的是___________ (填字母)。
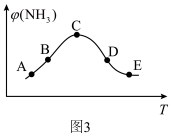
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是___________(填字母)。
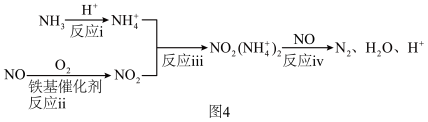
(4)氮氧化物会造成环境污染,SCR技术利用 选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
①对于反应ii: ,用
,用 表示的速率方程为
表示的速率方程为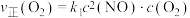 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则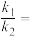
___________ (填数值)。
②根据上述机理,等物质的量的 、NO在有氧条件下完全转化为
、NO在有氧条件下完全转化为 的总反应化学方程式为
的总反应化学方程式为___________ 。
(1)根据图1数据计算反应
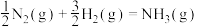 的
的
 。
。
(2)合成氮的原料混合气体的进料组成为
 ;
;①在不同压强下反应达平衡时,氨的体积分数
 与温度的关系如图2所示,其中压强(
与温度的关系如图2所示,其中压强( 、
、 、
、 )
)
②将混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中
 的体积分数
的体积分数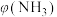 关系如图3所示,图3中各点表示的状态一定
关系如图3所示,图3中各点表示的状态一定
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是___________(填字母)。
| A.采用较高温度(400~500℃) | B.将生成的氨液化并及时从体系中分离出来 |
| C.用铁触媒加快化学反应速率 | D.采用较高压强(20~50MPa) |
(4)氮氧化物会造成环境污染,SCR技术利用
 选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
①对于反应ii:
 ,用
,用 表示的速率方程为
表示的速率方程为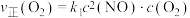 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则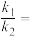
②根据上述机理,等物质的量的
 、NO在有氧条件下完全转化为
、NO在有氧条件下完全转化为 的总反应化学方程式为
的总反应化学方程式为
您最近半年使用:0次
5 . 综合利用含碳资源、促进碳中和在保护生态环境等方面具有重要意义。回答下列问题:
(1)中国科学院在国际上宣布首次实现CO2到淀粉的全合成,其中前两步涉及的反应如图1所示。
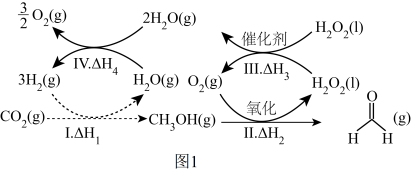
①反应:CO2(g)+2H2(g)=HCHO(g)+H2O(g)△H=_______ (用△H1、△H2、△H3、△H4表示)。
②反应I进行时,同时发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=
C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=_______ 。CH3OH物质的量分数为_______ %(计算结果保留1位小数)。
(2)乙烯是合成工业的重要原料,一定条件下可发生反应:3C2H4(g) 2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
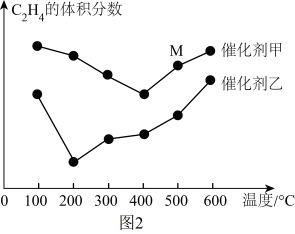
在催化剂甲作用下,图2中M点的速率V正_______ V逆(填“>”“<”或“=”),根据图中所给信息,应选择的反应条件为_______ 。
(3)CO2氧化1-丁烯脱氢生产1,3-丁二烯,其反应原理为:CH2=CHCH2CH3(g)+CO2(g)→CH2=CHCH=CH2(g)+H2O(g)+CO(g)氧化脱氢反应可能的反应路径有两种,如图3所示:
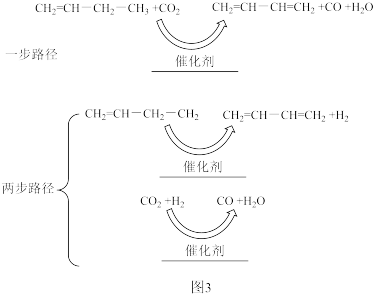
①为确定反应路径,可检测反应体系中的物质是_______ (填化学式)。
②若为“两步路径”,在温度和总压相同时,1-丁烯氧化脱氢的平衡转化率高于直接脱氢的原因是_______ 。
(1)中国科学院在国际上宣布首次实现CO2到淀粉的全合成,其中前两步涉及的反应如图1所示。

①反应:CO2(g)+2H2(g)=HCHO(g)+H2O(g)△H=
②反应I进行时,同时发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=
C2H4(g)+4H2O(g)。在1L恒容密闭容器中充入4.0molCO2和6.0molH2,一定温度下,达到平衡时,c(CO2)=c(H2O)=2.4mol/L,请回答下列问题:反应I的平衡常数的表达式K=(2)乙烯是合成工业的重要原料,一定条件下可发生反应:3C2H4(g)
 2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
2C3H6(g)分别在不同温度、不同催化剂下,保持其他初始条件不变,重复实验,经相同时间测得C2H4体积分数与温度的关系如图2所示。
在催化剂甲作用下,图2中M点的速率V正
(3)CO2氧化1-丁烯脱氢生产1,3-丁二烯,其反应原理为:CH2=CHCH2CH3(g)+CO2(g)→CH2=CHCH=CH2(g)+H2O(g)+CO(g)氧化脱氢反应可能的反应路径有两种,如图3所示:

①为确定反应路径,可检测反应体系中的物质是
②若为“两步路径”,在温度和总压相同时,1-丁烯氧化脱氢的平衡转化率高于直接脱氢的原因是
您最近半年使用:0次
名校
解题方法
6 . 诺贝尔化学奖获得者GeorgeA.Olah 提出了“甲醇经济”的概念,他建议用甲醇来代替目前广泛使用的化石燃料。工业上用天然气为原料,分为两个阶段制备甲醇:
i.制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH= + 206.0 kJ·mol-1
CO(g)+3H2(g) ΔH= + 206.0 kJ·mol-1
ii.合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH= - 90.67kJ·mol-1
CH3OH(g) ΔH= - 90.67kJ·mol-1
(焓变 ΔH>0:反应吸热;ΔH<0:反应放热) 回答下列问题:
(1)制备合成气反应中,平衡混合物中 CO 的体积分数与压强的关系如图 1 所示,判断T1和T2的大小关系:T1___________ T2(填“<”或“=”),理由是___________ 。

(2)工业生产中为解决合成气中 H2过量而 CO 不足的问题,原料气中需添加 CO2,发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH= + 41.17kJ·mol-1。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) ΔH= + 41.17kJ·mol-1。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为___________ 。
(3)在体积不变的密闭容器中投入 0.5mol CO 和 1mol H2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。

①图 2 中 X 代表___________ (填“温度”或“压强”)。图 3 中正确表示该反应的平衡常数的负对数pK(pK=-lgK)与X 的关系的曲线___________ (填“AC”或“AB”)。
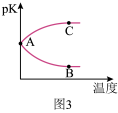
②若图 2 中M 点对应的容器体积为 5L,则N 点的平衡常数K 为___________ 。
(4)通过光催化、光电催化或电水制氢来进行二氧化碳加氢制甲醇(CH3OH),发生的主要反应是:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是
CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是___________ (填标号)。
a.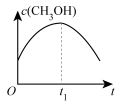 b.
b.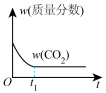
c.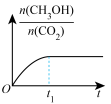 d.
d.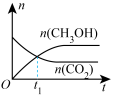
i.制备合成气:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH= + 206.0 kJ·mol-1
CO(g)+3H2(g) ΔH= + 206.0 kJ·mol-1ii.合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH= - 90.67kJ·mol-1
CH3OH(g) ΔH= - 90.67kJ·mol-1(焓变 ΔH>0:反应吸热;ΔH<0:反应放热) 回答下列问题:
(1)制备合成气反应中,平衡混合物中 CO 的体积分数与压强的关系如图 1 所示,判断T1和T2的大小关系:T1

(2)工业生产中为解决合成气中 H2过量而 CO 不足的问题,原料气中需添加 CO2,发生反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH= + 41.17kJ·mol-1。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) ΔH= + 41.17kJ·mol-1。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为(3)在体积不变的密闭容器中投入 0.5mol CO 和 1mol H2,不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图 2 所示。
①图 2 中 X 代表

②若图 2 中M 点对应的容器体积为 5L,则N 点的平衡常数K 为
(4)通过光催化、光电催化或电水制氢来进行二氧化碳加氢制甲醇(CH3OH),发生的主要反应是:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是
CH3OH(g)+H2O(g)。若二氧化碳加氢制甲醇的反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 t1时刻达到平衡状态的是a.
 b.
b.
c.
 d.
d.
您最近半年使用:0次
名校
7 . 以CO2为原料合成CH3OH和CH3OCH3是实现碳中和的重要途径之一。有关反应如下:
反应I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1
反应Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-25.0kJ·mol-1
反应Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3=+41.2kJ·mol-1
回答下列问题:
(1)反应Ⅳ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH4=___________ 。
(2)在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇(反应I)的历程如图所示。

在反应气中加入少量水能够提升甲醇产率的原因是___________ 。
(3)催化条件下,某密闭容器中投入CO2和H2发生反应I和反应Ⅱ,实验测得温度对平衡体系中甲醇、甲醚含量的影响如图所示。
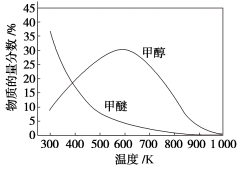
600K以下,甲醇百分含量变化的可能原因是___________ ;一定温度下,增大压强,甲醚的百分含量___________ (填“增大”“减小”或“不变”)。
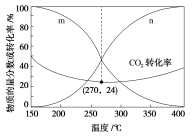
(4)在5MPa下,CO2和H2按物质的量之比为1∶3进行投料,发生反应I和反应Ⅲ,平衡时CO和CH3OH在含碳产物中的物质的量分数及CO2转化率随温度的变化如图所示。图中n代表的物质是___________ ;150~400℃范围内,随温度升高,H2O的平衡产量变化趋势是___________ ;270℃时CH3OH的分压为___________ (保留2位有效数字,下同),反应Ⅲ的平衡常数Kp=___________ (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
反应I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1
反应Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-25.0kJ·mol-1
反应Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3=+41.2kJ·mol-1
回答下列问题:
(1)反应Ⅳ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH4=
(2)在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇(反应I)的历程如图所示。

在反应气中加入少量水能够提升甲醇产率的原因是
(3)催化条件下,某密闭容器中投入CO2和H2发生反应I和反应Ⅱ,实验测得温度对平衡体系中甲醇、甲醚含量的影响如图所示。

600K以下,甲醇百分含量变化的可能原因是
(4)在5MPa下,CO2和H2按物质的量之比为1∶3进行投料,发生反应I和反应Ⅲ,平衡时CO和CH3OH在含碳产物中的物质的量分数及CO2转化率随温度的变化如图所示。图中n代表的物质是

您最近半年使用:0次
名校
解题方法
8 . 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,反应物的物质的量之比n(CO2)∶n(H2)=___________ 。当反应达到平衡时,若增大压强,则n(C2H4)___________ (填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
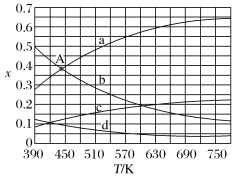
图中,表示H2、H2O变化的曲线分别是___________ 、___________ 。CO2催化加氢合成C2H4反应的ΔH___________ 0(填“大于”或“小于”)。
(3)根据图中点A(440 K,0.39),计算该温度时平衡分压p(H2O) =___________ ,p(C2H4)=___________ (分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________ 。
(1)CO2催化加氢生成乙烯和水的反应中,反应物的物质的量之比n(CO2)∶n(H2)=
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

图中,表示H2、H2O变化的曲线分别是
(3)根据图中点A(440 K,0.39),计算该温度时平衡分压p(H2O) =
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当
您最近半年使用:0次
名校
解题方法
9 . 氨是工农业生产中的重要原料,研究氨的合成和转化是一项重要的科研课题。回答下列问题:
(1)已知:工业合成氨合成塔中每产生2molNH3,放出92.2kJ热量,

则1molN-H键断裂吸收的能量为___________ kJ。
(2)在密闭容器中合成氨气,有利于加快反应速率且能提高H2转化率的措施是___________(填字母)
(3)将0.6molN2和0.8molH2充入恒容密闭容器中,在不同温度下,平衡时NH3的体积分数随压强变化的曲线如图。
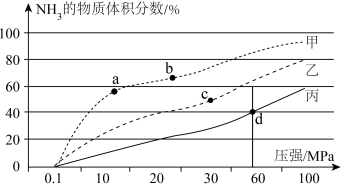
甲、乙、丙中温度从高到低的顺序是___________ 。d点N2的转化率是___________ ,d点Kp=___________ (Kp是以平衡分压表示的平衡常数,平衡分压=平衡时各组分的物质的量分数×总压)。
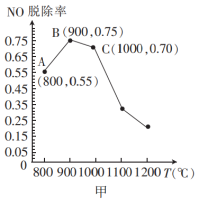
(4)催化氧化法消除NO反应原理为:6NO+4NH3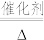 5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是___________ 。在温度超过1000°C时NO脱除率骤然下降的原因可能是___________ 。
(5)研究发现NH3与NO的反应历程如图乙所示。下列说法正确的是___________(填字母)。

(1)已知:工业合成氨合成塔中每产生2molNH3,放出92.2kJ热量,

则1molN-H键断裂吸收的能量为
(2)在密闭容器中合成氨气,有利于加快反应速率且能提高H2转化率的措施是___________(填字母)
| A.升高反应温度 | B.增大反应的压强 |
| C.及时移走生成的NH3 | D.增加H2的物质的量 |

甲、乙、丙中温度从高到低的顺序是
(4)催化氧化法消除NO反应原理为:6NO+4NH3
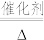 5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
5N2+6H2O。不同温度条件下,氨气与一氧化氮的物质的量之比为2:1时,得到NO脱除率曲线如图甲所示。脱除NO的最佳温度是
(5)研究发现NH3与NO的反应历程如图乙所示。下列说法正确的是___________(填字母)。

| A.该反应历程中形成了非极性键和极性键 |
| B.每生成2molN2,转移的电子总数为8NA |
| C.Fe2+能降低总反应的活化能,提高反应速率 |
| D.该反应历程中存在:NO+Fe2+-NH2=Fe2++N2↑+H2O |
您最近半年使用:0次
2023-04-16更新
|
537次组卷
|
4卷引用:广西壮族自治区2023届高三下学期第三次联合调研考试理综化学试题
广西壮族自治区2023届高三下学期第三次联合调研考试理综化学试题(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(原理综合题)(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)2024届四川省泸县第五中学高三上学期一诊模拟考试理综试题
名校
解题方法
10 .  在化工生产中有重要作用.天然气法合成
在化工生产中有重要作用.天然气法合成 相关反应如下:
相关反应如下:
反应I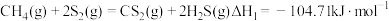
反应Ⅱ
(1) 、
、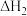 随温度变化不大。温度不同时,反应体系中
随温度变化不大。温度不同时,反应体系中 不同。合成
不同。合成 总反应
总反应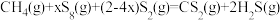 的
的 随温度T变化如图。
随温度T变化如图。
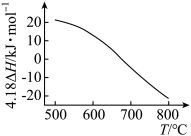
①

________  。
。
②为提高 平衡转化率,控制温度范围在
平衡转化率,控制温度范围在________ (填标号),理由是________ 。
A.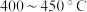 B.
B.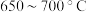 C.
C.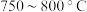 D.
D. 以上
以上
(2)合成 总反应中硫蒸气达到饱和时,反应时间t与
总反应中硫蒸气达到饱和时,反应时间t与 初始浓度
初始浓度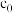 和
和 转化率
转化率 满足关系
满足关系 ,式中k为速率常数。
,式中k为速率常数。
① 、
、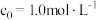 时,测得
时,测得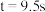 、
、 ,则
,则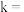
________ 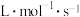 。
。
② 时,计划在
时,计划在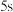 内转化率达
内转化率达 ,应控制初始浓度
,应控制初始浓度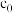 大于
大于________  。
。
(3)利用工业废气 替代硫磺矿生产
替代硫磺矿生产 的反应为
的反应为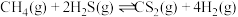 。反应物投料比采用
。反应物投料比采用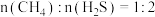 ,维持体系压强为
,维持体系压强为 ,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
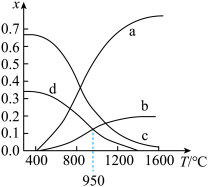
①图中表示 的曲线是
的曲线是________ (填“a”“b”“c”或“d”)。
② 时,该反应的
时,该反应的
________ (以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
③相比以硫磺矿为原料,使用 的优点是
的优点是________ ,缺点是________ 。
 在化工生产中有重要作用.天然气法合成
在化工生产中有重要作用.天然气法合成 相关反应如下:
相关反应如下:反应I
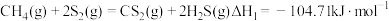
反应Ⅱ

(1)
 、
、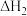 随温度变化不大。温度不同时,反应体系中
随温度变化不大。温度不同时,反应体系中 不同。合成
不同。合成 总反应
总反应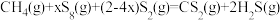 的
的 随温度T变化如图。
随温度T变化如图。
①


 。
。②为提高
 平衡转化率,控制温度范围在
平衡转化率,控制温度范围在A.
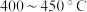 B.
B.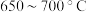 C.
C.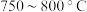 D.
D. 以上
以上(2)合成
 总反应中硫蒸气达到饱和时,反应时间t与
总反应中硫蒸气达到饱和时,反应时间t与 初始浓度
初始浓度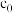 和
和 转化率
转化率 满足关系
满足关系 ,式中k为速率常数。
,式中k为速率常数。①
 、
、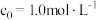 时,测得
时,测得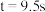 、
、 ,则
,则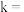
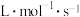 。
。②
 时,计划在
时,计划在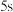 内转化率达
内转化率达 ,应控制初始浓度
,应控制初始浓度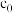 大于
大于 。
。(3)利用工业废气
 替代硫磺矿生产
替代硫磺矿生产 的反应为
的反应为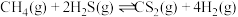 。反应物投料比采用
。反应物投料比采用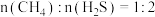 ,维持体系压强为
,维持体系压强为 ,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图。
①图中表示
 的曲线是
的曲线是②
 时,该反应的
时,该反应的
 总压
总压 物质的量分数)。
物质的量分数)。③相比以硫磺矿为原料,使用
 的优点是
的优点是
您最近半年使用:0次
2023-03-08更新
|
877次组卷
|
3卷引用:福建省厦门市2023届高三毕业班3月第二次质量检测化学试题



