名校
1 . 氧和氮是大气的主要成分,氮的化合物在工业上均有重要的应用。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:________________
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是__________________ 。(填序号)
①单位时间内生成n molN2的同时生成2n molNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态 ⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态。
为提高H2的转化率,实际生产中宜采取的措施有________ (填字母)。
A.及时移出氨 B.最适合催化剂活性的适当高温
C.适当增大压强 D.循环利用和不断补充氮气
E.减小压强 F.降低温度
(3)电厂烟气脱氮的主反应①: 4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②: 2NH3(g)+8NO(g)
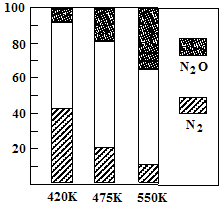
5N2(g)+6H2O(g),副反应②: 2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400K~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400K~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是_____________________________
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2 L的恒容密闭容器中充入2mol N2H4,发生反应N2H4(g) N2(g)+2H2(g),
N2(g)+2H2(g),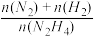 (用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=_______________ 。
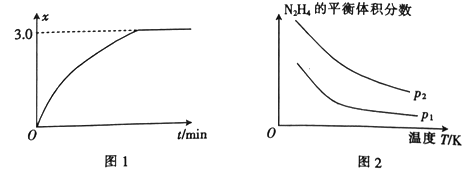
肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2_______ (填“大于”或“小于”) p1。
(1)根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:
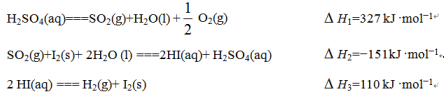
(2)在恒容密闭容器中,发生反应N2(g)+3H2(g)
 2NH3(g),下列说法可以证明反应已达到平衡状态的是
2NH3(g),下列说法可以证明反应已达到平衡状态的是①单位时间内生成n molN2的同时生成2n molNH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态 ⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态。
为提高H2的转化率,实际生产中宜采取的措施有
A.及时移出氨 B.最适合催化剂活性的适当高温
C.适当增大压强 D.循环利用和不断补充氮气
E.减小压强 F.降低温度
(3)电厂烟气脱氮的主反应①: 4NH3(g)+6NO(g)
 5N2(g)+6H2O(g),副反应②: 2NH3(g)+8NO(g)
5N2(g)+6H2O(g),副反应②: 2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400K~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400K~600K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是
(4)肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2 L的恒容密闭容器中充入2mol N2H4,发生反应N2H4(g)
 N2(g)+2H2(g),
N2(g)+2H2(g),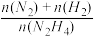 (用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
(用x表示)与时间的关系如图1所示,则该温度下,此反应的平衡常数K=
肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系,则p2
您最近半年使用:0次
2017-10-28更新
|
405次组卷
|
2卷引用:河南省商丘市第一高级中学2017-2018学年高二10月月考化学试题
2 . 某兴趣小组同学探究 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将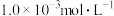 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。
【设计实验】
(1)补全 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:_______ 。

(2)实验①和②的目的是_______ 。
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a. 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:
反应ⅰ.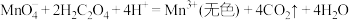
反应ⅱ.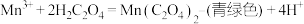
反应ⅲ。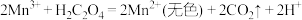
b. 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。
c. 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。
【继续探究】
进一步实验证明溶液中含有 ,实验①反应过程中
,实验①反应过程中 和
和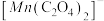 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
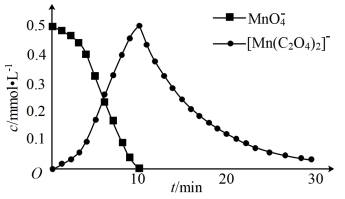
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ_______ 反应ⅲ(填“>”、“=”或“<”)。
(4)小组同学认为反应ⅱ的离子方程式应该改为: ,结合实验现象,说明其理由
,结合实验现象,说明其理由_______ 。
 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将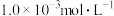 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。【设计实验】
| 序号 | V( 酸性溶液)/ 酸性溶液)/ | V(草酸溶液)/ | 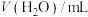 | 反应温度/ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:
(2)实验①和②的目的是
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a.
 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:反应ⅰ.
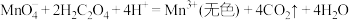
反应ⅱ.
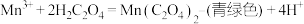
反应ⅲ。
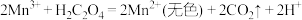
b.
 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。c.
 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。【继续探究】
进一步实验证明溶液中含有
 ,实验①反应过程中
,实验①反应过程中 和
和 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ
(4)小组同学认为反应ⅱ的离子方程式应该改为:
 ,结合实验现象,说明其理由
,结合实验现象,说明其理由
您最近半年使用:0次
解题方法
3 . 从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)司南是由天然磁石制成的,其主要成分是______ (填字母序号)。
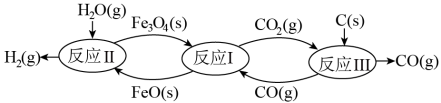
(2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。
①已知:Fe3O4(s)+CO(g) 3FeO(s)+CO2(g)ΔH1==+19.3kJ·mol-1
3FeO(s)+CO2(g)ΔH1==+19.3kJ·mol-1
3FeO(s)+H2O(g) Fe3O4(s)+H2(g)ΔH2==-57.2kJ·mol-1
Fe3O4(s)+H2(g)ΔH2==-57.2kJ·mol-1
C(s)+CO2(g) 2CO(g)ΔH3==+172.4kJ·mol-1
2CO(g)ΔH3==+172.4kJ·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是______ 。
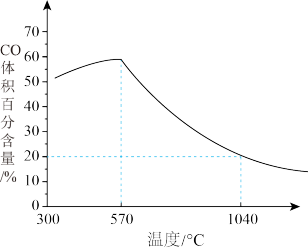
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
i.反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g)ΔH
3Fe(s)+4CO2(g)ΔH______ 0(填“>”、“<”或“=”),理由是______ 。
ii.随温度升高,反应Fe3O4(s)+CO(g) 3FeO(s)+CO2(g)平衡常数的变化趋势是
3FeO(s)+CO2(g)平衡常数的变化趋势是______ ;1040℃时,该反应的化学平衡常数的数值是______ 。
(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是______ 。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用______ 。
(1)司南是由天然磁石制成的,其主要成分是
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。

①已知:Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g)ΔH1==+19.3kJ·mol-1
3FeO(s)+CO2(g)ΔH1==+19.3kJ·mol-13FeO(s)+H2O(g)
 Fe3O4(s)+H2(g)ΔH2==-57.2kJ·mol-1
Fe3O4(s)+H2(g)ΔH2==-57.2kJ·mol-1C(s)+CO2(g)
 2CO(g)ΔH3==+172.4kJ·mol-1
2CO(g)ΔH3==+172.4kJ·mol-1铁氧化物循环裂解水制氢气总反应的热化学方程式是
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。

i.反应Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2(g)ΔH
3Fe(s)+4CO2(g)ΔHii.随温度升高,反应Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g)平衡常数的变化趋势是
3FeO(s)+CO2(g)平衡常数的变化趋势是(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用
您最近半年使用:0次
名校
解题方法
4 . 铁及其化合物在工农业生产中有重要的作用。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol;
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原Fe2O3的热化学方程式为__________________________________________ 。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的新举措,反应原理:CO(g)+2H2(g) CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
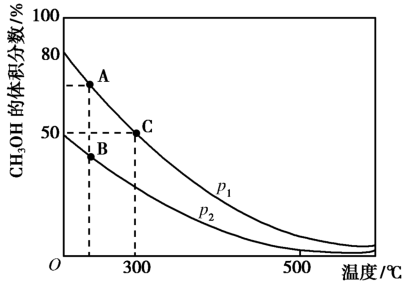
①在上图A、B、C三点中,选出对应下表物理量最小的点。
②在300℃时,向C点平衡体系中再充入0. 5molCO、1.0molH2和0.5mol的CH3OH,该反应向_________ 方向进行(填“正反应”、‘逆反应”或“不移动”)。
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系图所示,测得D点氢气的转化率为40%,则x=_____________ 。
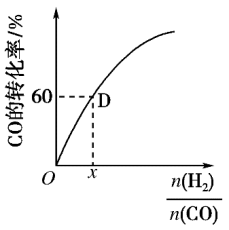
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为_________ 。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38]
(4)莫尔盐,即六水合硫酸亚铁铵晶体,是一种重要的化工原料,在空气中缓慢风化及氧化,欲证明一瓶久置的莫尔盐已经部分氧化,需要进行实验操作是:取少量样品,加无氧水溶解,将溶液分成两份,______________________________________ ,则证明该样品已部分氧化。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol;
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原Fe2O3的热化学方程式为
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的新举措,反应原理:CO(g)+2H2(g)
 CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
①在上图A、B、C三点中,选出对应下表物理量最小的点。
| 反应速率 | 平衡常数K | 平衡转化率α |
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系图所示,测得D点氢气的转化率为40%,则x=

(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为
(4)莫尔盐,即六水合硫酸亚铁铵晶体,是一种重要的化工原料,在空气中缓慢风化及氧化,欲证明一瓶久置的莫尔盐已经部分氧化,需要进行实验操作是:取少量样品,加无氧水溶解,将溶液分成两份,
您最近半年使用:0次
解题方法
5 . 一定条件下,1-苯基丙炔(Ph-C=C-CH3)可与HCl发生催化加成,反应如下:不正确 的是
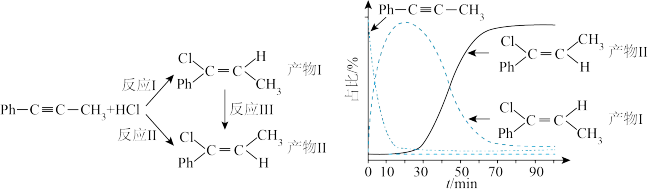
| A.反应活化能:反应I<反应Ⅱ |
| B.反应焓变:反应I<反应Ⅱ |
| C.增加HCl浓度不会改变平衡时产物Ⅱ和产物I的比例 |
| D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ |
您最近半年使用:0次
6 . 在 ℃,
℃,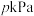 下,向1L的密闭容器中充入1mol
下,向1L的密闭容器中充入1mol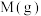 和一定物质的量的
和一定物质的量的 发生反应:
发生反应: ,平衡时
,平衡时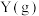 的物质的量分数与初始投料比
的物质的量分数与初始投料比 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 ℃,
℃,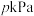 下,向1L的密闭容器中充入1mol
下,向1L的密闭容器中充入1mol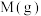 和一定物质的量的
和一定物质的量的 发生反应:
发生反应: ,平衡时
,平衡时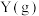 的物质的量分数与初始投料比
的物质的量分数与初始投料比 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.随着 的增大, 的增大,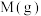 的转化率逐渐增大 的转化率逐渐增大 |
B.e点: |
C.a点时,该反应的平衡常数为 |
D.a点,平衡后再投入1mol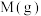 和1mol 和1mol ,达到新平衡时, ,达到新平衡时,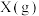 的产率增大 的产率增大 |
您最近半年使用:0次
名校
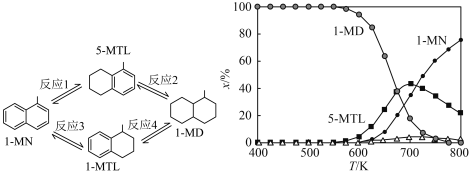
7 . 下图(左)表示1-甲基萘(1-MN)加氢饱和反应网络,四个加氢反应均为放热反应(用反应1、2、3、4表示)。下图(右)表示反应温度(T)对平衡时反应体系中有机化合物物质的量分数(x/%)的影响(6MPa,1-MN和 体积比为1∶5条件下)。下列说法
体积比为1∶5条件下)。下列说法不正确 的是
 体积比为1∶5条件下)。下列说法
体积比为1∶5条件下)。下列说法
| A.800K反应2和反应4生成1-MD的程度很小 |
| B.600K到800K,反应1的平衡常数逐渐减小 |
| C.700K反应1的平衡常数小于反应3的平衡常数 |
| D.600K到650K,反应2中5-MTL增加的量大于反应1中5-MTL减少的量 |
您最近半年使用:0次
名校
8 . 在容积不变的密闭容器中,充入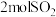 与
与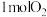 发生反应:
发生反应: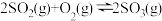 。温度分别为
。温度分别为 和
和 时,
时, 的体积分数随时间的变化如图所示。下列说法
的体积分数随时间的变化如图所示。下列说法不正确 的是
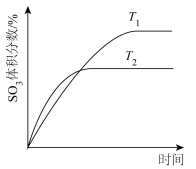
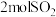 与
与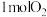 发生反应:
发生反应: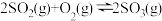 。温度分别为
。温度分别为 和
和 时,
时, 的体积分数随时间的变化如图所示。下列说法
的体积分数随时间的变化如图所示。下列说法
A.保持温度为 时,再充入 时,再充入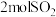 与 与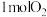 ,平衡常数不变 ,平衡常数不变 |
B.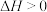 |
C.向平衡后的体系中充入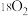 ,达到新平衡后, ,达到新平衡后,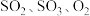 中均含 中均含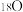 原子 原子 |
D.平衡后的体系中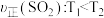 |
您最近半年使用:0次
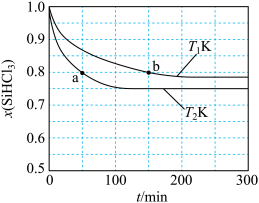
9 . 恒容条件下,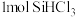 发生如下反应:
发生如下反应: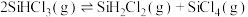 。已知:
。已知: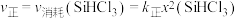 ,
,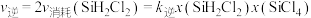 ,
,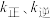 分别为正、逆向反应速率常数(仅与温度有关),
分别为正、逆向反应速率常数(仅与温度有关), 为物质的量分数。如图是不同温度下
为物质的量分数。如图是不同温度下 随时间的变化。下列说法不正确的是
随时间的变化。下列说法不正确的是
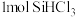 发生如下反应:
发生如下反应: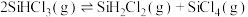 。已知:
。已知: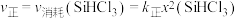 ,
,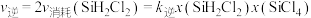 ,
,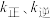 分别为正、逆向反应速率常数(仅与温度有关),
分别为正、逆向反应速率常数(仅与温度有关), 为物质的量分数。如图是不同温度下
为物质的量分数。如图是不同温度下 随时间的变化。下列说法不正确的是
随时间的变化。下列说法不正确的是
A.已知电负性: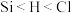 ,则 ,则 与水反应的方程式为: 与水反应的方程式为: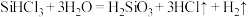 |
B.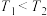 ,该反应 ,该反应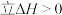 |
C.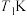 时平衡体系中再充入 时平衡体系中再充入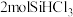 ,平衡正向移动, ,平衡正向移动,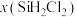 增大 增大 |
D.当反应进行到 处时, 处时, |
您最近半年使用:0次
名校
解题方法
10 . 反应
 ,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
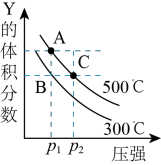

 ,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是
,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法错误的是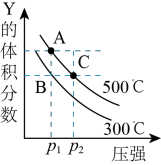
A.该反应的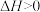 | B.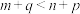 |
C.B、C两点化学平衡常数: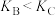 | D.A、C两点的反应速率 |
您最近半年使用:0次
2024-03-07更新
|
178次组卷
|
2卷引用:山西省吕梁市2023-2024学年高二上学期1月期末化学试题



