1 . 氨是化肥工业和化工生产的主要原料,工业合成氨使用的氢气主要来自合成气( ,
, 混合气体)。回答下列问题:
混合气体)。回答下列问题:
(1)合成氨的热化学方程式为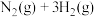


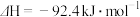 ,升高温度,合成氨反应的平衡常数
,升高温度,合成氨反应的平衡常数_______ (填“增大”“不变”或“减小”)。理论上,为了增大平衡时 的转化率,可采取的措施是
的转化率,可采取的措施是_____ (填字母)。
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物
(2)合成氨的原料 可通过反应
可通过反应

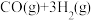
 来获取,已知该反应中,当初始混合气中的
来获取,已知该反应中,当初始混合气中的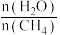 恒定时,温度、压强对平衡混合气中
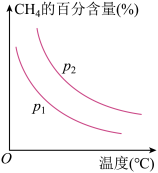
恒定时,温度、压强对平衡混合气中 的百分含量的影响如图所示:
的百分含量的影响如图所示:
图中两条曲线表示压强的关系是:
________  (填“>”“<”或“=”下同),
(填“>”“<”或“=”下同),
________ 0。
(3) 的另外一个反应为
的另外一个反应为

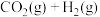
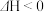 ,一定条件下,反应达到平衡后,采取
,一定条件下,反应达到平衡后,采取______________ 措施可提高 的转化率。
的转化率。
 ,
, 混合气体)。回答下列问题:
混合气体)。回答下列问题:(1)合成氨的热化学方程式为
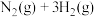


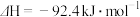 ,升高温度,合成氨反应的平衡常数
,升高温度,合成氨反应的平衡常数 的转化率,可采取的措施是
的转化率,可采取的措施是a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物
(2)合成氨的原料
 可通过反应
可通过反应

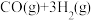
 来获取,已知该反应中,当初始混合气中的
来获取,已知该反应中,当初始混合气中的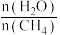 恒定时,温度、压强对平衡混合气中
恒定时,温度、压强对平衡混合气中 的百分含量的影响如图所示:
的百分含量的影响如图所示:图中两条曲线表示压强的关系是:

 (填“>”“<”或“=”下同),
(填“>”“<”或“=”下同),

(3)
 的另外一个反应为
的另外一个反应为

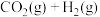
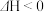 ,一定条件下,反应达到平衡后,采取
,一定条件下,反应达到平衡后,采取 的转化率。
的转化率。
您最近一年使用:0次
2 .
(1)Ⅰ.工业上利用 和
和 合成二甲醚的反应如下:
合成二甲醚的反应如下:
 。
。
温度升高,该化学平衡移动后达到新的平衡, 的产率将
的产率将__________ (填“变大”“变小”或“不变”,下同),混合气体的平均相对分子质量将__________ 。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应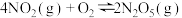
 的影响。
的影响。
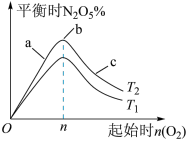
(2)图中 和
和 的关系是
的关系是
________ (填“>”“<”或“=”) 。
。
(3)比较a、b、c三点所处的平衡状态中,反应物 的转化率最大的是
的转化率最大的是__________ (填字母)。
(4)若容器体积为 ,
,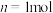 ,
, 的转化率为
的转化率为 ,则此条件下
,则此条件下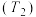 ,反应的平衡常数
,反应的平衡常数
___________ 。
(1)Ⅰ.工业上利用
 和
和 合成二甲醚的反应如下:
合成二甲醚的反应如下:
 。
。温度升高,该化学平衡移动后达到新的平衡,
 的产率将
的产率将Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应
 的影响。
的影响。
(2)图中
 和
和 的关系是
的关系是
 。
。(3)比较a、b、c三点所处的平衡状态中,反应物
 的转化率最大的是
的转化率最大的是(4)若容器体积为
 ,
,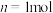 ,
, 的转化率为
的转化率为 ,则此条件下
,则此条件下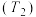 ,反应的平衡常数
,反应的平衡常数
您最近一年使用:0次
解题方法
3 . Ⅰ.在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g) 2Z(g),已知将2molX 和1molY充入该容器中,反应在绝热条件下达到平衡时,Z 的物质的量为pmol.回答下列问题:
2Z(g),已知将2molX 和1molY充入该容器中,反应在绝热条件下达到平衡时,Z 的物质的量为pmol.回答下列问题:
(1)若把2molX 和1molY 充入该容器时,处于状态I,达到平衡时处于状态II(如图),则该反应的熵变△S_____ 0(填:“<,>,=”).该反应在_____ (填:高温或低温)条件下能自发进行.
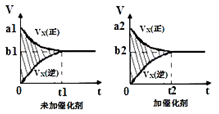
(2)该反应的v﹣t图象如图中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v﹣t图象如图中右图所示.以下说法正确的是____ .
①a1>a2②b1<b2③t1>t2④图中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图所示.下列说法正确的是_____ .
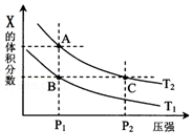
A.A、C 两点的反应速率:A>C
B.A、C 两点的气体密度:A<C
C.B、C 两点的气体的平均相对分子质量:B<C
D.由状态B 到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:CO(g)+H2O(g) CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是
CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是_____ .
A.2c1=c2=c3B.2Q1=Q2=Q3C.α1=α2=α3D.α1+α2=1
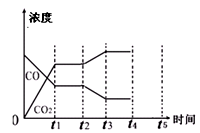
(5)图3表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是_____ (写出一种).
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)_____ .
 2Z(g),已知将2molX 和1molY充入该容器中,反应在绝热条件下达到平衡时,Z 的物质的量为pmol.回答下列问题:
2Z(g),已知将2molX 和1molY充入该容器中,反应在绝热条件下达到平衡时,Z 的物质的量为pmol.回答下列问题:(1)若把2molX 和1molY 充入该容器时,处于状态I,达到平衡时处于状态II(如图),则该反应的熵变△S

(2)该反应的v﹣t图象如图中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v﹣t图象如图中右图所示.以下说法正确的是
①a1>a2②b1<b2③t1>t2④图中阴影部分面积更大 ⑤两图中阴影部分面积相等

(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图所示.下列说法正确的是

A.A、C 两点的反应速率:A>C
B.A、C 两点的气体密度:A<C
C.B、C 两点的气体的平均相对分子质量:B<C
D.由状态B 到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:CO(g)+H2O(g)
 CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是
CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(5)图3表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)

您最近一年使用:0次
名校
4 . 汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是_____ 。(填选项序号字母)

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是_____ 。(填选项序号字母)
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g) 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g) 2NO(g)为
2NO(g)为_____ (填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=_____ 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_____ 。

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:_____ 。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=_____ 。若用标准状况下4.48 L CH4还原NO2至N2,共转移的电子总数为_____ (阿伏伽德罗常数的值用NA表示)。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g)
 2NO2(g),下列可判断反应达平衡的是
2NO2(g),下列可判断反应达平衡的是a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g)
 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,据此判断反应N2(g)+O2(g)
 2NO(g)为
2NO(g)为
②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=
您最近一年使用:0次
2018-01-25更新
|
1001次组卷
|
3卷引用:练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)
(已下线)练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题【全国百强校】四川省棠湖中学2019届高三二诊模拟理综-化学试题
2014高二·全国·专题练习
解题方法
5 . 可逆反应:aA(气)+bB(气)  cC(气)+dD(气) △H=Q,试根据图回答
cC(气)+dD(气) △H=Q,试根据图回答
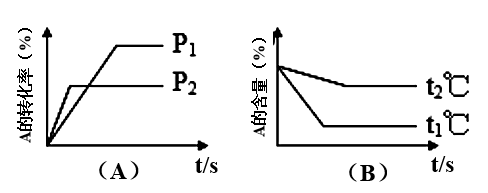
(1)压强P1比P2______ (填大、小)
(2)体积(a+b)比(c+d)____ (填大、小)
(3)温度t1℃比t2℃______ (填高、低)
(4)Q值是______ (填正、负)
 cC(气)+dD(气) △H=Q,试根据图回答
cC(气)+dD(气) △H=Q,试根据图回答
(1)压强P1比P2
(2)体积(a+b)比(c+d)
(3)温度t1℃比t2℃
(4)Q值是
您最近一年使用:0次
2018-01-01更新
|
256次组卷
|
4卷引用:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷
(已下线)2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷河北省唐山市滦县二中2017-2018学年高二期中考试化学(理)试卷甘肃省宁县第二中学2020-2021学年高二上学期期末考试化学试题福建省清流一中2017-2018学年高二上学期第二阶段(期中)考试化学(理)试题
名校
6 . 工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2(g) CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
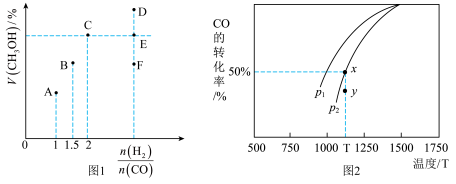
(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____ 。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______ (选填“增大”、“减小”或“不变”)。
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_____ 点(选填“D”、“E”或“F”)。
(3)由图2可知该反应的△H_____ 0(选填“>”、“<”或“=”,下同),压强pl____ p2;当压强为p2时,在y点:v(正)____ v(逆)。
CO (g) +2H2(g)
 CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
(3)由图2可知该反应的△H
您最近一年使用:0次
2017-10-22更新
|
622次组卷
|
6卷引用:河南省八市2017-2018学年高二上学期第一次质量检测化学试题



