名校
1 . 在容积一定的密闭容器中,可逆反应A(g)+B(g) xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
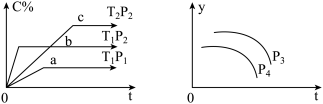
 xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
| A.p3>p4,y轴表示A的物质的量分数 |
| B.若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体 |
| C.p3<p4,y轴表示平衡常数K |
| D.p3>p4,y轴表示混合气体的平均摩尔质量 |
您最近一年使用:0次
2019-10-22更新
|
159次组卷
|
2卷引用:安徽省淮北市第一中学2023-2024学年高二(上)期末化学模拟试卷
名校
2 . 将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g) P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
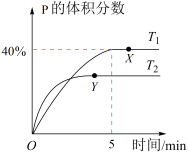
 P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
| A.若X、Y两点的平衡常数分别为K1、K2,则K1>K2 |
| B.温度为T1时,N的平衡转化率为80%,平衡常数K=40 |
| C.无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态 |
| D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率 |
您最近一年使用:0次
2019-10-13更新
|
612次组卷
|
15卷引用:安徽省黄山市屯溪第一中学2020-2021学年高二上学期期中考试化学试题
安徽省黄山市屯溪第一中学2020-2021学年高二上学期期中考试化学试题山东省日照市莒县第一中学2019-2020学年高三10月月考化学试卷2020届高考化学小题狂练(全国通用版)专练14 化学平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡状态的判断依据(强化练习)山东省日照市莒县2019-2020学年高二上学期期中考试化学试题(已下线)第02章 化学反应速率和化学平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.3化学平衡常数(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题(仁智班)四川省遂宁市第二中学2020-2021学年高二上学期期中考试化学试题山东省聊城市茌平区第二中学2020-2021学年高二上学期第二次月考化学试题山西省寿阳县第一中学2020—2021学年高二上学期第二次月考化学试题广东省东莞市第四高级中学2021-2022学年高三上学期期中考试化学试题天津市第二南开学校2021-2022学年高二上学期第三次月考化学试题天津市南仓中学2023-2024学年高二上学期12月月考化学试题
名校
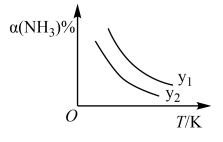
3 . 以 和
和 为原料可合成尿素
为原料可合成尿素 ,反应为:
,反应为: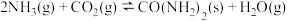 。达到平衡时,
。达到平衡时, 的转化率
的转化率 随温度变化的情况如下图。下列说法不正确的是( )
随温度变化的情况如下图。下列说法不正确的是( )
 和
和 为原料可合成尿素
为原料可合成尿素 ,反应为:
,反应为: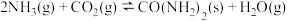 。达到平衡时,
。达到平衡时, 的转化率
的转化率 随温度变化的情况如下图。下列说法不正确的是( )
随温度变化的情况如下图。下列说法不正确的是( )
A.该反应的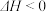 |
B.若y为压强,则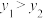 |
C.若y表示反应起始时的水碳比(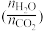 ,则 ,则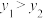 |
D.在恒温恒容(2L)的容器和绝热恒容(2L)容器中,分别加入 和 和 ,达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率 ,达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率 |
您最近一年使用:0次
2019-09-24更新
|
707次组卷
|
3卷引用:安徽省“江淮十校”2020届高三上学期第一次联考化学试题
14-15高二上·贵州遵义·期末
名校
解题方法
4 . 在一密闭容器中进行以下可逆反应:M(g)+N(g) P(g)+2L(?)。在不同的条件下P的体积分数φ(P)的变化情况如图,则该反应
P(g)+2L(?)。在不同的条件下P的体积分数φ(P)的变化情况如图,则该反应
 P(g)+2L(?)。在不同的条件下P的体积分数φ(P)的变化情况如图,则该反应
P(g)+2L(?)。在不同的条件下P的体积分数φ(P)的变化情况如图,则该反应
| A.正反应放热,L是固体 | B.正反应放热,L是气体 |
| C.正反应吸热,L是气体 | D.正反应放热,L是固体或气体 |
您最近一年使用:0次
2020-11-18更新
|
285次组卷
|
17卷引用:【校级联考】安徽省宿州市十三所重点中学2018-2019学年高二(理)上学期期中考试化学试题
【校级联考】安徽省宿州市十三所重点中学2018-2019学年高二(理)上学期期中考试化学试题(已下线)2013-2014学年贵州省遵义四中高二上学期期末考试化学试卷2014-2015河北枣强中学高二上学期期末考试化学试卷2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷2016-2017学年河北省卓越联盟高二上第一次月考化学试卷2016-2017学年甘肃省民乐一中高二上10月月考化学试卷江西省四校协作体2017-2018学年高二上学期期中联考化学试题【全国百强校】湖南省衡阳市第八中学2018-2019学年高二上学期六科联赛试题(12月)化学试题宁夏长庆高级中学2019-2020学年高二上学期期中考试化学试题山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题甘肃省武威市古浪县第二中学2019-2020学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 章末综合检测卷河北省保定市唐县第一中学20202-2021学年高二上学期第二次月考化学试卷题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题山东省潍坊市临朐县实验中学2021-2022学年高二上学期9月月考化学试题湖北省恩施利川市第五中学2019-2020学年高二上学期期中考试化学试题四川省巴中市第三中学2021-2022学年高二上学期期中考试化学试题
14-15高二上·甘肃天水·阶段练习
名校
解题方法
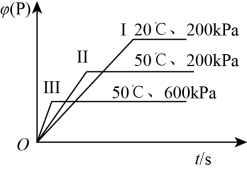
5 . 密闭容器中进行反应M(g)+N(g) R(g)+2L(?),R的体积分数φ随时间的变化情况如图所示。下列叙述正确的是
R(g)+2L(?),R的体积分数φ随时间的变化情况如图所示。下列叙述正确的是
 R(g)+2L(?),R的体积分数φ随时间的变化情况如图所示。下列叙述正确的是
R(g)+2L(?),R的体积分数φ随时间的变化情况如图所示。下列叙述正确的是
| A.正反应为吸热反应,L是气体 | B.正反应为吸热反应,L是固体或液体 |
| C.正反应为放热反应,L是气体 | D.正反应为放热反应,L是固体或液体 |
您最近一年使用:0次
2020-10-10更新
|
451次组卷
|
12卷引用:安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题
安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题(已下线)2014-2015学年甘肃天水市第一中学高二上第一阶段考试题化学试卷(已下线)2014-2015学年甘肃省庆阳一中高二第一学期期中考试化学试卷百所名校联考-化学反应速率与化学平衡甘肃省张掖市第二中学2019-2020学年高二上学期10月月考化学试题福建省莆田第一中学2019-2020学年高一下学期期中考试化学试题四川省简阳市阳安中学2020-2021学年高二上学期9月月考化学试题甘肃省庄浪县第一中学2020-2021学年高二上学期第二学段考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时4 化学平衡图象内蒙古呼伦贝尔市阿荣旗第一中学2020-2021学年高二上学期月考化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第二次月考化学试题
名校
6 . 根据下列图示所得出的结论正确的是( )
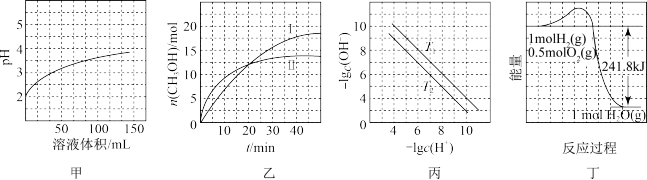

| A.图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸 |
B.图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ |
| C.图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2 |
| D.图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1 |
您最近一年使用:0次
2019-03-04更新
|
1120次组卷
|
6卷引用:安徽省合肥市肥东县高级中学2020届高三5月调研考试理科综合化学试题
11-12高二上·江西赣州·期中
名校
7 . 可逆反应mA(固)+nB(气)⇌pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
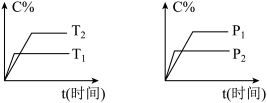

| A.达到平衡后,使用催化剂,C%将增大 |
| B.达到平衡后,若升高温度、化学平衡向逆反应方向移动 |
| C.方程式中n>p+q |
| D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
您最近一年使用:0次
2019-10-05更新
|
1847次组卷
|
39卷引用:安徽省六安市二中2018-2019学年高二第一学期10月月考化学试题
安徽省六安市二中2018-2019学年高二第一学期10月月考化学试题安徽省怀宁县第二中学2021-2022学年高二上学期期中考试化学试题(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2011-2012学年内蒙古包头三十三中高二上学期期末考试化学试卷(已下线)2012-2013学年黑龙江省集贤县第一中学高二上学期期末考试化学试卷(已下线)2014-2015学年吉林延边二中高二9月阶段考试化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷2014-2015学年内蒙古巴彦淖尔市一中高二上学期期中化学试卷2014-2015学年福建省晋江市季延中学高二下学期期中考试化学试卷2015-2016学年浙江台州中学高二上第三次统练化学试卷2016-2017学年河北省定州二中高二上学期第一次月考化学试卷2016-2017学年甘肃省嘉峪关市酒钢三中高二上学期期末考试化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷四川省泸州泸县第五中学2018届高三上学期期末考试理综化学试题吉林省吉林地区普通高中友好学校联合体2017-2018学年高二上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题【校级联考】广东省汕头市达濠华侨中学、东厦中学2018-2019学年高二(理)上学期阶段测试(二)化学试题甘肃省白银市会宁县第一中学2019-2020学年高二上学期期中考试化学(理)试题广东省广州市第八十九中学2019-2020学年高二上学期期中考试化学试题湖南省永州市宁远县第一中学2019-2020学年高二上学期期中考试化学试题福建省莆田四中2019-2020学年高二上学期期中考试化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题云南省曲靖市陆良县第十中学2019-2020学年高二上学期期末考试化学试题甘肃省兰州大学附属中学(33中)2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题湖北省恩施州巴东县第二高级中学2019-2020学年高一下学期网课质量检测化学试题江西省上饶市横峰中学2020-2021学年高二上学期第一次月考化学(统招班)试题甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 吉林省吉化第一高级中学校2020-2021学年高二上学期期末考试化学试题宁夏固原市隆德县2020-2021学年高二上学期期末考试化学试题湖南省湘潭电机子弟中学2019-2020学年高二下学期期中考试化学(理)试题河南省登封市第一高级中学2019-2020学年高二上学期期中考试化学试题广东省汕尾市2021-2022学年高一年级下学期期末考试化学试题云南省文山州广南县第二中学校2021-2022学年高二上学期12月考试化学试题广东省江门广雅中学2022-2023学年高二上学期期中考试化学试题浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题辽宁省名校联盟2023-2024学年高二上学期期初考试化学试题辽宁省锦州市黑山县名校联盟试2023-2024学年高二上学期开学考试化学试题黑龙江省虎林市高级中学2023-2024学年高二上学期第一次月考化学试题
2019·安徽·一模
8 . 已知图一表示的是可逆反应O2(g)+2SO2(g)⇌2SO3(g) ∆H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)⇌N2O4(g) ∆H<0的浓度(c)随时间t 的变化情况。下列说法中正确的是


| A.若图一t2时改变的条件是增大压强,则反应∆H的增大 |
| B.图一t2时改变的条件可能是升高了温度或增大了压强 |
| C.图二t1时改变的条件可能是增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
您最近一年使用:0次
9-10高二·福建厦门·期中
名校
解题方法
9 . 在一定温度不同压强(P1<P2)下,可逆反应2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是
 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系如图示,正确的是A.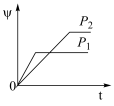 | B.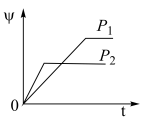 |
C.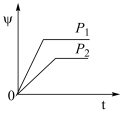 | D.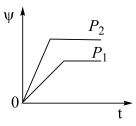 |
您最近一年使用:0次
2021-03-03更新
|
924次组卷
|
87卷引用:2011-2012学年安徽省六安市徐集中学高二上学期期末考试化学试卷
(已下线)2011-2012学年安徽省六安市徐集中学高二上学期期末考试化学试卷(已下线)2014秋安徽省淮北师范大学附属实验中学高二上学期期中化学试卷(已下线)2010年福建厦门理工学院附中高二化学期中阶段性测试试卷(已下线)吉林省长春外国语学校2010-2011学年高二第一次月考化学试题(已下线)2010年江西省德兴市四校联考高二上学期期中考试化学试卷(已下线)2010年青海省青海师大附中高二上学期期中考试化学试卷(已下线)2011-2012年山东省莒南县三中高二上学期期中考试化学试卷(已下线)2011-2012学年江西省新余九中高二上学期期中考试化学试卷(已下线)2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省牡丹江一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年甘肃兰州一中高二上学期期末考试化学试卷(已下线)2012-2013学年吉林省实验中学高二上学期期末考试化学试卷(已下线)2012年苏教版高中化学选修4 2.3化学平衡的移动练习卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年江苏省江都区丁沟中学高二下学期期中考试化学试卷2014-2015学年宁夏育才中学高二上学期期中化学试卷2014-2015湖南省益阳六中高二上学期期中考试化学(理)试卷2015-2016湖南省衡阳四中高二12月学科联赛化学试卷2015-2016湖南省衡阳县四中高二12月学科联赛化学试卷2015届北京市房山区高三4月模拟练习化学试卷2015-2016学年西藏日喀则中学高二上12月月考化学试卷2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷2015-2016学年黑龙江省海林林业局一中高二上期末考试化学试卷2015-2016学年广西南宁市八中高二下学期期中段考化学试卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2016-2017学年山东省德州市陵城一中高二上10月月考化学试卷2015-2016学年甘肃省白银市靖远一中高二上期中化学试卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷2016-2017学年山西省大同一中高二12月月考化学试卷2016-2017学年湖南省长沙一中高一上月考三化学试卷陕西省西安中学2016-2017学年高二(平行班)上学期期末考试化学试题2016-2017学年黑龙江省鸡西市第十九中学高二上学期期末考试化学试卷黑龙江省大庆市第十中学2016-2017学年高一下学期期末考试化学试题山西省朔州市第二中学2016-2017学年高一下学期期末考试化学试题广西桂林市2016-2017学年高二下学期期末质量检测化学试题山西省朔州市第一中学2017-2018学年高二8月月考化学试题吉林省汪清县第六中学2018届高三9月月考化学试题吉林省汪清县第六中学2017-2018学年高二9月月考化学试题甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题福建省莆田市第二十五中学2017-2018学年高二12月月考化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二上学期期中考试化学试题2甘肃省宁县二中2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第二章 章末知识测评(二)黑龙江省鸡西市第十九中学2018-2019学年高二(理)上学期期中考试化学试题【市级联考】吉林省公主岭市2018-2019学年高二上学期期末考试化学试题陕西省黄陵中学高新部2018-2019学年高一下学期期末考试化学试题河北省唐山市开滦第二中学2018-2019学年高二下学期期末考试化学试题黑龙江省大庆铁人中学2019-2020学年高二上学期入学考试化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题上海燎原双语学校2018-2019学年高三化学期中试题广东省潮州市潮安区颜锡祺中学2019-2020学年高二上学期期中考试化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二上学期期中考试化学试题吉林省辽源市田家炳高级中学2019-2020学年高二12月月考化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第二次月考化学试题宁夏贺兰县景博中学2019-2020学年高二上学期第一次月考化学试题吉林省长春外国语学校2019-2020学年高一下学期期末考试化学(理)试题河北省邢台市第七中学2019-2020学年高二上学期10月月考化学试题河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题四川省苍溪实验中学校2020-2021学年高二上学期期中质量检测化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题湖北省黄冈麻城市第二中学2021届高三上学期第一次质量检测化学试题湖南省新宁县崀山培英学校2020-2021学年高二上学期期中考试化学试题陕西省咸阳百灵中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw118福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题青海省北外附属西宁新华联国际学校2020-2021学年高二上学期期末考试化学试题海南省海南鑫源高级中学2019-2020学年高二上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期第一次月考化学试题山东省淄博市第七中学2019-2020学年高二上学期第一次月考化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期中考试化学(理)试题山西省侯马市第一中学校2021-2022年高二上学期期中测试化学试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题四川省泸州市泸县第一中学2021-2022学年高二下学期入学考试化学试题陕西省千阳中学2020-2021学年高二上学期期中化学(理科)试题上海市控江中学2022-2023学年高二上学期9月阶段测化学试题北京市第三十五中学2022-2023学年高二上学期10月月考化学试题海南省鑫源中学2021-2022学年高二上学期期中考试化学试题河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期期中考试化学试题福建省平潭翰英中学2021-2022学年高二上学期期中考试化学试题宁夏中卫市中宁县2022-2023学年高二上学期质量测查(期末)化学试题浙江省宁波效实中学2022-2023学年高一下学期期中考试化学(选考班)试题北京市北京医学院附属中学2022-2023学年高二上学期期中考试化学试题广东省东莞市东华高级中学2023-2024学年高二上学期期中联考化学试卷河北省百师联盟2023-2024学年高二上学期1月期末大联考化学试题河北省石家庄市赵县七县联考2023-2024学年高二上学期1月期末化学试题黑龙江省伊春市铁力市马永顺中学校2023-2024学年高二上学期期末考试化学试题
2010·河北保定·一模
名校
10 . 反应N2O4(g)⇌2NO2(g) ΔH=+57 kJ·mol-1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示,下列说法正确的是( )。
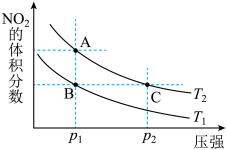

| A.A、C两点的反应速率:A>C |
| B.A、C两点气体的颜色:A深,C浅 |
| C.由状态B到状态A,可以用加热的方法 |
| D.若p2>p1,则化学平衡常数KA>KC |
您最近一年使用:0次
2020-10-07更新
|
437次组卷
|
33卷引用:2010-2011学年安徽省马鞍山市第二中学高二下学期期中素质测试化学试卷
(已下线)2010-2011学年安徽省马鞍山市第二中学高二下学期期中素质测试化学试卷(已下线)2010—2011学年安徽省马鞍山二中高二下学期期中考试化学试卷(理科)安徽省池州市第一中学2020-2021学年高二上学期期中考试化学试题(已下线)2010年河北省保定一中高三押题(理科综合)化学部分(已下线)09~10年江西四校高二下学期期中联考化学卷(已下线)2010年广东省执信中学高二上学期期中考试化学卷(已下线)2010—2011学年浙江省杭州二中高二下二学期期中考试化学试卷(已下线)2012-2013学年甘肃省兰州一中高二上学期期末考试化学试卷2015届吉林省东北师大附中高三上学期第三次摸底化学试卷2014-2015学年四川眉山市高二第四学期期末教学质量检测化学试卷2015-2016学年广西钦州市钦南区高二上学期期中测试化学试卷2015-2016学年湖北荆州中学高二上期中测试化学试卷2016届河南省三门峡市陕州中学高三下尖子生专题训练(三)理综化学试卷2016届天津市红桥区重点中学高三下学期八校联考化学试卷2016-2017学年河北冀州市中学高二上开学调研化学卷2016-2017学年黑龙江大庆一中高二上10月月考化学卷山东省新泰二中、泰安三中、宁阳二中2017-2018学年高二上学期期中联考化学试卷四川省成都外国语学校2017-2018学年高二上学期期中考试化学试题陕西省西安市远东第一中学2018-2019学年高二上学期期中考试化学试题江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题浙江省宁波市余姚中学2018-2019学年高二上学期期中考试化学试题河北省承德第一中学2019-2020学年高二上学期开学考试化学试题河北省张家口第一中学2019-2020学年高二9月月考化学试题陕西省榆林市绥德县绥德中学2019-2020学年高二下学期第二次阶段性测试化学试题广东省广州大学附属中学2019-2020学年高一下学期期末考试化学试题江西省南昌市第十中学2019-2020学年高二上学期第一次月考化学试题广东省广州大学附属中学等三校2019~2020学年高一下学期期末联考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期9月月考化学试题浙江平湖杭州湾实验学校2020-2021学年高二上学期第一次月考化学试题江西省南昌市第二中学2020-2021学年高二上学期第一次月考化学试题江西省南昌市八一中学2020-2021学年高二上学期10月考试化学试题江西省贵溪市实验中学2020-2021学高二上学期期中考试化学试题天津市滨海新区大港油田第三中学2020-2021学年高二上学期期中考试化学试题



