1 . 锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 和
和 杂质离子,可在0~14范围内调节
杂质离子,可在0~14范围内调节 对其净化(即相关离子浓度
对其净化(即相关离子浓度 )。
)。 时,
时,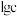 与
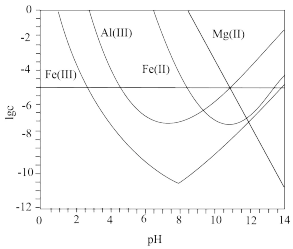
与 关系见下图(碱性过强时
关系见下图(碱性过强时 和
和 会部分溶解)。下列说法正确的是
会部分溶解)。下列说法正确的是
 和
和 杂质离子,可在0~14范围内调节
杂质离子,可在0~14范围内调节 对其净化(即相关离子浓度
对其净化(即相关离子浓度 )。
)。 时,
时,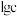 与
与 关系见下图(碱性过强时
关系见下图(碱性过强时 和
和 会部分溶解)。下列说法正确的是
会部分溶解)。下列说法正确的是
A. 可被净化的 可被净化的 区间最大 区间最大 |
B.加入适量 ,可进一步提升净化程度 ,可进一步提升净化程度 |
C.净化的先后顺序: |
D.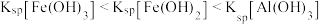 |
您最近一年使用:0次
2 . 四钼酸铵是钼深加工的重要中间产品具有广泛的用途。一种以钼精矿(主要含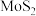 ,还有
,还有 、
、 的化合物及
的化合物及 等)为原料制备四钼酸铵的工艺流程如下图所示。
等)为原料制备四钼酸铵的工艺流程如下图所示。

回答下列问题:
(1)“焙烧”产生的气体用_______ 吸收后可制取氮肥。
(2)“浸出”时,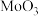 转化为
转化为 。提高单位时间内钼浸出率的措施有
。提高单位时间内钼浸出率的措施有_______ (任写两种)。温度对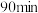 内钼浸出率的影响如图所示。当浸出温度超过
内钼浸出率的影响如图所示。当浸出温度超过 后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致_______ 。

(3)“净化”时,浸出液中残留的 、
、 转化为沉淀除去。研究表明,该溶液中
转化为沉淀除去。研究表明,该溶液中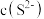 和pH的关系为:
和pH的关系为: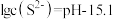 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于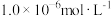 ,应控制溶液的pH不小于
,应控制溶液的pH不小于_______ 。(已知: ;
; 和
和 的
的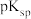 分别为35.2和17.2)
分别为35.2和17.2)
(4)“净化”后,溶液中若有低价钼(以 表示),可加入适量
表示),可加入适量 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(5)“沉淀”时,加入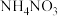 的目的是
的目的是_______ 。
(6)高温下用 还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为
还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为_______ 。【已知:(NH4)2Mo4O13受热分解生成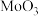 】
】
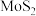 ,还有
,还有 、
、 的化合物及
的化合物及 等)为原料制备四钼酸铵的工艺流程如下图所示。
等)为原料制备四钼酸铵的工艺流程如下图所示。
回答下列问题:
(1)“焙烧”产生的气体用
(2)“浸出”时,
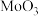 转化为
转化为 。提高单位时间内钼浸出率的措施有
。提高单位时间内钼浸出率的措施有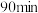 内钼浸出率的影响如图所示。当浸出温度超过
内钼浸出率的影响如图所示。当浸出温度超过 后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
(3)“净化”时,浸出液中残留的
 、
、 转化为沉淀除去。研究表明,该溶液中
转化为沉淀除去。研究表明,该溶液中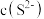 和pH的关系为:
和pH的关系为: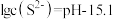 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于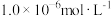 ,应控制溶液的pH不小于
,应控制溶液的pH不小于 ;
; 和
和 的
的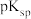 分别为35.2和17.2)
分别为35.2和17.2)(4)“净化”后,溶液中若有低价钼(以
 表示),可加入适量
表示),可加入适量 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)“沉淀”时,加入
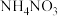 的目的是
的目的是(6)高温下用
 还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为
还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为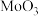 】
】
您最近一年使用:0次
2021-11-09更新
|
8146次组卷
|
12卷引用:2021年新高考福建化学高考真题
2021年新高考福建化学高考真题(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题山东省东营市第一中学2021-2022学年高二上学期期中考试化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第55练 无机化工流程题的解题策略(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题
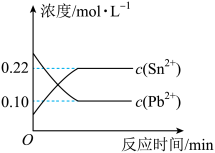
3 . 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(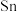 ),发生反应:
),发生反应: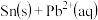

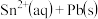 ,体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
,体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
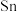 ),发生反应:
),发生反应: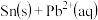

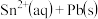 ,体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
,体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
| A.往平衡体系中加入少量金属铅后,c(Pb2+)增大 |
B.往平衡体系中加入少量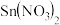 固体后,c(Sn2+)变小 固体后,c(Sn2+)变小 |
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应 |
| D.25℃时,该反应的平衡常数K=2.2 |
您最近一年使用:0次
2019-01-30更新
|
885次组卷
|
5卷引用:2011年普通高等学校招生全国统一考试化学卷(福建)
2011年普通高等学校招生全国统一考试化学卷(福建)山东省临沂市罗庄区2019-2020学年高二上学期期末考试化学试题湖南省长沙市雅礼中学2019-2020学年高二上学期期末考试化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)河南省信阳高级中学2021-2022学年高二下学期4月月考化学试题
真题
解题方法
4 . 四氧化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成为是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是___________________ 。
(2)在② ③工艺过程中需要控制条件以形成TiO2·nH2O,该分散系的分散质颗粒直径大大小在
③工艺过程中需要控制条件以形成TiO2·nH2O,该分散系的分散质颗粒直径大大小在___________ 范围。
(3)若把③中制得得固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可以制得钛白粉。已知25°C时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=
Fe3++3H2O的平衡常数K=____________ 。
(4)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g) △H=+140kJ/mol
2C(s)+O2(g)═2CO(g) △H=-221kJ/mol
写出④中TiO2和焦炭、氧气反应生成TiCl4和CO气体的热化学方程式:___________ 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_________ (只要求写出一项)。
(6)依据如表信息,要精制含少量SiCl4杂质的TiCl4,可采用___________ 方法。

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是
(2)在②
 ③工艺过程中需要控制条件以形成TiO2·nH2O,该分散系的分散质颗粒直径大大小在
③工艺过程中需要控制条件以形成TiO2·nH2O,该分散系的分散质颗粒直径大大小在(3)若把③中制得得固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可以制得钛白粉。已知25°C时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+
 Fe3++3H2O的平衡常数K=
Fe3++3H2O的平衡常数K=(4)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g) △H=+140kJ/mol
2C(s)+O2(g)═2CO(g) △H=-221kJ/mol
写出④中TiO2和焦炭、氧气反应生成TiCl4和CO气体的热化学方程式:
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是
(6)依据如表信息,要精制含少量SiCl4杂质的TiCl4,可采用
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
您最近一年使用:0次
5 . 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的________ (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是___________ 【已知:Ksp(BaSO4)= 1.1 ×10-10 Ksp(BaCO3)= 5.1 ×10-9】
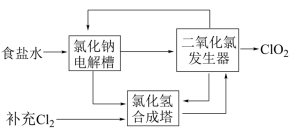
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有____________ (填化学式),发生器中生成ClO2的化学方程式为___________ 。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□_________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的_______ 倍
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。其次除杂操作时,往粗盐水中先加入过量的

②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
□ (D) +24NaClO3+12H2SO4=□ClO2↑+□CO2↑+18H2O+□
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量得电镀废水,所需Cl2的物质的量是ClO2的
您最近一年使用:0次
2016-12-09更新
|
1350次组卷
|
3卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷)(已下线)练习9 电解池-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题
真题
名校
6 . 从铝土矿(主要成分是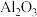 ,含
,含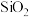 、
、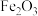 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
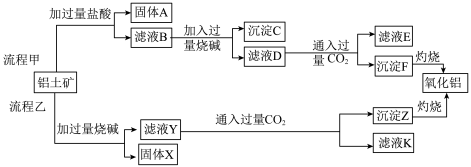
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________ .
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________ .
(3)验证滤液B含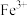 ,可取少量滤液并加入
,可取少量滤液并加入________ (填试剂名称)。
(4)滤液E、K中溶质的主要成分是________ (填化学式),写出该溶液的一种用途________
(5)已知298K时, 的容度积常数
的容度积常数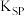 =5.6×
=5.6×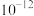 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的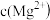 =
=_______ .
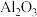 ,含
,含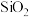 、
、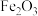 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为
(2)流程乙加入烧碱后生成SiO32-的离子方程式为
(3)验证滤液B含
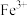 ,可取少量滤液并加入
,可取少量滤液并加入(4)滤液E、K中溶质的主要成分是
(5)已知298K时,
 的容度积常数
的容度积常数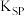 =5.6×
=5.6×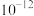 ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的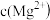 =
=
您最近一年使用:0次
2016-12-09更新
|
232次组卷
|
10卷引用:2009年普通高等学校招生统一考试理综试题化学部分(福建卷)
2009年普通高等学校招生统一考试理综试题化学部分(福建卷)2009高考真题汇编-无机综合题(已下线)2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(已下线)2015届江西省南昌市八一中学高三8月月考化学试卷2015届山东省邹城市第一中学高三4月高考模拟理综化学试卷广东省惠州市惠东中学2019届高三上学期第一次月考化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)2020届高中化学第一轮复习第十三章《化学与技术》测试卷贵州省锦屏中学2019-2020学年高二上学期期末考试化学试题甘肃省会宁县第一中学2021届高三上学期第三次月考化学试题
真题
7 . 研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。
[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。
[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
您最近一年使用:0次
2015-06-24更新
|
1589次组卷
|
2卷引用:2015年全国普通高等学校招生统一考试化学(福建卷)



