名校
1 . 化学上常用 表示溶液中的
表示溶液中的 。25℃时,用0.100
。25℃时,用0.100 的
的 溶液滴定20.00
溶液滴定20.00 0.100
0.100 的
的 溶液,
溶液, 与所加
与所加 溶液的体积V的关系如图所示,下列说法正确的是
溶液的体积V的关系如图所示,下列说法正确的是

 表示溶液中的
表示溶液中的 。25℃时,用0.100
。25℃时,用0.100 的
的 溶液滴定20.00
溶液滴定20.00 0.100
0.100 的
的 溶液,
溶液, 与所加
与所加 溶液的体积V的关系如图所示,下列说法正确的是
溶液的体积V的关系如图所示,下列说法正确的是
A.D点溶液的 |
| B.C点之前溶液显碱性,C点之后溶液显酸性 |
C.C点时,加入 溶液的体积为20 溶液的体积为20 |
D.25℃时, 的电离常数 的电离常数 |
您最近一年使用:0次
2022-11-12更新
|
368次组卷
|
3卷引用:湖北省宜城一中、枣阳一中等六校联考2022-2023学年高二上学期期中考试化学试题
解题方法
2 . 按要求填空:
(1)某些共价化合物(如 等)在液态时会发生微弱的电离,如
等)在液态时会发生微弱的电离,如 ,则液态
,则液态 的电离方程式为
的电离方程式为_______ 。
(2)已知水溶液中 和
和 的关系如图所示,试回答下列问题:
的关系如图所示,试回答下列问题:

图中A点和B点对应的 的关系是
的关系是_______ 。若从A点到D点,可采用的措施是_______ (填序号)。
A.升温 B.加入少量氯化钠溶液 C.加入少量的 D.加入少量的盐酸
D.加入少量的盐酸
(3)25℃时, 的
的 溶液中
溶液中 。请回答下列问题:
。请回答下列问题:
① 是
是_______ (填“强电解质”或“弱电解质”)。
②在加水稀释 溶液的过程中,随着水量的增加而增大的是
溶液的过程中,随着水量的增加而增大的是_______ (填序号)。
A. B.溶液的
B.溶液的 C.
C. 与
与 的乘积 D.
的乘积 D.
③100℃时, 的氢氧化钠和
的氢氧化钠和 的盐酸溶液等体积混合,混合后溶液呈
的盐酸溶液等体积混合,混合后溶液呈_______ (填“酸性”“中性”或“碱性”)。
(4)现有浓度均为 的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的
的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是_______ (用序号表示)。
(5)浓度均为 的5种溶液:①氨水、②
的5种溶液:①氨水、② 、③
、③ 、④
、④ 、⑤
、⑤ ,其中
,其中 由大到小的顺序为
由大到小的顺序为_______ (用序号表示)。
(6)已知25℃时, 。在
。在 时,向浓度均为
时,向浓度均为 的
的 和
和 混合溶液中逐滴加入氨水,先生成
混合溶液中逐滴加入氨水,先生成_______ 沉淀(填化学式),生成该沉淀的离子方程式为_______ 。
(7)已知25℃时, ,该温度下反应
,该温度下反应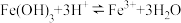 的平衡常数
的平衡常数
_______ 。
(1)某些共价化合物(如
 等)在液态时会发生微弱的电离,如
等)在液态时会发生微弱的电离,如 ,则液态
,则液态 的电离方程式为
的电离方程式为(2)已知水溶液中
 和
和 的关系如图所示,试回答下列问题:
的关系如图所示,试回答下列问题:
图中A点和B点对应的
 的关系是
的关系是A.升温 B.加入少量氯化钠溶液 C.加入少量的
 D.加入少量的盐酸
D.加入少量的盐酸(3)25℃时,
 的
的 溶液中
溶液中 。请回答下列问题:
。请回答下列问题:①
 是
是②在加水稀释
 溶液的过程中,随着水量的增加而增大的是
溶液的过程中,随着水量的增加而增大的是A.
 B.溶液的
B.溶液的 C.
C. 与
与 的乘积 D.
的乘积 D.
③100℃时,
 的氢氧化钠和
的氢氧化钠和 的盐酸溶液等体积混合,混合后溶液呈
的盐酸溶液等体积混合,混合后溶液呈(4)现有浓度均为
 的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的
的下列溶液:①硫酸、②醋酸、③氢氧化钠,三种溶液中由水电离出的 浓度由大到小的顺序是
浓度由大到小的顺序是(5)浓度均为
 的5种溶液:①氨水、②
的5种溶液:①氨水、② 、③
、③ 、④
、④ 、⑤
、⑤ ,其中
,其中 由大到小的顺序为
由大到小的顺序为(6)已知25℃时,
 。在
。在 时,向浓度均为
时,向浓度均为 的
的 和
和 混合溶液中逐滴加入氨水,先生成
混合溶液中逐滴加入氨水,先生成(7)已知25℃时,
 ,该温度下反应
,该温度下反应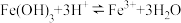 的平衡常数
的平衡常数
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1)某温度时,测得0.01 的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=
的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=_______ 该温度(填“>”“<”或“=”)_______ 25℃。
(2)在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=_______ 。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=_______ 。
(3)该温度下, 的溶液呈
的溶液呈_______ (填“酸性”、“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的
_______  。
。
(1)某温度时,测得0.01
 的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=
的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=(2)在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=
(3)该温度下,
 的溶液呈
的溶液呈
 。
。
您最近一年使用:0次
名校
4 . 化学上常用AG表示溶液中的 。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
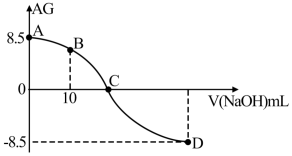
 。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol/L的NaOH溶液滴定20.00mL0.100mol/L的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
| A.HNO2为一元弱酸 |
B.D点溶液的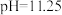 |
| C.C点之前溶液显碱性,C点之后溶液显酸性 |
D.25℃时,HNO2的电离常数 |
您最近一年使用:0次
5 . 化学上常用AG表示溶液中的lg ,25℃时,用0.100mol•L﹣1的NaOH溶液滴定20.00mL 0.100mol•L﹣1的HNO2溶液,AG与所加NaOH溶液的体积V的关系如图所示,下列说法正确的是
,25℃时,用0.100mol•L﹣1的NaOH溶液滴定20.00mL 0.100mol•L﹣1的HNO2溶液,AG与所加NaOH溶液的体积V的关系如图所示,下列说法正确的是

 ,25℃时,用0.100mol•L﹣1的NaOH溶液滴定20.00mL 0.100mol•L﹣1的HNO2溶液,AG与所加NaOH溶液的体积V的关系如图所示,下列说法正确的是
,25℃时,用0.100mol•L﹣1的NaOH溶液滴定20.00mL 0.100mol•L﹣1的HNO2溶液,AG与所加NaOH溶液的体积V的关系如图所示,下列说法正确的是
| A.D点溶液的pH=11.25 |
| B.C点之前溶液显碱性,C点之后溶液显酸性 |
| C.C点时,加入NaOH溶液的体积为20 mL |
| D.25℃时,HNO2的电离常数Ka=1.0×10﹣4.5 |
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)某温度(t℃)时,水的电离图象如下图所示,a点水的离子积Kw=_____ 该温度下,pH=11的NaOH溶液与pH=2的H2SO4溶液等体积混合,溶液显_____ (填“酸”或“碱”)性。

(2)25℃时,向0.1mol•L-1的氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH_____ (填“增大”“减小”或“不变”,下同), 的物质的量浓度
的物质的量浓度_____
(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显_____ (填“酸性”“碱性”或“中性”),则混合前c(NaOH)_____ (填“>”“<”或“=”)c(CH3COOH)
(4)常温下,Ksp[Fe(OH)3]=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5mol•L-1],则溶液的pH应大于_____
(5)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程中会发生反应:CaSO4(s)+ (ag)⇌CaCO3(s)+
(ag)⇌CaCO3(s)+ (aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_____ (计算结果保留三位有效数字)。
(1)某温度(t℃)时,水的电离图象如下图所示,a点水的离子积Kw=

(2)25℃时,向0.1mol•L-1的氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH
 的物质的量浓度
的物质的量浓度(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显
(4)常温下,Ksp[Fe(OH)3]=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5mol•L-1],则溶液的pH应大于
(5)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程中会发生反应:CaSO4(s)+
 (ag)⇌CaCO3(s)+
(ag)⇌CaCO3(s)+ (aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
您最近一年使用:0次
2020-07-11更新
|
185次组卷
|
4卷引用:湖北省黄冈市麻城市第二中学2021-2022学年高二上学期期中考试化学试题
湖北省黄冈市麻城市第二中学2021-2022学年高二上学期期中考试化学试题河北省石家庄市元氏县第四中学2019-2020学年高二上学期期末考试化学试题(已下线)第19讲 水的电离和溶液的酸碱性-2021年高考化学一轮复习名师精讲练内蒙古兴安盟乌兰浩特市第一中学2022-2023学年高二上学期期中考试化学试题
解题方法
7 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。
H++A2-。
(1)Na2A溶液显____ (填“酸性、中性、或碱性”),理由是(用离子方程式表示):_______ 。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中(H+)_____ (填“<”“>”或“=”)0.11mol/L,理由是____________ 。
(3)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为______________ 。
(4)某温度下,纯水中的c(H+)=4.0×10-7mol/L,若温度不变,滴入稀NaOH溶液,使c(OH-)=5.0×10-6moL/L,则溶液的c(H+)=______ mol/L;pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa 溶液的pH_____ NaOH溶液的pH(填“>”“=”或“<”);
II.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:

(5)若处理后的废水中残留的c(Fe3+)=4.0×10-13mol/L,则残留的Cr3+的浓度为____ mo/L(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-33)。
I.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
 H++A2-。
H++A2-。(1)Na2A溶液显
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中(H+)
(3)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为
(4)某温度下,纯水中的c(H+)=4.0×10-7mol/L,若温度不变,滴入稀NaOH溶液,使c(OH-)=5.0×10-6moL/L,则溶液的c(H+)=
II.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:

(5)若处理后的废水中残留的c(Fe3+)=4.0×10-13mol/L,则残留的Cr3+的浓度为
您最近一年使用:0次



