解题方法
1 . 常温下,分别在 溶液中滴加
溶液中滴加 溶液,溶液
溶液,溶液 代表
代表 ]与
]与 关系如图所示。已知:
关系如图所示。已知: 。
。
 溶液中滴加
溶液中滴加 溶液,溶液
溶液,溶液 代表
代表 ]与
]与 关系如图所示。已知:
关系如图所示。已知: 。
。
A.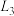 代表 代表 代表 代表 |
B. 的数量级为 的数量级为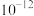 |
C.若在同溶液中产生这两种沉淀时, |
D. 的平衡常数 的平衡常数 |
您最近一年使用:0次
名校
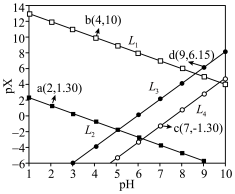
2 . 已知室温时: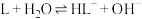
 。化合物L与
。化合物L与 形成配合物(
形成配合物(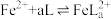 ),
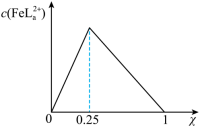
),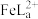 的浓度随
的浓度随 的投料百分比的变化如图所示(
的投料百分比的变化如图所示(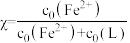 ,
, 表示初始浓度)。
表示初始浓度)。
下列说法错误的是
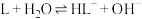
 。化合物L与
。化合物L与 形成配合物(
形成配合物(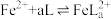 ),
),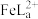 的浓度随
的浓度随 的投料百分比的变化如图所示(
的投料百分比的变化如图所示(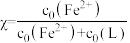 ,
, 表示初始浓度)。
表示初始浓度)。下列说法错误的是
A.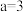 |
B.25℃时, 的L溶液pH≈5 的L溶液pH≈5 |
C.增大pH有利于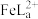 的生成 的生成 |
D.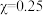 的溶液中, 的溶液中,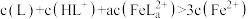 |
您最近一年使用:0次
3 . 用0.1 NaOH标准溶液滴定20mL等浓度的三元酸
NaOH标准溶液滴定20mL等浓度的三元酸 ,得到pH与
,得到pH与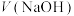 、
、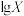 [
[ 或
或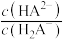 或
或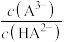 ]的关系分别如图1、图2所示。
]的关系分别如图1、图2所示。
 NaOH标准溶液滴定20mL等浓度的三元酸
NaOH标准溶液滴定20mL等浓度的三元酸 ,得到pH与
,得到pH与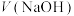 、
、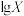 [
[ 或
或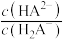 或
或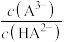 ]的关系分别如图1、图2所示。
]的关系分别如图1、图2所示。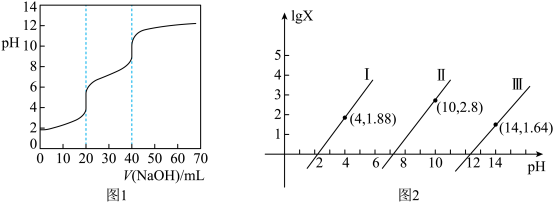
A.当加入20mL NaOH溶液时,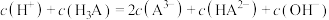 |
B.当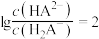 时,水电离出的 时,水电离出的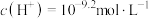 |
C.当加入40mL NaOH溶液时, |
D.当pH=11时,溶液中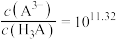 |
您最近一年使用:0次
2024-05-25更新
|
390次组卷
|
3卷引用:山东省潍坊市2024届高三下学期二模化学试题
4 . 常温下,0.10 mol/L HCOONH4溶液中部分微粒( 、
、 、HCOOH、
、HCOOH、 )的
)的 (可通入加入NaOH或HCl调节溶液pH)关系如图所示。
(可通入加入NaOH或HCl调节溶液pH)关系如图所示。 ,
,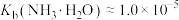 。下列说法正确的是
。下列说法正确的是


 、
、 、HCOOH、
、HCOOH、 )的
)的 (可通入加入NaOH或HCl调节溶液pH)关系如图所示。
(可通入加入NaOH或HCl调节溶液pH)关系如图所示。 ,
,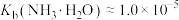 。下列说法正确的是
。下列说法正确的是

A.曲线②和③分别表示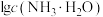 和 和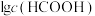 随pH的变化 随pH的变化 |
| B.溶液中M点对应的pH=7 |
C.HCOONH4的水解平衡常数 约为 约为 |
D.原溶液中 |
您最近一年使用:0次
2024-02-25更新
|
146次组卷
|
2卷引用:湖北省新高考协作体2023-2024学年高三下学期2月收心考试化学试题
5 . 某同学模拟工业废水变废为宝,设计了用沉淀法回收各金属阳离子的实验方案:

已知:
①溶液中某离子浓度小于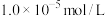 ,可认为该离子不存在;
,可认为该离子不存在;
②实验过程中,假设溶液体积、温度不变;
③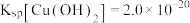 ;
;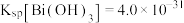 ;
;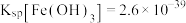 ;
; 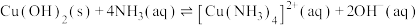

下列说法不正确的是

| 模拟工业废水的离子浓度(mol/l) |  |  |  |  |  |
| 0.10 | 0.010 | 0.0040 | 0.0010 | 0.141 |
①溶液中某离子浓度小于
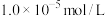 ,可认为该离子不存在;
,可认为该离子不存在;②实验过程中,假设溶液体积、温度不变;
③
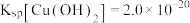 ;
;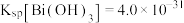 ;
;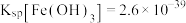 ;
; 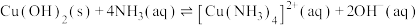

下列说法不正确的是
A.步骤I中加入的 |
B.步骤II得到的滤液N中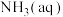 的浓度 的浓度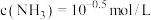 |
C.步骤III得到的沉淀Z为 |
D.反应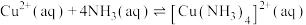 的平衡常数 的平衡常数 |
您最近一年使用:0次
2023-05-31更新
|
460次组卷
|
3卷引用:浙江省重点中学拔尖学生培养联盟2023届高三下学期6月适应性考试化学试题
浙江省重点中学拔尖学生培养联盟2023届高三下学期6月适应性考试化学试题江西省智学联盟体2023-2024学年高三上学期第一次联考化学试题 (已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
6 . 向 的
的 溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中
溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如图a所示;向
)与溶液pH的关系如图a所示;向 的草酸钠溶液中逐滴滴加等浓度的
的草酸钠溶液中逐滴滴加等浓度的 溶液,形成的
溶液,形成的 与
与 变化如图b所示。下列有关说法中
变化如图b所示。下列有关说法中错误 的是(已知 )
)

 的
的 溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中
溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如图a所示;向
)与溶液pH的关系如图a所示;向 的草酸钠溶液中逐滴滴加等浓度的
的草酸钠溶液中逐滴滴加等浓度的 溶液,形成的
溶液,形成的 与
与 变化如图b所示。下列有关说法中
变化如图b所示。下列有关说法中 )
)
A.图b中当溶液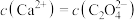 时, 时,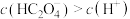 |
B.向 草酸钠溶液中加入等体积 草酸钠溶液中加入等体积 溶液后,溶液中 溶液后,溶液中 为 为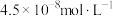 |
C. 的 的 溶液的pH>2.5 溶液的pH>2.5 |
D.向 的 的 溶液中逐滴滴加等浓度的 溶液中逐滴滴加等浓度的 溶液,所得溶液中 溶液,所得溶液中 、 、 、 、 三种微粒的物质的量分数( 三种微粒的物质的量分数( )与溶液pH的关系与图a相同 )与溶液pH的关系与图a相同 |
您最近一年使用:0次
7 . 工业以钒铁精矿(主要成为 ,还含有少量
,还含有少量 、
、 )为主要原料制备
)为主要原料制备 的工艺流程如图所示。
的工艺流程如图所示。
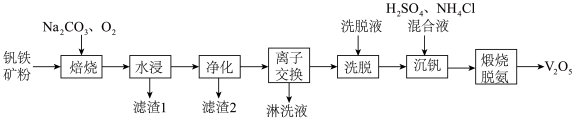
回答下列问题:
(1) 中V的化合价为
中V的化合价为_______ ,V在周期表的位置为_______ 。
(2)“焙烧”的目的是将 转化为可溶性的
转化为可溶性的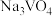 并将Al、Si的氧化物转化为可溶性钠盐,“焙烧”过程中生成
并将Al、Si的氧化物转化为可溶性钠盐,“焙烧”过程中生成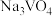 的化学反应方程式为
的化学反应方程式为_______ 。
(3)“滤渣1”的化学式为_______ ,“净化”除去的阴离子有 、
、 和
和_______ 。
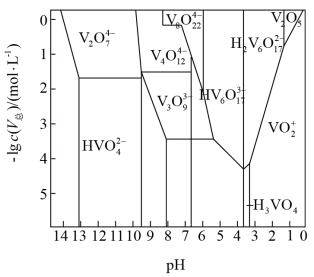
(4)“离子交换”和“洗脱”可以表示为: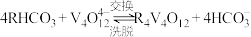 。常温下,各种形态五价钒粒子总浓度的负对数
。常温下,各种形态五价钒粒子总浓度的负对数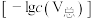 与pH关系如图所示。已知净化液中
与pH关系如图所示。已知净化液中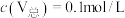 ,则“离子交换”前还应调节pH的范围为
,则“离子交换”前还应调节pH的范围为_______ ,淋洗液中的阳离子主要是_______
(5)“沉钒”过程过滤得到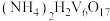 ,则沉钒反应的离子方程式为
,则沉钒反应的离子方程式为_______ 。
 ,还含有少量
,还含有少量 、
、 )为主要原料制备
)为主要原料制备 的工艺流程如图所示。
的工艺流程如图所示。
回答下列问题:
(1)
 中V的化合价为
中V的化合价为(2)“焙烧”的目的是将
 转化为可溶性的
转化为可溶性的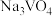 并将Al、Si的氧化物转化为可溶性钠盐,“焙烧”过程中生成
并将Al、Si的氧化物转化为可溶性钠盐,“焙烧”过程中生成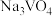 的化学反应方程式为
的化学反应方程式为(3)“滤渣1”的化学式为
 、
、 和
和(4)“离子交换”和“洗脱”可以表示为:
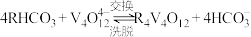 。常温下,各种形态五价钒粒子总浓度的负对数
。常温下,各种形态五价钒粒子总浓度的负对数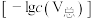 与pH关系如图所示。已知净化液中
与pH关系如图所示。已知净化液中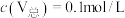 ,则“离子交换”前还应调节pH的范围为
,则“离子交换”前还应调节pH的范围为
(5)“沉钒”过程过滤得到
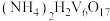 ,则沉钒反应的离子方程式为
,则沉钒反应的离子方程式为
您最近一年使用:0次
2022-05-19更新
|
317次组卷
|
2卷引用:湖北省武汉市武昌区2022届高三5月质量检测化学试题
名校
8 . As2S3可转化为用于治疗白血病的亚砷酸。向一定浓度的亚砷酸溶液中逐滴滴入NaOH溶液,含砷元素微粒的物质的量分数与溶液pH的关系如图所示。下列表述正确的是


A.当pH调至11时,所发生的反应为:H3AsO3+2OH-=HAsO +2H2O +2H2O |
B.P点,pH= |
C.N点: |
D.Q点:c(Na+)>2c(HAsO )+4c(AsO )+4c(AsO ) ) |
您最近一年使用:0次
2022-01-24更新
|
226次组卷
|
2卷引用:山东省青岛市2021-2022学年高三上学期教学质量检测化学试题
名校
9 . 常温下,向20mL0.1mol·L-1的CH3COOH溶液中逐滴加入等浓度的NH3·H2O,溶液的pH和溶液中水电离出c(H+)的pH水与滴加NH3·H2O的体积关系如图所示[pH曲线只画了一部分,已知Ka(CH3COOH)=Kb(NH3·H2O)]。
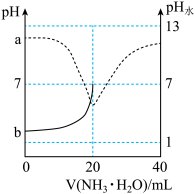
下列说法中正确的是

下列说法中正确的是
| A.a、b两点关于pH=7对称 |
| B.滴加过程中,c(CH3COO-)逐渐增大 |
| C.V(NH3·H2O)=10mL时,溶液中c(CH3COO-)=c(CH3COOH) |
D.V(NH3·H2O)=30mL时,溶液中c(CH3COO-)>c( ) ) |
您最近一年使用:0次
2021-05-08更新
|
156次组卷
|
2卷引用:安徽省马鞍山市2021届高三第三次教学质量检测理综化学试题
名校
解题方法
10 . 25℃时,重水(D2O)的离子积为 1.6×10ˉ15,也可用与 pH 一样的定义来规定其酸碱度:pD=-lgc(D+),下列叙述正确的是(均为 25℃条件下)
| A.重水和水两种液体,D2O 的电离度大于 H2O |
| B.在 100mL0.25mol·Lˉ1DCl 重水溶液中,加入 50mL0.2mol·Lˉ1NaOD 重水溶液,反应后溶液的 pD=1 |
| C.0.01 mol·Lˉ1NaOD 重水溶液,其 pD=12 |
| D.NH4Cl 溶于 D2O 中生成的一水合氨和水合氢离子的化学式为 NH3·D2O 和 HD2O+ |
您最近一年使用:0次
2020-05-21更新
|
552次组卷
|
7卷引用:浙江省嘉兴市2020届高三年级教学质量评估化学试题
浙江省嘉兴市2020届高三年级教学质量评估化学试题四川省雅安中学2019-2020学年高二6月月考(期中)理综化学试题浙江省杭州高级中学2021届高三上学期期中考试化学试题(已下线)【浙江新东方】116湖北随州市第一中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】高中化学20210513-042【2021】【高二下】四川省宜宾市叙州区第二中学校2021-2022学年高二下学期期中考试化学试题



